
- •1. Физическая химия: цель, задачи, методы исследования. Основные понятия физической химии.
- •3 .Следствия первого начала термодинамики ( изохорный и изобарный процессы). Способы записи теплот химических реакций.
- •4. Закон Гесса, его следствия. Взаимосвязь между тепловым эффектом химической реакции при постоянном объеме и давлении.
- •7. Зависимость тепловых эффектов химических реакций от температуры. Уравнение Киргоффа. Определение реакции при нестандартной температуре.
- •9. Работа расширения для идеальных газов при адиабатическом процессе. Вывести уравнения адиабат.
- •11. II закон термодинамики для обратимых и необратимых процессов. Свойства энтропии.
- •12.Расчет изменения энтропии для различных физико-химических процессов: нагревание, фазовые переходы, смешение идеальных газов, изобарный, изотермический, изохорныйпроцессы.
- •13. Расчет изменения энтропии реакции при стандартной и нестандартной температурах (на примере реакций с участием неорганических веществ)
- •14.Изохорно-изотермический потенциал, его свойства, применение в качестве критерия направленности процесса.
- •15. Изобарно-изоэнтропийный потенциал, его свойства, применение в качестве критерия направленности процесса.
- •16) Изобарно-изотермический потенциал, его свойства, применение в качестве критерия направленности процесса
- •17. Изохорно-изоэнтропийный потенциал, его свойства, применение в качестве критерия направленности процесса.
- •17. Изохорно-изоэнтропийный потенциал, его свойства, применение в качестве критерия направленности процесса.
- •18) Уравнение Гиббса – Гельмгольца. Определение изменения энергии Гиббса реакции при не стандартной температуре.
- •19) Химический потенциал, определение, условие равновесия в открытых системах. Химический потенциал идеальных и реальных систем (газы, растворы).
- •20) Химическое равновесие, вывод уравнения изотермы химической реакции. Определение стандартного значения константы равновесия реакций.
- •23) Влияние температуры на константу равновесия, вывод уравнения изобары Вант- Гоффа. Принцип Ле- Шателье.
- •25) Расчёт теп.Эф х.Р. На основе изобары Вант-Гоффа (расчётный и граф. Способы).
- •26) Расчёт теп.Эф х.Р. На основе изохоры Вант-Гоффа (расчётный и граф. Способы).
- •27)Фазовые равновесия основные опр-я:
- •28)Равновесие чис-го в-ва в 2-х фазах одноком.Сис-мы.
- •29) Определение теплоты спарение расчетным и графическим способами на основе уравнения Клаузиуса – Клапейрона.
- •30) Гетерогенное равновесие. Бинарные системы. Законы Рауля. Законы Коновалова.
- •31) Основные понятия химической кинетики: скорость, механизм реакции.
- •32) Основной постулат химической кинетики. Гомогенные, гетерогенные реакции. Порядок и молекулярность реакции, отличая между ними.
- •33) Влияние концентрации на скорость химической реакции. Физический смысл, размерность константы скорости.
- •34) Кинетический анализ необратимых реакций первого порядка в закрытых системах.
- •35) Кинетический анализ необратимых реакций второго порядка в закрытых системах.
- •36) Кинетический анализ необратимых реакций нулевого порядка в закрытых системах.
- •37)Реакции 3-ого порядка
- •41. Влияние температуры на скорость химической реакции, правило Вант-Гоффа, закон Аррениуса.
- •42. Энергия активации, ее физический смысл. Методы определения энергии активации.
- •43.Катализ, основные свойства катализатора
- •44. Биогенные каталитические реакции. Кинетический анализ гомогенной каталитической реакции.
- •45. Электрохимия, особенности электрохимических реакций.
- •48. Приближения теории Дебая – Гюккеля, их концентрационные пределы применимости.
- •49) Основы теории электролитической диссоциации
- •50) Основные достоинства и недостатки тэд Аррениуса. Энергия кристаллической решетки, энергия сольватации.
- •51) Свойства буферных растворов, определение их рН, буферная емкость, диаграмма.
- •52) Определение рН гидратообразования и произведения растворимости гирооксидов металлов.
- •53. Удельная электропроводность растворов электролитов, зависимость от температуры и концентрации.
- •54. Молярная электропроводность. Закон Кольрауша. Определение молярной электропроводности при бесконечном разбавлении растворов сильных и электролитов.
- •55. Молярная электропроводность. Влияние температуры и концентрации на молярную электропроводность растворов сильных и слабых электролитов.
- •56. Электролиз, законы электролиза. Электролиз водных растворов солей с инертным анодом (привести пример).
- •57. Определение стандартного значения электродных потенциалов. Уравнение Нернста для определения эдс цепей.
- •58. Классификация электродов, правила записи электродов и цепей.
- •59.Химические цепи(гальванический элемент), их классификация.
- •60.Гальванический элемент. Термодинамика гальванического элемента.
20) Химическое равновесие, вывод уравнения изотермы химической реакции. Определение стандартного значения константы равновесия реакций.
Хим равновесие состояние си-мы в кот-й протекают хим реакции, но: 1) количество вещетсв не зависит от времени,2) отсутствуют потоки массы и энергии. Равновесие называют гомогенным, если реагирующие вещества наход-ся в одной фазе. И гетерогенными если они распределены по нескольким фазам. N2+3H22NH3, Ѵ1=Ѵ2( химическое равновесие)
Основная задача теории хим равновесия исходя из экспериментальных (справочных) данных при произвольных температуре и давлении предсказать равновесный состав сложных смесей веществ в которых может протекать большое число хим реакций.
Условия равновесия. Хим равновесие характеризуется в основном общими условиями: 1) равенство 0 всех термодинамических функций при соответствующих условиях. 2) динамическим равновесием. 3) подвижным равновесием(с изменением параметров равновесия, равновесие изменяется соответствующим образом. При прекращении действия параметров равновесия возвращается в исходное состояние. 4)Равновесие может быть достигнуто с двух сторон, со стороны увеличения или уменьшения соответствующих параметров.
Основной количественный закон хим равновесия это закон действующих масс (ЗДМ) применяется для гомогенных равновесных систем. Рассмотрим в общем виде гомогенную хим реакцию.
aA+bBmM+nN (1)
Изменение энергии Гиббса для данной хим реакции
∆G=m(GM)+n(GN)-a(GA)-b(GB) (2)
Изменение для общего i-го изменения
dG(i)=VdP(i)-SidT (3)
T=const, dT=0
dGi=VdPi (4)
PV=RT => V=RT/P
dGi=RT =RTlnPi
(5)
=RTlnPi
(5)
проинтегрируем ур (5)в пределах стандартного состояния газа на начала реакции
(G0(i),P0i) (G(i),P0(i))
 (i)=
(i)= lnP(i)
(6)
lnP(i)
(6)
G(i)-G0i=RTln (7)
(7)
Давление газа в стандартном состоянии равна 1атм.
G(i)=G0i+RTlnP0(i) (8)
P0(i)- парциальное давление i-го участника реакции на начало реакции. С учетом ур(8), ур (2) будет выглядеть
∆G=m(G0 M)+m RTlnP0(M) +n(G0 N)+ nRTlnP0(N) -a(G0 A)-a RTlnP0(A) -b(G0 B) - bRTlnP0(B) (9)
∆G=m(G0
M)+n(G0
N)-a(G0
A)-b(G0
B)
+RTln (10)
(10)
∆G=∆G0+RTln (11)
(11)
Если в хим реакции имеет место состояния равновесия тогда ∆G будет равно 0, но парциальные давления будут иметь равновесные значения
∆G0=-RTln (12)
(12)
 Кр
(13)(константа
равновесия )
Кр
(13)(константа
равновесия )
Т.о константа равновесия любой гомогенной хим реакции протекающей в газовой фазе равна произведению равновесных парциальных давлений продуктов реакций деленному на произведение равновесных парциальных давлений исходных веществ в степенях соответствующих стехиометрическим коэф-м участников реакций.
С учетом ур (13) ур (12) можно записать ∆G0=-RTlnКр (14)
С учетом ур (14) ур
(11) примет вид ∆G=-RTln (15)
(15)
Ур (11), (15) называются ур изотермы Вант-Гоффа, еще записывается для идеального газа через парциальные давления
∆G=-RTlnКр+RTlnПр'
Вывод: Величина константы равновесия зависит только от температуры и природы участников реакции. От ∆G,зависит от исходных концнтраций (активностей) или давлений( летучистей).
∆G=-RTlnКf+RTlnПf для реальных газовых систем
∆G=-RTlnКс+RTlnПс для идеальных растворов
∆G=-RTlnКm+RTlnПm
∆G=-RTlnКN+RTlnПN
∆G=-RTlnКA+RTlnA реальных растворов.
Ур-е изотермы хим реакции и направление реакции.
∆G=-RTlnКр+RTlnПр'
∆G<0 тогда lnПP'<lnKp реакция идет в прямом направлении
∆G=0 тогда lnПP'=lnKp реакция идет как в прямом так и в обратном направлении
∆G>0 тогда lnПP'>lnKp реакция идет в обратном направлении
Способы выражения константы равновесия
Константа равновесия гомогенной хим реакции протекающей в газовой фазе
aA+bBmM+nN (22)
KP=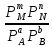 (23)
(23)
Поскольку ур (23) выведено из предложения , что каждый компонент хим реакции представляет собой идеальный газ. Тогда для любого участника реакции справедливо:
PiV=niRT => Pi= niRT/V => ni/V=Ci => Pi=CiRT (24)
Учитывая (24), ур (23) можно записать:
KP= (25)
(25)
KP= (RT)m+n-a-b==
(RT)m+n-a-b== (RT)∆n
(26)
(RT)∆n
(26)
Обозначим KС= (27)
(27)
Ур (27) выражает константу равновесия ур (22) выраженную через малярную концентрацию реагирующих компонентов.
КР=кС(RT)∆n (28)
Каждый компонент идеальной газовой смеси подчиняется закону Дальтону.
Pi=XiPобщ (29)
Xi- молярная доля i-го компонента газовой смеси
Pобщ-общее давление газа в си-ме
Подставляем ур (29) в ур (23)
Кр= (30)
(30)
KP= Робщ
m+n-a-b=
Робщ
m+n-a-b=
 Робщ
∆n
(31)
Робщ
∆n
(31)
KX=
Ур (32) выражает константу равновесия через равновесные молярные доли.
Сравнивая ур (32) (31) (28), дает следующие соотношения
КР=кС(RT)∆n =KXPобщ∆n (33)
Ур (33) выражает связь между константами равновесия для любой хим реакции которые выражены через различные равновесные концентрации, если реакция протекает без изменения числа молей газообразных участников реакции , тогда ∆n=0
КР= кС=KX (34)
21. Константа
равновесия при различных способах
выражения состава реакционной смеси,
связь между ними. Расчет константы
равновесия для реакций с изменением
числа молей в системе (А+В
 C
и A
C
и A B+C).
B+C).
Состояние химического равновесия определяется двумя признаками:
если система находится в состоянии равновесия, то состав её с течением времени при постоянных внешних условиях не изменяется.
если система, находящаяся в равновесии, будет выведена из этого состояния вследствие внешних воздействий, то с прекращением их действия она возвратится в прежнее состояние. Другими словами, химическое равновесие является подвижным, динамическим.
Состав равновесной смеси характеризуется тем, что в ней концентрации исходных веществ и концентрации конечных веществ находятся между собой в определенном соотношении. Эти соотношения определяются законом действующих масс. Константу равновесия можно выразить через равновесные парциальные давления системы
КР
= .
.
Для смеси идеальных газов закон действующих масс можно записать с помощью константы равновесия КР, Кс или Кх, выраженных через различные величины: парциальные давления реагентов Рi, молярные концентрации сi или молярные доли хi. Во всех случаях получается величина, не зависящая от соотношения реагентов в равновесной смеси и имеющая постоянное значение при постоянной температуре. Между КР, Кс и Кх для смеси идеальных газов существует взаимосвязь. Математическое выражение её выводится с использованием уравнения Клапейрона-Менделееева. Эти выражения имеют следующий вид:
КР = Кс(RT)Dn , где Dn = n1 + n2 - n3 - n4 – изменение числа молей в ходе реакции, или КР = КхРDn .
Эти формулы показывают, что в общем случае числовые значения КР, Кс и Кх не совпадают. Совпадение наблюдается лишь для реакций, идущих без изменения числа молей.
Конста́нта равнове́сия — величина, определяющая для данной химической реакции соотношение между термодинамическими активностями (либо, в зависимости от условий протекания реакции, парциальными давлениями, концентрациями или фугитивностями) исходных веществ и продуктов в состоянии химического равновесия (в соответствии с законом действующих масс).
Константы равновесия
гомогенной хим. р-ии, протекающей в
газовой фазе будет выражена через
парциальное давление: аА+вВ= mM+nN
Кр= (1).
Это ур-е показывает, что каждый компонент
представляет собой идеальный газ, тогда
для любого участка р-ии справедливо:
PiV=niRT.
Pi=niRT/V.
ni/V=ci.
Pi=Ci*RT
(2), учитывая это уравнение, тогдаможно
записать: Кр=
(1).
Это ур-е показывает, что каждый компонент
представляет собой идеальный газ, тогда
для любого участка р-ии справедливо:
PiV=niRT.
Pi=niRT/V.
ni/V=ci.
Pi=Ci*RT
(2), учитывая это уравнение, тогдаможно
записать: Кр= (3)
(3)
(4) Kc= через
молярную конц-ю реагирующих
компонентов.ТогдаKp=
Kc-
через
молярную конц-ю реагирующих
компонентов.ТогдаKp=
Kc- (5).
Каждый компонент идеальной газовой
системы подчиняется закону Дальтона:
Pi=Xi
(5).
Каждый компонент идеальной газовой
системы подчиняется закону Дальтона:
Pi=Xi (6).
Xi
молярная доля i-го компонента в газовой
смеси,
(6).
Xi
молярная доля i-го компонента в газовой
смеси,
 -
общ. давление газа в системе. Подставляя
ур-е (6) в ур.е (1) получаем: Kp=
-
общ. давление газа в системе. Подставляя
ур-е (6) в ур.е (1) получаем: Kp= (7)
(7)
Kp= (8)
(8)
Kx=
 (9)-
это ур-е выражает константу равновесия
через равновесные молярные доли. Сравнив
ур-я (9),(8), (5)- дает соотношение: Kp=Kc*
(9)-
это ур-е выражает константу равновесия
через равновесные молярные доли. Сравнив
ур-я (9),(8), (5)- дает соотношение: Kp=Kc* (10). Это ур-е выражает связь между
константами равновесия для любой хим.
р-ии, кот. Выражены через различные
равновесные конц-ии.
(10). Это ур-е выражает связь между
константами равновесия для любой хим.
р-ии, кот. Выражены через различные
равновесные конц-ии.
2) Р-ии протек-е с изменением числа молекул:
а) А+ В= С

 +1-
+1- +
+ =2-
=2-
1 1 -
1- 1-
1-

NA= NB=
NB= NC=
NC=

 Pc=
Pc=


Б) А= С +Д
1 - -
1-


 =1-
=1- +
+ +
+ =1+
=1+
 =
=
 Nc=
Nc= Nd=
Nd=
Pa= Pc=
Pc= Pd=
Pd=
Kp=
22. Химическое равновесие. Расчет константы равновесия для р-й без изменения числа молей в системе (А+В= С+Д и А=В).
Состояние химического равновесия определяется двумя признаками:
если система находится в состоянии равновесия, то состав её с течением времени при постоянных внешних условиях не изменяется.
если система, находящаяся в равновесии, будет выведена из этого состояния вследствие внешних воздействий, то с прекращением их действия она возвратится в прежнее состояние. Другими словами, химическое равновесие является подвижным, динамическим.
Состав равновесной смеси характеризуется тем, что в ней концентрации исходных веществ и концентрации конечных веществ находятся между собой в определенном соотношении. Эти соотношения определяются законом действующих масс. Константу равновесия можно выразить через равновесные парциальные давления системы
КР
= .
.
Для смеси идеальных газов закон действующих масс можно записать с помощью константы равновесия КР, Кс или Кх, выраженных через различные величины: парциальные давления реагентов Рi, молярные концентрации сi или молярные доли хi. Во всех случаях получается величина, не зависящая от соотношения реагентов в равновесной смеси и имеющая постоянное значение при постоянной температуре. Между КР, Кс и Кх для смеси идеальных газов существует взаимосвязь. Математическое выражение её выводится с использованием уравнения Клапейрона-Менделееева. Эти выражения имеют следующий вид:
КР = Кс(RT)n , где n = n1 + n2 - n3 - n4 – изменение числа молей в ходе реакции, или КР = КхРn .
Эти формулы показывают, что в общем случае числовые значения КР, Кс и Кх не совпадают. Совпадение наблюдается лишь для реакций, идущих без изменения числа молей.Химическое равновесие — состояние химической системы, в котором обратимо протекает одна или несколько химических реакций, причём скорости в каждой паре прямая-обратная реакция равны между собой.
Для системы, находящейся в химическом равновесии, концентрации реагентов, температура и другие параметры системы не изменяются со временем.А2 + В2 ⇄ 2AB.
Отсутствуют потоки массы и энергии.
Равновесие:
гомогенное, гетерогенное. Гомогенное,
если все реаг-е в-ва находятся в одной
фазе. Гетерогенное, если они распределены
по нескольким фазам:

Тут: V1=V2 (выражается хим. равновесие).
Основная задача теории хим. равновесия, исходя из справочных данных при использовании температуры и давл., предсказать равновесное состояние сложных смесей в-в, в кот. Может протекать большое число хим. р-й.
Хим. равновесие характеризуется в основном общими условиями: 1)Равенством 0 всех термодин-х ф-й при сообтветствующих условиях. 2) динамич-м равновесием. 3) подвижным равновесием ( с изменением параметров равновесия), равновесие изменяется соответствующим образом, при прекращении действия параметров, равновесие возвращается в исходное состояние. Равновесие может быть достигнуто с 2х сторон, со стороны уменьшения или увеличения соответствующих параметров.
Основной колич-й закон хим. равновесия-это зак. действующих масс: Закон действующих масс в кинетической форме (основное уравнение кинетики) гласит, что скорость элементарной химической реакции пропорциональна произведению концентраций реагентов в степенях, равных стехиометрическим коэффициентам в уравнении реакции . Этот закон применим для гомогенных равновесных систем. аА+вВ=mM+nN (1)
Изменение энергии
Гиббса для данной хим. р-ии будет:
 )
(2)
)
(2)
Изменение энерг. Гиббса для общего участка компонента: dG(i)=VdP(i)-SidT (3)
Если р-я протекает при пост. Температуре, тогда dT=0. dG(i)=VdPi (4).
Если для идеальн. Газов:PV=RT, V=RT/P, dGi=RT*dPi/Pi=RTlnPi (5)
Давл. Газа в станд.
Сост.= 1атм, тогда для каждого участка
р-ии получим ур-е: Gi= (6)
(6)
Poi-это
парциальное давление i-го участка р-ии
на начало р-ии. C
учетом этого ур-я: (7).
(7).
Если в хим. р-ии
имеет место сост-е хим. равновесия,
тогда
 .
. (8) P (A,B,M,N)-
парциальное давление,m,n,a,b-
коэф-ты.
(8) P (A,B,M,N)-
парциальное давление,m,n,a,b-
коэф-ты.
 -
равновесия. Ур-е закона действующих
масс.
-
равновесия. Ур-е закона действующих
масс.
2)Без изменения числа молей.1) A+ B= C+ D
1 1 - -
1- 1-
1-




NA= NB=
NB= Nc=
Nc= Nd=
Nd=
Pa= PB=
PB= Pc=
Pc= Nc
PD=
Nc
PD=
Kp=
