
- •1. Физическая химия: цель, задачи, методы исследования. Основные понятия физической химии.
- •3 .Следствия первого начала термодинамики ( изохорный и изобарный процессы). Способы записи теплот химических реакций.
- •4. Закон Гесса, его следствия. Взаимосвязь между тепловым эффектом химической реакции при постоянном объеме и давлении.
- •7. Зависимость тепловых эффектов химических реакций от температуры. Уравнение Киргоффа. Определение реакции при нестандартной температуре.
- •9. Работа расширения для идеальных газов при адиабатическом процессе. Вывести уравнения адиабат.
- •11. II закон термодинамики для обратимых и необратимых процессов. Свойства энтропии.
- •12.Расчет изменения энтропии для различных физико-химических процессов: нагревание, фазовые переходы, смешение идеальных газов, изобарный, изотермический, изохорныйпроцессы.
- •13. Расчет изменения энтропии реакции при стандартной и нестандартной температурах (на примере реакций с участием неорганических веществ)
- •14.Изохорно-изотермический потенциал, его свойства, применение в качестве критерия направленности процесса.
- •15. Изобарно-изоэнтропийный потенциал, его свойства, применение в качестве критерия направленности процесса.
- •16) Изобарно-изотермический потенциал, его свойства, применение в качестве критерия направленности процесса
- •17. Изохорно-изоэнтропийный потенциал, его свойства, применение в качестве критерия направленности процесса.
- •17. Изохорно-изоэнтропийный потенциал, его свойства, применение в качестве критерия направленности процесса.
- •18) Уравнение Гиббса – Гельмгольца. Определение изменения энергии Гиббса реакции при не стандартной температуре.
- •19) Химический потенциал, определение, условие равновесия в открытых системах. Химический потенциал идеальных и реальных систем (газы, растворы).
- •20) Химическое равновесие, вывод уравнения изотермы химической реакции. Определение стандартного значения константы равновесия реакций.
- •23) Влияние температуры на константу равновесия, вывод уравнения изобары Вант- Гоффа. Принцип Ле- Шателье.
- •25) Расчёт теп.Эф х.Р. На основе изобары Вант-Гоффа (расчётный и граф. Способы).
- •26) Расчёт теп.Эф х.Р. На основе изохоры Вант-Гоффа (расчётный и граф. Способы).
- •27)Фазовые равновесия основные опр-я:
- •28)Равновесие чис-го в-ва в 2-х фазах одноком.Сис-мы.
- •29) Определение теплоты спарение расчетным и графическим способами на основе уравнения Клаузиуса – Клапейрона.
- •30) Гетерогенное равновесие. Бинарные системы. Законы Рауля. Законы Коновалова.
- •31) Основные понятия химической кинетики: скорость, механизм реакции.
- •32) Основной постулат химической кинетики. Гомогенные, гетерогенные реакции. Порядок и молекулярность реакции, отличая между ними.
- •33) Влияние концентрации на скорость химической реакции. Физический смысл, размерность константы скорости.
- •34) Кинетический анализ необратимых реакций первого порядка в закрытых системах.
- •35) Кинетический анализ необратимых реакций второго порядка в закрытых системах.
- •36) Кинетический анализ необратимых реакций нулевого порядка в закрытых системах.
- •37)Реакции 3-ого порядка
- •41. Влияние температуры на скорость химической реакции, правило Вант-Гоффа, закон Аррениуса.
- •42. Энергия активации, ее физический смысл. Методы определения энергии активации.
- •43.Катализ, основные свойства катализатора
- •44. Биогенные каталитические реакции. Кинетический анализ гомогенной каталитической реакции.
- •45. Электрохимия, особенности электрохимических реакций.
- •48. Приближения теории Дебая – Гюккеля, их концентрационные пределы применимости.
- •49) Основы теории электролитической диссоциации
- •50) Основные достоинства и недостатки тэд Аррениуса. Энергия кристаллической решетки, энергия сольватации.
- •51) Свойства буферных растворов, определение их рН, буферная емкость, диаграмма.
- •52) Определение рН гидратообразования и произведения растворимости гирооксидов металлов.
- •53. Удельная электропроводность растворов электролитов, зависимость от температуры и концентрации.
- •54. Молярная электропроводность. Закон Кольрауша. Определение молярной электропроводности при бесконечном разбавлении растворов сильных и электролитов.
- •55. Молярная электропроводность. Влияние температуры и концентрации на молярную электропроводность растворов сильных и слабых электролитов.
- •56. Электролиз, законы электролиза. Электролиз водных растворов солей с инертным анодом (привести пример).
- •57. Определение стандартного значения электродных потенциалов. Уравнение Нернста для определения эдс цепей.
- •58. Классификация электродов, правила записи электродов и цепей.
- •59.Химические цепи(гальванический элемент), их классификация.
- •60.Гальванический элемент. Термодинамика гальванического элемента.
18) Уравнение Гиббса – Гельмгольца. Определение изменения энергии Гиббса реакции при не стандартной температуре.
Характеристической функцией называется термодинамическая функция, посредством которой или ее производных могут быть выражены в явном виде термодинамические свойства си-мы (p,V,T,S и др.).
Рассмотрим энергию Гиббса как функцию температуры и давления: G=f(T,p),
а энергию Гельмгольца как функцию температуры и объема: F=f(T,V).
Выразим полный дифференциал функции G и F через частные производные:
dG≤-SdT+Vdp (1)
dF≤-SdT-pdV (2)
dG= PdT+
PdT+ Tdp;
(3)
Tdp;
(3)
dF= VdT+
VdT+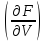 TdV.
(4)
TdV.
(4)
Сравнивая уравнения (1) с (3) и (2) с (4) для состояния равновесия си-мы, получаем
 P=-S;
P=-S;
 T=V;
(5)
T=V;
(5)
 V=-S;
V=-S;
 T=-p
(6)
T=-p
(6)
Т.о, частные производные энергии Гиббса по температуре и давлению и частные производные энергии Гельмгольца по температуре и объему равны параметрам S,V или p, т.е эти функции являются характеристическими функциями. Равенства (5) и (6) позволяют вывести ряд важных уравнений химической термодинамики. Приращение энергии Гиббса или энергии Гельмгольца выражается равенствами:
∆ G=∆H-T∆S; (7)
∆F=∆U-T∆S; (8)
Тогда соответственно из (5) и (6) вытекает
 P=-∆S;
(9)
P=-∆S;
(9)
 V=-∆S;
(10)
V=-∆S;
(10)
Подставляя выражения для ∆S из (9) и (10) в (7) и (8), получаем
∆ G=∆H+Т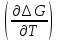 P;
(11)
P;
(11)
∆F=∆U+T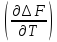 V;
(12)
V;
(12)
Уравнения (11) и (12) называются уравнениями Гиббса-Гельмгольца. Величины ∆ G и ∆F имеют смысл максимальной работы химической реакции, когда она проводится изотермически и обратимым путем, например в электрохимическом элементе.
Вторые слагаемые в правой части уравнений (11) и (12) имеют смысл теплоты обратимого процесса ,т.к
-Т P=T∆S=Qобр;
P=T∆S=Qобр;
-Т V=T∆S=Qобр;
V=T∆S=Qобр;
Величины ∆H и ∆U представляют собой тепловые эффекты химических реакций или физико-химических процессов, когда они осуществляются предельно необратимо. Уравнение Гиббса-Гельмгольца используются, например, для вычисления тепловых эффектов химических реакций по опытным значениям электродвижущих сил электрохимических элементов, для вычисления ∆S и других термодинамических величин.
19) Химический потенциал, определение, условие равновесия в открытых системах. Химический потенциал идеальных и реальных систем (газы, растворы).
При прохождении многих хим. процессов число молей компонентов в си-ме меняется, т.е количество компонентов в си-ме или в фазе могут быть переменными: n1n2n3…….ni
∆G=-S∆T+VdP+f(n1)+f(n2)+……f(ni)
dG=f(T,P, n1n2n3…….ni)
dG= P,nidT+
P,nidT+
 T,nidP+
T,nidP+ P,T,njdn1+
P,T,njdn1+ P,T,njdn2
P,T,njdn2
где ni-это постоянное количество всех компонентов в си-ме, nj-это постоянное количество всех компонентов кроме одного изменение которого рассматривается.
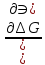 P,T,nj=ϻi
P,T,nj=ϻi
ϻi – химический потенциал i-го компонента.
ϻi – это частная производная в данном случае энергии Гиббса по массе итого компонента при постоянных р и Т и массах остальных компонентов.
ϻi – равно приращению энергии Гиббса при добавлении одного моля итого компонента к большому объему си-мы при постоянстве температуры и давления. Большой объем си-мы это когда состав си-мы почти не изменяется при добавлении 1моля компонента.
∂G= ϻi dni => G= ϻi
dGT,P= ϻ1 dn1+ ϻ2 dn2+…. ϻi dni
dGT,P= P,T
, если
P,T
, если
 P,T
=0, то dGT,P=0
P,T
=0, то dGT,P=0
это общее условие равновесие, при переменном числе компонента и постоянном р,Т.
dGT,P≤0;=>
 P,T
≤0
P,T
≤0
dU=TdS-pdV+ f(n1)+f(n2)+……f(ni)
U= f(S,V, n1n2n3…….ni)
dU= P,V,nidS+
P,V,nidS+ SnidV+
SnidV+ S,V,njdnj+
S,V,njdnj+
 S,V,njdni
S,V,njdni
dH=TdS+VdP+ f(n1)+f(n2)+……f(ni)
H= f(S,P, n1n2n3…….ni)
dH= P,nidS+
P,nidS+ S,nidP+
S,nidP+ S,P,njdn1+
S,P,njdn1+ S,P,njdni.
S,P,njdni.
dF=-SdT-pdV+ f(n1)+f(n2)+……f(ni)
F=f(T,V,n1n2….ni)
dF= V,nidT+
V,nidT+ T,nidV+
T,nidV+ V,T,njdn1+
V,T,njdn1+ V,T,njdni.
V,T,njdni.
dU=TdS-PdV+ idni
idni
dH=
TdS-VdP+ idni
idni
dF=
-SdT-PdV+ idni
idni
dG=
-SdT+VdP+ idni
idni
выражает бесконечно малое изменение U,F,H,G для фазы масса которого может изменятся в результате обмена с др фазами.
ϻi= S,V,nj
S,V,nj
ϻi= S,P,nj
S,P,nj
ϻi= T,V,nj
T,V,nj
ϻi= T,P,nj
T,P,nj
Химический потенциал называется частные производные термодинамического потенциала по числу молей компонента при постоянстве естественных переменных и состава си-мы.
Химический потенциал идеального и реального газа.
∂G=-SdT+VdP
G=f(T,P)
T=const
dG=-SdT+VdP=VdP
PV=nRT =>
V=
dG= dP
dP
G=nRT RϬ,
RϬ-постоянная
интегральная
RϬ,
RϬ-постоянная
интегральная
G=RTLnP+ RϬ (1)
G0=RTLnP0+ RϬ (2)
Отнимем 1ур от 2го
G-G0=RT(LnP-LnP0)
=> G-G0=RTLn
P0=1атм => G-G0=RTLnP => G=G0+RTLnP
G=ϻi => ϻi = ϻi 0+RTLnP
Это ур для определения химического потенциала смеси идеального газа.
Льюис предложил для реальных газов использовать фугитивность( летучесть), т.к до сих пор рассматривались лишь такие си-мы газообразные части которых идеальны, т.е подчиняются уравнению PV=nRT для неидеальных систем все выше рассмотренные термодинамические соотношения не верны.
Предложенное Льюисом, остается в силе и для неидеальных систем, если заменить в них фактически парциальные давления эффективными давлениями(летучесть).
ϻi = ϻi 0+RTLnf, f-летучесть
Летучесть совпадает с давлением если последнее настолько мало, что газ становиться идеальным.
Фугитивностью(летучестью) назыв-ся величина, которую нужно подставить в выраж-е для хим-го потенциала идеального газа, чтобы получить значения реального газа.
ɣ= => ɣ- коэфф фугитивности , отношение
фугитивности к давлению реального
газа, т.е степень отклонения газов от
идеального состояния.
=> ɣ- коэфф фугитивности , отношение
фугитивности к давлению реального
газа, т.е степень отклонения газов от
идеального состояния.
ɣmax=1, безразмерная величина.
Химический потенциал для идеального и реального растворов.
Для ид-го р-ра хим потенц: ϻi = ϻi 0+RTLnmi (моляльная конц)
ϻi = ϻi 0+RTLnM(молярная конц)
ϻi = ϻi 0+RTLnXi(мольная доля)
Активность итого компонента эта величина которую нужно подставить в ур для хим потенц компонента в идеальном растворе чтобы получить действительное значение хим потенциала итого компонента в неидеальном растворе.
ϻi = ϻi 0+RTLnаi
ɣ= => a=ɣc
=> a=ɣc
коэфф. Активности- отношение активности компонента в растворе к его концентрации.
ax = ɣxi Cxi(мольные доли)
am= ɣmi Cmi(моляльность)
aM= ɣMi CMi(молярность)
