
reakcii в водных растворах электролитов
.pdf
ПРИЛОЖЕНИЕ Справочный материал
Таблица 1 - Растворимость веществ в воде (в том числе при подавлении гидролиза)
Катионы |
H+ |
Li+ |
Na+ |
K+ |
NH4+ |
Be2+ |
Mg2+ |
Ca2+ |
|
Sr2+ |
|
Ba2+ |
Al3+ |
Cr3+ |
|
Анионы |
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
OH- |
|
Р |
Р |
Р |
Р |
Р |
Н |
Н |
М |
М |
|
Р |
Н |
Н |
|
Cl- |
|
Р |
Р |
Р |
Р |
Р |
Р |
Р |
Р |
|
Р |
|
Р |
Р |
Р |
Br- |
|
Р |
Р |
Р |
Р |
Р |
Р |
Р |
Р |
|
Р |
|
Р |
Р |
Р |
I- |
|
Р |
Р |
Р |
Р |
Р |
Р |
Р |
Р |
|
Р |
|
Р |
Р |
Р |
SCN- |
|
Р |
Р |
Р |
Р |
Р |
Р |
Р |
Р |
|
Р |
|
Р |
Р |
Р |
CN- |
|
Р |
Р |
Р |
Р |
Р |
г |
г |
Р |
|
Р |
М |
г |
Н |
|
CO32- |
|
М |
М |
Р |
Р |
Р |
М |
Мг |
Н |
Н |
Н |
г |
г |
||
HCO3- |
|
М |
Р |
Р |
Р |
Р |
- |
Р |
Р |
|
Р |
|
Р |
- |
- |
SiO32- |
|
Н |
Р |
Р |
Р |
- |
Н |
Н |
Н |
|
Н |
|
Н |
Н |
Н |
NO2- |
|
Р |
Р |
Р |
Р |
Р |
г |
Р |
Р |
|
Р |
|
Р |
г |
г |
NO3- |
|
Р |
Р |
Р |
Р |
Р |
Р |
Р |
Р |
|
Р |
|
Р |
Р |
Р |
CH3COO- |
|
Р |
Р |
Р |
Р |
Р |
М |
Р |
Р |
|
Р |
|
Р |
М |
Р |
HCOO- |
|
Р |
Р |
Р |
Р |
Р |
Р |
Р |
Р |
|
Р |
|
Р |
Р |
Р |
PO43- |
|
Р |
М |
Р |
Р |
Р |
Н |
Н |
Н |
Н |
Н |
Н |
Н |
||
AsO43- |
|
Р |
Р |
Р |
Р |
Р |
Н |
Н |
М |
|
М |
|
М |
Н |
Н |
S2- |
|
Р |
Р |
Р |
Р |
Р |
г |
Мг |
М |
Р |
Р |
г |
г |
||
SO32- |
|
Р |
Р |
Р |
Р |
Р |
М |
М |
Н |
Н |
М |
г |
г |
||
SO42- |
|
Р |
Р |
Р |
Р |
Р |
Р |
Р |
М |
М |
Н |
Р |
Р |
||
SeO32- |
|
Р |
Р |
Р |
Р |
Р |
|
М |
М |
|
М |
|
|
г |
г |
SeO42- |
|
Р |
Р |
Р |
Р |
Р |
Р |
Р |
|
|
Н |
|
М |
Р |
Р |
ClO4- |
|
Р |
Р |
Р |
М |
Р |
Р |
Р |
Р |
|
Р |
|
Р |
Р |
Р |
MnO4- |
|
Р |
Р |
Р |
Р |
Р |
Р |
Р |
Р |
|
Р |
|
Р |
Р |
Р |
CrO42- |
|
Р |
Р |
Р |
Р |
Р |
|
Р |
Р |
|
М |
|
Н |
|
|
Р – вещество растворимо в воде (более 1 г на 100 г раствора) |
|
|
|
|
|
||||||||||
М - вещество малорастворимо в воде (0,001 – 1 г на 100 г раствора) |
|
|
|||||||||||||
Н - вещество нерастворимо в воде (менее 0,01 г на 100 г раствора) |
|
|
|
||||||||||||
Нг, Мг – |
вещество образует осадок основных солей вследствие гидролиза |
|
|||||||||||||
М , Р - при выделении из раствора вещество разлагается г – вещество необратимо гидролизуется Д – вещество диспропорционирует при контакте с водой ? – существование вещества сомнительно - - вещество не существует
□– данные отсутствуют
Использованы данные Тугашева К.
31
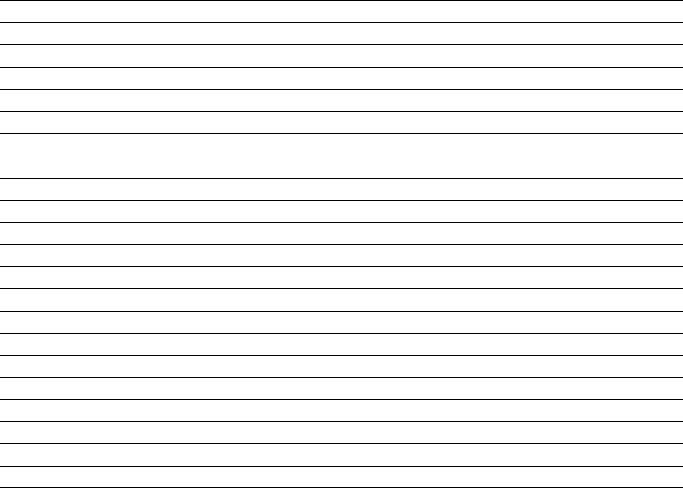
продолжение Таблицы 1 - Растворимость веществ в воде (в том числе при подавлении гидролиза)
Катионы |
Mn2+ |
Fe2+ |
Fe3+ |
Co2+ |
Ni2+ |
Cu2+ |
Zn2+ |
Cd2+ |
Ag+ |
Pb2+ |
Sn2+ |
In3+ |
|
Анионы |
|
||||||||||||
OH- |
|
Н |
Н |
Н |
Н |
Н |
Н |
Н |
Н |
- |
Н |
Н |
Н |
Cl- |
|
Р |
Р |
Р |
Р |
Р |
Р |
Р |
Р |
Н |
М |
Р |
Р |
Br- |
|
Р |
Р |
Р |
Р |
Р |
Р |
Р |
Р |
Н |
М |
Р |
Р |
I- |
|
Р |
Р |
Д |
Р |
Р |
Д |
Р |
Р |
Н |
М |
М |
Р |
SCN- |
|
Р |
Р |
Р |
Р |
Р |
Н |
Р |
Р |
Н |
М |
Р |
Р |
CN- |
|
Н |
Н |
Н |
Н |
Н |
Н |
Н |
Р |
Н |
М |
г |
Н |
CO32- |
|
Н |
Н |
г |
Нг |
Нг |
Нг |
Нг |
Н |
Н |
Н |
г |
г |
HCO3- |
|
Р |
Р |
- |
Р |
Р |
|
Р |
Р |
|
Р |
- |
- |
SiO32- |
|
Н |
Н |
Н |
Н |
Н |
Н |
Н |
М |
Н |
Н |
г |
Н |
NO2- |
|
Р |
Р |
г |
Р |
Р |
Р |
Р |
Р |
М |
Р |
г |
|
NO3- |
|
Р |
Р |
Р |
Р |
Р |
Р |
Р |
Р |
Р |
Р |
Р |
Р |
CH3COO- |
|
Р |
Р |
Р |
Р |
Р |
Р |
Р |
Р |
М |
Р |
|
Р |
HCOO- |
|
Р |
Р |
Р |
Р |
Р |
Р |
Р |
Р |
Р |
Р |
Р |
Р |
PO43- |
|
Н |
Н |
М |
Н |
Н |
Н |
Н |
Н |
Н |
Н |
Н |
Н |
AsO43- |
|
Н |
Н |
Н |
Н |
Н |
Н |
Н |
Н |
Н |
М |
Н |
Н |
S2- |
|
Н |
Н |
Д |
Н |
Н |
Н |
Н |
Н |
Н |
Н |
Н |
Н |
SO32- |
|
Н |
М |
Д |
Н |
Н |
Н |
М |
М |
М |
Н |
г |
|
SO42- |
|
Р |
Р |
Р |
Р |
Р |
Р |
Р |
Р |
М |
Н |
Р |
Р |
SeO32- |
|
Н |
|
Н |
Н |
М |
М |
М |
М |
Н |
Н |
|
|
SeO42- |
|
Р |
Р |
Р |
Р |
Р |
Р |
Р |
Р |
|
Н |
Р |
Р |
ClO4- |
|
Р |
Р |
Р |
Р |
Р |
Р |
Р |
Р |
Р |
Р |
Р |
Р |
MnO4- |
|
Р |
Р |
Р |
Р |
Р |
Р |
Р |
Р |
М |
Р |
Р |
Р |
CrO42- |
|
Н |
|
|
Н |
Н |
М |
М |
Н |
Н |
Н |
|
|
Р – вещество растворимо в воде (более 1 г на 100 г раствора) |
|
|
|
|
|||||||||
М - вещество малорастворимо в воде (0,001 – 1 г на 100 г раствора) |
|
|
|
||||||||||
Н - вещество нерастворимо в воде (менее 0,01 г на 100 г раствора) |
|
|
|
||||||||||
Нг, Мг – |
вещество образует осадок основных солей вследствие гидролиза |
|
|
||||||||||
М , Р - при выделении из раствора вещество разлагается г – вещество необратимо гидролизуется Д – вещество диспропорционирует при контакте с водой ? – существование вещества сомнительно - - вещество не существует □ – данные отсутствуют
32

Таблица 2 - Константы диссоциации кислот
Кислота |
Формула |
Азотистая |
HNO2 |
Азотная |
HNO3 |
Алюминиевая |
HAlO2 |
Борная (мета) |
HBO2 |
Борная (орто) |
H3BO3 |
|
|
Тетраборная |
H2B4O7 |
|
|
Бромноватая |
HBrO3 |
Бромноватистая |
HBrO |
Бромоводородная |
HBr |
Вода |
Н2О |
Водорода пероксид |
H2O2 |
Германиевая |
H2GeO3 |
|
|
Йодная (мета) |
HIO4 |
Йодная (орто) |
H5IO6 |
|
|
Йодноватая |
HIO3 |
Йодноватистая |
HIO |
Йодоводородная |
HI |
Кремниевая (мета) |
H2SiO3 |
|
|
Кремниевая (орто) |
H4SiO4 |
|
|
Марганцовая |
HMnO4 |
Марганцовистая |
H2MnO4 |
Молибденовая |
H2MoO4 |
Муравьиная |
НСООН |
Мышьяковая (орто) |
H3AsO4 |
|
|
Мышьяковистая (орто) |
H3AsO3 |
|
|
|
33 |
Ка (Кк) |
рКа (рКк) |
|
5,13·10-4 |
3,29 |
|
2,69·10 |
-1,43 |
|
4,00·10-13 |
12,40 |
|
7,50·10-10 |
9,12 |
|
(I) |
5,80·10-10 |
9,24 |
(II) |
1,80·10-13 |
12,74 |
(III) |
1,60·10-14 |
13,80 |
(I) 1,00·10-4 |
4,00 |
|
(II) |
1,00·10-9 |
9,00 |
2,00·10-1 |
0,70 |
|
2,06·10-9 |
8,70 |
|
1,00·109 |
-9,00 |
|
1,82·10-16 |
15,74 |
|
2,40·10-12 |
11,62 |
|
(I) |
1,86·10-9 |
8,73 |
(II) |
1,91·10-13 |
12,72 |
2,30·10-2 |
1,64 |
|
(I) |
2,82·10-2 |
1,55 |
(II) |
5,37·10-9 |
8,27 |
(III) |
1,05·10-15 |
14,98 |
1,69·10-1 |
0,77 |
|
2,29·10-11 |
10,64 |
|
1,00·1011 |
-11,00 |
|
(I) |
2,20·10-10 |
9,66 |
(II) |
1,60·10-12 |
11,80 |
(I) |
1,58·10-10 |
9,80 |
(II) |
1,86·10-12 |
11,73 |
(III) |
1,00·10-12 |
12,00 |
(IV) |
2,00·10-14 |
13,70 |
2,00·102 |
-2,30 |
|
(I) |
7,08·10-11 |
10,15 |
(II) 1,00·10-6 |
6,00 |
|
1,78·10-4 |
3,75 |
|
(I) |
5,50·10-3 |
2,26 |
(II) |
1,07·10-7 |
6,97 |
(III) |
3,02·10-12 |
11,52 |
(I) |
5,89·10-10 |
9,23 |
(II) |
7,41·10-13 |
12,13 |
(III) |
3,89·10-14 |
13,41 |

Продолжение таблицы 2 - Константы диссоциации кислот
Кислота |
Формула |
Мышьяковистая (мета) |
HAsO2 |
Оловинная |
H2SnO3 |
Оловянистая |
H2SnO2 |
Роданистоводородная |
HSCN |
Свинцовистая |
H2PbO2 |
Селенистая |
H2SeO3 |
|
|
Селеновая |
H2SeO4 |
|
|
Селеноводородная |
H2Se |
|
|
Серная |
H2SO4 |
|
|
Сернистая |
H2SO3 |
|
|
Сероводородная |
H2S |
|
|
Сурьмяная (орто) |
H3SbO4 |
Сурьмянистая (мета) |
HSbO2 |
Теллуристая |
H2TeO3 |
|
|
Теллуровая (мета) |
H2TeO4 |
|
|
Теллуровая (орто) |
H6TeO6 |
|
|
Теллуроводородная |
H2Te |
|
|
Тиосерная |
H2S2O3 |
|
|
Угольная |
H2CO3 |
|
|
Уксусная |
CH3COOH |
Фосфористая |
H3PO3 |
|
|
Фосфорная (орто) |
H3PO4 |
|
|
Фосфорноватистая |
H3PO2 |
Ка (Кк) |
рКа (рКк) |
|
6,03·10-10 |
9,22 |
|
4,00·10-10 |
9,40 |
|
6,00·10-18 |
17,20 |
|
1,41·10-1 |
0,85 |
|
2,00·10-16 |
15,70 |
|
(I) |
2,45·10-3 |
2,61 |
(II) |
4,79·10-9 |
8,32 |
(I) |
1,00·103 |
-3,00 |
(II) |
1,19·10-2 |
1,66 |
(I) |
1,55·10-4 |
3,81 |
(II) |
1,00·10-11 |
11,0 |
(I) |
1,00·103 |
-3,00 |
(II) |
1,12·10-2 |
1,95 |
(I) |
1,58·10-2 |
1,80 |
(II) |
6,31·10-8 |
7,20 |
(I) |
1,05·10-7 |
6,98 |
(II) |
1,23·10-13 |
12,91 |
4,00·10-5 |
4,40 |
|
1,00·10-11 |
11,00 |
|
(I) |
1,35·10-4 |
3,87 |
(II) |
2,00·10-11 |
10,70 |
(I) |
2,29·10-8 |
7,64 |
(II) |
6,46·10-12 |
11,19 |
(I) |
1,90·10-8 |
7,72 |
(II) |
1,10·10-11 |
10,96 |
(III) |
1,00·10-15 |
15,00 |
(I) |
2,29·10-3 |
2,64 |
(II) |
6,76·10-13 |
12,17 |
(I) |
2,51·10-1 |
0,60 |
(II) |
1,91·10-2 |
1,72 |
(I) |
4,27·10-7 |
6,37 |
(II) |
4,68·10-11 |
10,33 |
1,74·10-5 |
4,76 |
|
(I) |
1,00·10-2 |
2,00 |
(II) |
2,57·10-7 |
6,59 |
(I) |
7,24·10-3 |
2,14 |
(II) |
6,17·10-8 |
7,21 |
(III) |
4,57·10-13 |
12,34 |
7,94·10-2 |
1,10 |
|
34

Продолжение таблицы 2 - Константы диссоциации кислот
Кислота |
Формула |
Пирофосфорная |
H4P2O7 |
Фтороводородная (плавиковая) |
HF |
Хлорная |
HClO4 |
Хлорноватая |
HClO3 |
Хлористая |
HClO2 |
Хлорноватистая |
HClO |
Хлороводородная (соляная) |
HCl |
Хромовая |
H2CrO4 |
|
|
Дихромовая |
H2Cr2O7 |
|
|
Циановодородная (синильная) |
HCN |
Щавелевая |
H2C2O4 |
Ка (Кк) |
рКа (рКк) |
|
(I) |
1,41·10-1 |
0,85 |
(II) |
3,24·10-2 |
1,49 |
(III) |
1,70·10-6 |
5,77 |
(IV) |
6,03·10-9 |
8,22 |
6,67·10-4 |
3,18 |
|
1,00·1010 |
-10,00 |
|
1,00·10 |
-1,00 |
|
1,07·10-2 |
1,97 |
|
2,82·10-8 |
7,55 |
|
1,00·107 |
-7,00 |
|
(I) 9,55 |
-0,98 |
|
(II) |
3,16·10-7 |
6,50 |
(I) 1,00 |
-1,00 |
|
(II) |
2,29·10-2 |
1,64 |
4,93·10-10 |
9,31 |
|
(I) |
6,46·10-2 |
1,19 |
(II) |
6,17·10-5 |
4,21 |
Таблица 3 - Константы диссоциации оснований |
|
|
|
|
|
|
Кb (Ко) |
|
|
Основание |
Формула |
рКb (рКо) |
||
Алюминия гидроксид |
Al(OH)3 |
(I) |
7,41·10-9 |
8,13 |
|
|
(II) |
2,13·10-9 |
8,67 |
|
|
(III) |
1,05·10-9 |
8,98 |
Аммиака гидрат |
NH3·Н2О |
1,78·10-5 |
4,75 |
|
Бария гидроксид |
Ba(OH)2 |
(II) |
2,30·10-1 |
0,64 |
Бериллия гидроксид |
Bе(OH)2 |
(I) |
3,16·10-7 |
6,50 |
|
|
(II) |
5,01·10-9 |
8,30 |
Ванадия (III) гидроксид |
V(OH)3 |
(III) |
8,32·10-12 |
11,08 |
Висмута (III) гидроксид |
Bi(OH)3 |
(I) |
3,09·10-12 |
11,51 |
|
|
(II) |
1,00·10-12 |
12,00 |
|
|
(III) |
3,72·10-13 |
12,43 |
Вода |
Н2О |
1,82·10-16 |
15,74 |
|
Галлия гидроксид |
Ga(OH)3 |
(I) |
1,05·10-10 |
9,98 |
|
|
(II) |
3,24·10-11 |
10,49 |
|
|
(III) |
6,46·10-12 |
11,19 |
Железа (II) гидроксид |
Fe(OH)2 |
(I) |
1,20·10-2 |
1,92 |
|
|
II) |
5,50·10-8 |
7,26 |
35

продолжение таблицы 3 - Константы диссоциации оснований
Основание |
Формула |
Кb (Ко) |
рКb (рКо) |
|
Железа (III) гидроксид |
Fe(OH)3 |
(I) |
4,79·10-11 |
10,32 |
|
|
(II) |
1,82·10-11 |
10,74 |
|
|
(III) |
1,48·10-12 |
11,83 |
Индия гидроксид |
In(OH)3 |
(I) |
1,32·10-9 |
8,88 |
|
|
(II) |
1,74·10-10 |
9,76 |
|
|
(III) |
3,80·10-11 |
10,42 |
Кадмия гидроксид |
Cd(OH)2 |
(I) |
8,13·10-4 |
3,09 |
|
|
(II) |
4,17·10-7 |
6,38 |
Калия гидроксид |
КОН |
|
2,88 |
-0,46 |
Кальция гидроксид |
Ca(OH)2 |
(II) |
5,89·10-2 |
1,23 |
Кобальта (II) гидроксид |
Co(OH)2 |
(I) |
7,94·10-5 |
4,10 |
|
|
(II) |
7,94·10-6 |
5,10 |
Лантана гидроксид |
La(OH)3 |
(III) |
5,01·10-4 |
3,30 |
Лития гидроксид |
LiOH |
4,36·10-1 |
0,36 |
|
Магния гидроксид |
Mg(OH)2 |
(II) 2,63·10-3 |
2,58 |
|
Марганца (II) гидроксид |
Mn(OH)2 |
(II) |
3,89·10-4 |
3,41 |
Меди (II) гидроксид |
Cu(OH)2 |
(I) |
2,19·10-7 |
6,66 |
|
|
(II) |
6,61·10-8 |
7,18 |
Натрия гидроксид |
NaOH |
|
1,51 |
-0,18 |
Никеля (II) гидроксид |
Ni(OH)2 |
(II) |
8,32·10-4 |
3,08 |
Олова (II) гидроксид |
Sn(OH)2 |
(I) |
3,47·10-10 |
9,46 |
|
|
(II) |
1,26·10-12 |
11,90 |
Олова (IV) гидроксид |
Sn(OH)4 |
(I) |
1,66·10-13 |
12,78 |
|
|
(II) |
2,14·10-14 |
13,67 |
Палладия гидроксид |
Pd(OH)2 |
(I) |
2,04·10-13 |
12,69 |
Ртути (II) гидроксид |
Hg(OH)2 |
(I) |
1,12·10-10 |
9,95 |
|
|
(II) |
3,80·10-11 |
10,42 |
Свинца (II) гидроксид |
Pb(OH)2 |
(I) |
5,01·10-4 |
3,30 |
|
|
(II) |
1,41·10-8 |
7,85 |
Серебра гидроксид |
AgOH |
9,77·10-3 |
2,01 |
|
Скандия гидроксид |
Sc(OH)3 |
(I) |
3,16·10-8 |
7,50 |
|
|
(II) |
5,01·10-9 |
8,30 |
|
|
(III) |
4,07·10-10 |
9,39 |
Стронция гидроксид |
Sr(OH)2 |
(II) |
1,48·10-1 |
0,83 |
Титана (IV) гидроксид |
Ti(OH)4 |
(I) |
1,02·10-11 |
10,99 |
|
|
(II) |
3,09·10-13 |
12,51 |
Тория (IV) гидроксид |
Th(OH)4 |
(I) |
3,55·10-11 |
10,45 |
|
|
(II) |
2,40·10-11 |
10,62 |
|
|
(III) |
1,99·10-11 |
10,70 |
|
|
(IV) |
2,29·10-12 |
11,64 |
36

Окончание таблицы 3 - Константы диссоциации оснований |
|
|
||
|
|
Кb (Ко) |
|
|
Основание |
Формула |
рКb (рКо) |
||
Хрома (II) гидроксид |
Cr(OH)2 |
(II) |
3,98·10-8 |
7,40 |
Хрома (III) гидроксид |
Cr(OH)3 |
(II) |
3,55·10-9 |
8,45 |
|
|
(III) |
8,91·10-11 |
10,05 |
Цинка гидроксид |
Zn(OH)2 |
(I) |
1,32·10-5 |
4,88 |
|
|
(II) |
4,90·10-7 |
6,31 |
Циркония (IV) гидроксид |
Zr(OH)4 |
(I) |
6,46·10-14 |
13,19 |
|
|
(II) |
1,62·10-14 |
13,79 |
37
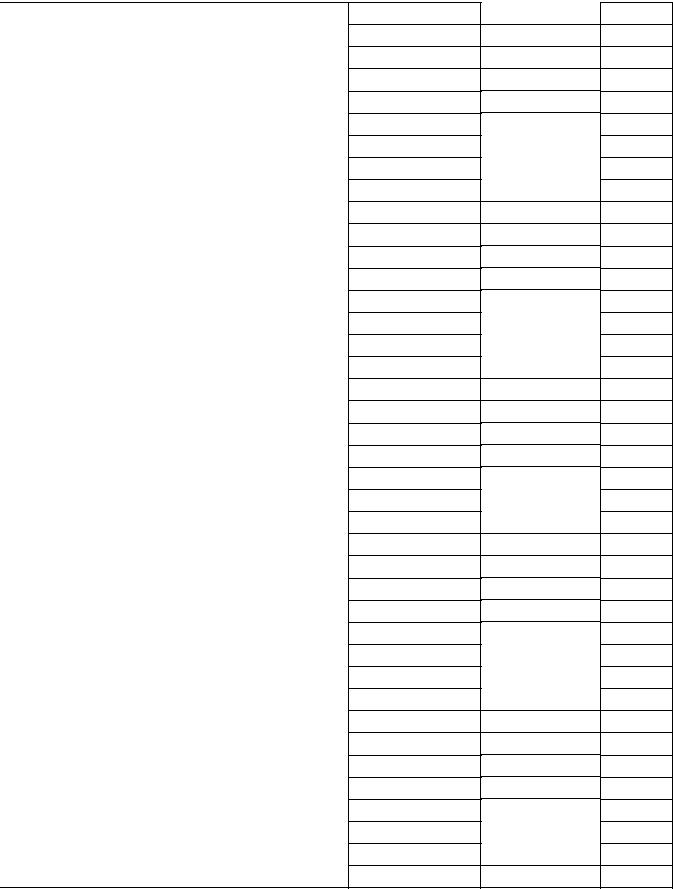
Таблица 4 – Произведение растворимости
Соединение |
ПР |
рПР |
AgBr |
5,30·10-13 |
12,28 |
AgBrO3 |
5,50·10-5 |
4,26 |
AgCN |
1,40·10-16 |
15,84 |
Ag2CO3 |
1,20·10-12 |
11,09 |
AgCl |
1,78·10-10 |
9,75 |
AgClO2 |
2,00·10-4 |
3,70 |
AgClO3 |
5,00·10-2 |
1,30 |
Ag2CrO4 |
1,10·10-12 |
11,95 |
Ag2Cr2O7 |
1,00·10-10 |
10,00 |
AgI |
8,30·10-17 |
16,08 |
AgIO3 |
3,00·10-8 |
7,52 |
AgMnO4 |
1,60·10-3 |
2,79 |
Ag2MoO4 |
2,80·10-12 |
11,55 |
AgNO2 |
6,00·10-4 |
3,22 |
Ag3PO4 |
1,30·10-20 |
19,89 |
AgReO4 |
7,95·10-5 |
4,10 |
Ag2S |
2,00·10-50 |
49,70 |
AgSCN |
1,10·10-12 |
11,97 |
Ag2SO3 |
1,50·10-14 |
13,82 |
Ag2SO4 |
1,60·10-5 |
4,80 |
Ag2SeO3 |
9,80·10-16 |
15,01 |
Ag2SeO4 |
5,60·10-8 |
7,25 |
Al(OH)3 |
1,00·10-32 |
32,00 |
AlPO4 |
5,75·10-19 |
18,24 |
AuBr |
5,00·10-17 |
16,30 |
AuBr3 |
4,00·10-36 |
35,40 |
AuCl |
2,00·10-13 |
12,70 |
AuCl3 |
3,20·10-25 |
24,50 |
AuOH |
7,90·10-20 |
19,10 |
Au(OH)3 |
5,50·10-46 |
45,26 |
AuI |
1,60·10-23 |
22,80 |
AuI3 |
1,00·10-46 |
46,00 |
Ba3(AsO4)2 |
7,80·10-51 |
50,11 |
Ba(BrO3)2 |
5,50·10-6 |
5,26 |
BaCO3 |
4,00·10-10 |
9,40 |
BaCrO4 |
1,20·10-10 |
9,93 |
BaF2 |
1,10·10-6 |
5,98 |
Ba(IO3)2 |
1,50·10-9 |
8,82 |
BaMnO4 |
2,50·10-10 |
9,60 |
Соединение
Ba(OH)2
Ba3(PO4)2
BaSO3
BaSO4
BaSeO4
Be(OH)2
BiAsO4
BiI3
BiPO4
Bi2S3
Ca3(AsO4)2
CaCO3
CaCrO4
CaF2
Ca(IO3)2
Ca(OH)2
Ca3(PO4)2
CaSO3
CaSO4
CaSeO3
Cd(CN)2
CdCO3
Cd(OH)2
CdS
CdSeO3
CdWO4
CoCO3
Co(IO3)2
Co(OH)2
Co(OH)3
CoS α
CoSeO3
CrAsO4
Cr(OH)2
Cr(OH)3
CrPO4
CsBrO3
CsClO3
CsClO4
38
ПР рПР
5,00·10-3 2,30 6,00·10-39 38,22 8,00·10-7 6,10 1,10·10-10 9,97 5,00·10-8 7,30 6,30·10-22 21,20 2,80·10-10 9,36 8,10·10-19 18,09 1,30·10-23 22,90 1,00·10-97 97,00 6,80·10-19 18,17 3,80·10-9 8,42 7,10·10-4 3,15 4,00·10-11 10,40 7,00·10-7 6,15 5,50·10-6 5,26 2,00·10-29 28,70 3,20·10-7 6,50 2,50·10-5 4,60 4,70·10-6 5,53 1,00·10-8 8,00 1,00·10-12 12,00 2,20·10-14 13,66 1,60·10-28 27,80 5,00·10-9 8,30 2,00·10-6 5,70 1,05·10-10 9,98 1,00·10-4 4,00 6,30·10-15 14,20 4,00·10-45 44,40 4,00·10-21 20,40 1,60·10-7 6,80 7,80·10-21 20,11 1,00·10-17 17,00 6,30·10-31 30,20 1,00·10-17 17,00 2,00·10-2 1,70 4,00·10-2 1,40 4,00·10-3 2,40
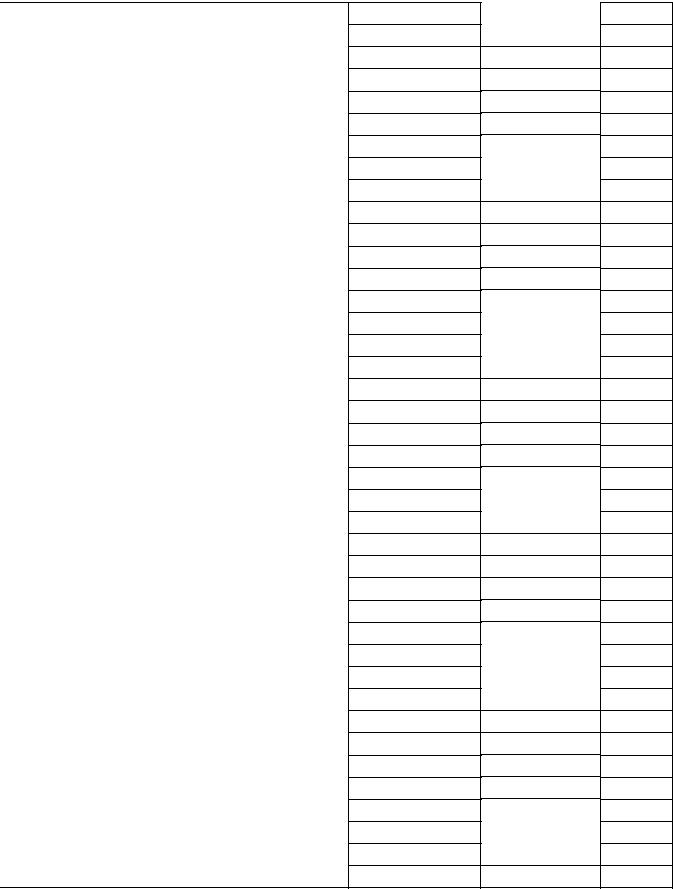
Продолжение таблицы 4 – Произведение растворимости
Соединение |
ПР |
рПР |
CsIO3 |
1,00·10-2 |
2,00 |
CsIO4 |
4,40·10-3 |
2,36 |
CsMnO4 |
9,10·10-5 |
4,08 |
CsReO4 |
4,00·10-4 |
3,40 |
CuCO3 |
2,50·10-10 |
9,60 |
CuCrO4 |
3,60·10-6 |
5,44 |
Cu(IO3)2 |
7,40·10-8 |
7,13 |
Cu(OH)2 |
2,20·10-20 |
19,66 |
CuS |
6,30·10-36 |
35,20 |
CuSe |
1,00·10-49 |
49,00 |
CuSeO3 |
1,70·10-8 |
7,78 |
FeAsO4 |
5,80·10-21 |
20,24 |
FeCO3 |
3,50·10-11 |
10,46 |
Fe(OH)2 |
8,00·10-16 |
15,10 |
Fe(OH)3 |
6,30·10-38 |
37,20 |
FePO4 |
1,30·10-22 |
21,89 |
FeS |
5,00·10-18 |
17,30 |
FeSe |
1,00·10-26 |
26,00 |
Fe2(SeO3)3 |
2,00·10-31 |
30,70 |
Hg2Br2 |
5,80·10-23 |
22,24 |
Hg2CO3 |
8,90·10-17 |
16,05 |
Hg2Cl2 |
1,30·10-18 |
17,88 |
Hg2CrO4 |
5,00·10-9 |
8,70 |
Hg2I2 |
4,50·10-29 |
28,35 |
Hg2(IO3)2 |
2,45·10-14 |
13,71 |
HgBr2 |
3,00·10-26 |
25,52 |
HgS |
1,60·10-52 |
51,80 |
Hg2S |
1,00·10-47 |
47,00 |
Hg2(SCN)2 |
3,00·10-20 |
19,52 |
Hg2SO3 |
1,00·10-27 |
27,00 |
Hg2SO4 |
6,80·10-7 |
6,17 |
HgSe |
1,00·10-59 |
59,00 |
Hg2SeO3 |
6,30·10-15 |
14,20 |
In(IO3)3 |
3,00·10-3 |
2,50 |
In(OH)3 |
5,00·10-34 |
33,30 |
In2S3 |
5,75·10-74 |
73,24 |
IrS2 |
1,00·10-75 |
75,00 |
KClO4 |
1,10·10-2 |
1,97 |
KIO4 |
8,30·10-4 |
3,08 |
Соединение
Li2CO3
LiF
Li3PO4
Mg3(AsO4)2
MgCO3
MgF2
Mg(IO3)2
Mg(OH)2
Mg3(PO4)2
MgSO3
MgSeO3
Mn3(AsO4)2
MnCO3
Mn(OH)2
Mn(OH)3
Mn(OH)4
MnS
MnSeO3
Mo(OH)4
NaIO4
Ni3(AsO4)2
Ni(CN)2
NiCO3
Ni(ClO3)2
Ni(IO3)2
Ni(OH)2
NiS α
NiSeO3
Pb3(AsO4)2
PbBr2
Pb(BrO3)2
PbCO3
PbCl2
PbCrO4
PbF2
PbI2
Pb(IO3)2
Pb(OH)2
Pb3(PO4)2
39
ПР рПР
4,00·10-3 2,40 1,70·10-3 2,77 3,20·10-9 8,50 2,10·10-20 19,68 2,10·10-5 4,67 6,50·10-9 8,19 3,00·10-3 2,50 6,00·10-10 9,22 1,00·10-13 13,00 3,00·10-3 2,50 4,40·10-6 5,36 1,90·10-29 28,72 1,80·10-11 10,74 1,90·10-13 12,72 1,00·10-36 36,00 1,00·10-56 56,00 2,50·10-13 12,60 5,40·10-8 7,27 1,00·10-50 50,00 3,00·10-3 2,50 3,10·10-26 25,51 3,00·10-23 22,50 1,30·10-7 6,87 1,00·10-4 4,00 1,40·10-8 7,85 2,00·10-15 14,89 3,20·10-19 18,50 1,00·10-5 5,00 4,10·10-36 35,39 9,10·10-6 5,04 8,00·10-6 5,10 7,50·10-14 13,13 1,60·10-5 4,79 1,80·10-14 13,75 2,70·10-8 7,57 1,10·10-9 8,98 2,60·10-13 12,58 5,00·10-16 15,30 7,90·10-43 42,10
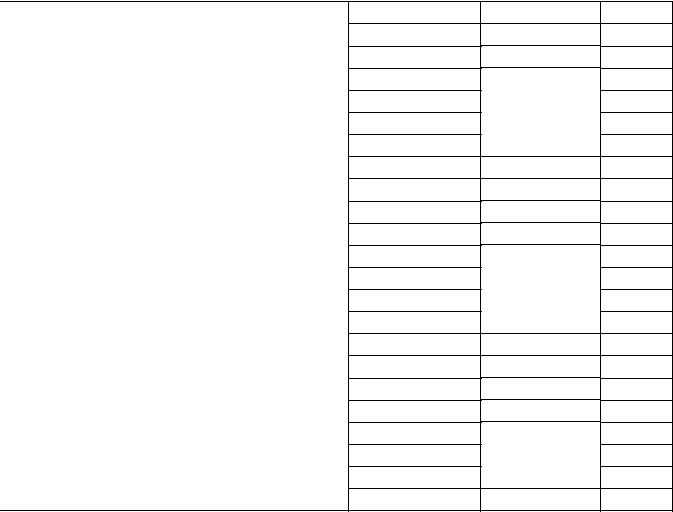
Окончание таблицы 4 – Произведение растворимости
Соединение |
ПР |
рПР |
PbS |
2,50·10-27 |
26,60 |
Pb(SCN)2 |
2,00·10-5 |
4,70 |
PbSO4 |
1,60·10-8 |
7,80 |
PbS2O3 |
4,00·10-7 |
6,40 |
PbSe |
1,00·10-38 |
38,00 |
PbSeO3 |
3,00·10-12 |
11,50 |
PbSeO4 |
1,45·10-7 |
6,84 |
Pd(OH)2 |
1,00·10-31 |
31,00 |
Pd(OH)4 |
6,50·10-71 |
70,20 |
PtBr4 |
3,00·10-41 |
40,50 |
PtCl4 |
8,00·10-29 |
28,10 |
Pt(OH)2 |
1,00·10-35 |
35,00 |
PtS |
8,00·10-73 |
72,10 |
RbBrO3 |
2,00·10-2 |
1,70 |
RbClO4 |
2,50·10-3 |
2,60 |
RbIO4 |
5,50·10-4 |
3,26 |
RbMnO4 |
2,90·10-3 |
2,54 |
RbReO4 |
9,60·10-4 |
3,02 |
SnI2 |
8,30·10-6 |
5,08 |
Sn(OH)2 |
6,30·10-27 |
26,20 |
Sn(OH)4 |
1,00·10-57 |
57,00 |
SnS |
2,50·10-27 |
26,60 |
Соединение
Sr3(AsO4)2
SrCO3
SrCrO4
SrF2
Sr(IO3)2
Sr(OH)2
Sr3(PO4)2
SrSO3
SrSO4
SrSeO3
SrWO4
Ti(OH)4
Zn3(AsO4)3
Zn(CN)2
ZnCO3
Zn(IO3)2
Zn(OH)2
Zn3(PO4)2
ZnS α
ZnSe
ZnSeO3
ПР рПР
1,30·10-18 17,10 1,10·10-10 9,96 3,60·10-5 4,44 2,50·10-9 8,61 3,30·10-7 6,48 3,20·10-4 3,50 1,00·10-31 31,00 4,00·10-8 7,40 3,20·10-7 6,49 4,40·10-6 5,36 2,20·10-10 9,77 8,00·10-54 53,10 1,30·10-27 27,89 2,60·10-13 12,59 1,45·10-11 10,84 2,00·10-8 7,70 1,20·10-17 16,92 9,10·10-33 32,04 1,60·10-24 23,80 1,00·10-31 31,00 1,90·10-8 7,72
40
