
khimia_metodichka_2
.pdf
42.Составить молекулярные и ионные уравнения реакций, протекающих между веществами: а) CuSO4 + NaOH; б) BaCl2 + Na2SO4; в) K2SiO3 + HCl.
43.Написать в ионно-молекулярной форме уравнения реакций нейтрализации: а) HCl + Ba(OH)2; б) HF + KOH; в) Fe(OH)3 + HNO3; г) CH3COOH
+NH4OH.
44.Написать в ионно-молекулярной форме уравнения реакций между следующими веществами: а) HNO2 + NH4OH; б) H2S + NH4OH; в) HCl + NaOH;
г) AlBr3 + AgNO3.
45. Составить в молекулярной форме уравнения реакций, которые
выражаются следующими ионно-молекулярными уравнениями:
NO2 H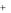 HNO2 , Cu 2
HNO2 , Cu 2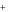 2OH
2OH Cu(OH) 2 , Pb2
Cu(OH) 2 , Pb2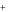 2J
2J PbJ2 .
PbJ2 .
46. Написать в ионно-молекулярной форме уравнения реакций:
а) H2SO4 + NaOH; б) Ba(OH)2 + HNO3; в) CH3COOH + Ca(OH)2; г) NH4OH + H2SO4.
47. Составить молекулярные уравнения реакций, которые выражаются ионными уравнениями:
SiO32 2H
2H H2SiO3 ,
H2SiO3 ,
Mg2 CO32
CO32 MgCO3 ,
MgCO3 ,
Al(OH)3 OH AlO2 2H2O .
AlO2 2H2O .
48.Написать в ионно-молекулярной форме уравнения реакций,
приводящих к образованию малодиссоциирующих соединений:
а) FeS + HCl; б) HCOOK + HNO3; в) Na2S + H2SO4; г) NH4Cl + Ca(OH)2.
49. Написать молекулярные и ионные уравнения следующих реакций:
а) Ca(OH)2 + HCl; б) NH4OH + HCOOH; в) HNO3 + KOH; г) HCN + KOH.
50. Составить молекулярные уравнения реакций, которые выражаются следующими ионными уравнениями:
Ag 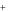 Cl
Cl AgCl ;
AgCl ;
Zn2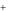 H2S ZnS 2H
H2S ZnS 2H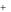 ;
;
Fe(OH)3 3H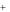 Fe3
Fe3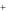 3H2O .
3H2O .

51. Составить молекулярные и ионные уравнения реакций, протекающих между веществами:
а) FeCl3 и KOH; б) CuSO4 и H2S; в) BaCO3 и HNO3.
52. Составить молекулярные уравнения реакций, которые выражаются следующими уравнениями:
Pb(OH)2 |
2OH PbO22 2H2O ; |
|
H |
OH |
H2O ; |
Cu2 |
S2 |
CuS . |
53. Составить молекулярные и ионные уравнения реакций, протекающих
между веществами: а) NH4Cl и Ba(OH)2; б) Pb(NO3)2 и KJ; в) Hg(NO3)2 и NaJ;
г) Cr(OH)3 и KOH.
54. Составить молекулярные уравнения реакций, которые выражаются следующими ионными уравнениями:
а) Al3+ + 3OH- = Al(OH)3; б) CH3COO- + H+ = CH3COOH; в) Zn2+ + S2- = ZnS.
55. Написать в молекулярной и ионной формах уравнения реакций взаимодействия:
а) хлорида железа (III) с гидроксидом аммония;
б) карбоната калия с нитратом кальция;
в) сульфата натрия с фосфатом алюминия.
56. Написать по два разных уравнения в молекулярной форме для каждой из следующих реакций, выраженных ионными уравнениями:
3Ba2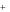 2PO34
2PO34 Ba3 (PO4 )2 ;
Ba3 (PO4 )2 ;
Cd2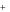 2OH
2OH Cd(OH)2 .
Cd(OH)2 .
57.К каждому из веществ: Ba(OH)2, Al(OH)3, H2SO4 прибавили раствор гидроксида калия. В каких случаях произошли реакции? Выразить их молекулярными и ионными уравнениями.
58.Написать в молекулярно-ионной форме уравнения реакций образования соединений, менее растворимых, чем исходные:
а) AgNO3 + FeCl3; б) CH3COOAg + KCl;

в) Pb(NO3)2 + K2S; г) Ba(NO3)2 + Al2(SO4)3.
59. Составьте молекулярные уравнения реакций, которые выражаются ионными уравнениями:
Ba 2 SO24
SO24 BaSO 4 ;
BaSO 4 ;
HCO3 H H2O CO2 ;
H2O CO2 ;
SiO32 2H
2H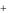 H2SiO3 .
H2SiO3 .
60. Составьте молекулярные и ионные уравнения реакций, протекающих между веществами: а) MgCO3 + HNO3; б) Cr(OH)3 + NaOH; в) FeCl3 + KOH;
г) NiSO4 + (NH4)2S.
4. ГИДРОЛИЗ СОЛЕЙ
Примеры решения задач
Пример 1. Какая из приведѐнных солей подвергается гидролизу:
а) NaCl; б) K2SO4; в) CuCl2?
Решение. а) NaCl – гидролизу не подвергается, так как образована
сильной кислотой и сильным основанием;
б) K2SO4 – гидролизу не подвергается, так как образована сильным основанием и сильной кислотой;
в) CuCl2 – подвергается гидролизу, так как образована сильной кислотой и слабым основанием.
Гидролиз данной соли идѐт ступенчато:
I ступень: CuCl2 + H2O |
CuOHCl + HCl; |
||
Cu2+ |
+ 2Cl- + HOH |
CuOH+ + Cl- + H+ + Cl-; |
|
Cu2+ |
+ HOH CuOH+ + H+. |
||
II ступень: CuOHCl + H2O |
Cu(OH)2 + HCl; |
||
CuOH+ + Cl- + HOH |
Cu(OH)2 + H+ + Cl-; |
||
CuOH+ + HOH |
Cu(OH)2 + H+. |
||
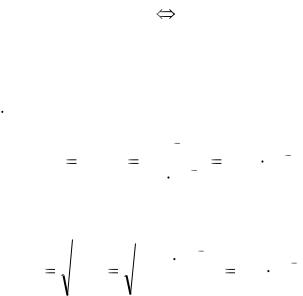
Так как в результате гидролиза по первой и второй ступеням образуется избыток ионов H+, то раствор CuCl2 имеет кислую реакцию среды.
Пример 2. Вычислить степень гидролиза ацетата калия в 0,1М растворе и
pH раствора.
Решение. Уравнение реакции гидролиза:
CH3COO– + H2O CH3COOH + OH–.
Для вычисления степени гидролиза найдем, прежде всего, константу гидролиза.
Для этого воспользуемся справочным значением константы диссоциации уксусной кислоты 1,8 10-5:
K |
|
|
|
KH2O |
|
10 14 |
|
|
5,56 10 |
10 |
. |
|||||||
Г |
|
K |
|
|
1,8 10 |
5 |
|
|
|
|||||||||
|
|
|
|
кисл |
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
Теперь найдѐм степень гидролиза: |
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
h |
|
|
K Г |
|
|
|
5,56 10 10 |
7,5 10 |
5 |
. |
||||||||
|
|
CM |
|
|
0,1 |
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
Для вычисления pH следует принять во внимание, что в результате гидролиза каждого аниона CH3COO– образуется один гидроксид-ион. Если исходная концентрация гидролизующихся анионов CM (моль/л), а гидролизу подверглась доля h этих анионов, то при этом образовалось hCM (моль/л) ионов
OH-. Таким образом, [OH–] = hCM = 7,5 · 10-5 · 0,1 = 7,5 · 10-6 моль/л.
Следовательно pOH = -lg[OH–] = -lg(7,5 · 10-6) = 5,12.
Отсюда pH = 14 – pOH = 14 – 5,12 = 8,88.
Задачи для самостоятельного решения
61.Какие из перечисленных солей подвергаются гидролизу: NaCN, KNO3, CaCl2? Для каждой из гидролизующихся солей написать уравнение гидролиза в ионно-молекулярной форме и указать реакцию еѐ водного раствора.
62.Какие из перечисленных ниже солей подвергаются гидролизу: NaNO2, KBr, FeCl3? Для каждой из гидролизующихся солей написать уравнение
гидролиза в ионно-молекулярной форме и указать реакцию еѐ водного
раствора.
63.Указать, какие из перечисленных ниже солей подвергаются гидролизу: ZnBr2, MgSO4, K2CO3. Для каждой из гидролизующихся солей написать в молекулярной и ионной форме уравнение гидролиза по каждой ступени, указать реакцию водного раствора соли.
64.Указать, какие из перечисленных ниже солей подвергаются гидролизу: Na3PO4, CrCl3, Na2SO4. Для каждой из гидролизующихся солей написать в молекулярной и ионной форме уравнение гидролиза по каждой ступени, указать реакцию водного раствора соли.
65.На основании уравнений гидролиза солей ответить, в растворах какой соли среда щелочная: а) KCl; б) Na2SO3; в) AlBr3; г) Zn(NO3)2?
66.Составить ионные и молекулярные уравнения гидролиза солей NiCl2, Pb(CH3COO)2, Na2S. Какое значение pH (больше или меньше 7) имеют растворы этих солей?
67.Какие из солей: K2CO3, FeBr3, K2SO4, ZnBr2 подвергаются гидролизу?
Составить молекулярные и ионные уравнения гидролиза соответствующих
солей.
68.Написать в ионно-молекулярной форме уравнения реакций,
приводящих к образованию малорастворимых осадков или газов: а)
Pb(NO3 )2 + KI; б) NiCl2 + H2 S; в) K2 CO3 + HCl; г) CuSO4 + NaOH; д) CaCO3 + HCl; е) Na2 SO3 + H2 SO4 ; ж) AlBr3 + AgNO3 .
69.pH 0,1 М раствора натриевой соли некоторой одноосновной органической кислоты равен 10. Вычислить константу диссоциации этой кислоты.
70.Вычислить константу гидролиза хлорида аммония, определить степень гидролиза этой соли в 0,01 М растворе и pH раствора.
71.Указать, какие из перечисленных ниже солей подвергаются гидролизу: ZnBr2, K2S, Fe2(SO4)3, MgSO4, Cr(NO3)3, K2CO3, Na3PO4, CuCl2. Для

каждой из гидролизующихся солей написать в молекулярной и в ионно-
молекулярной форме уравнения гидролиза по каждой ступени, указать реакцию водного раствора соли.
72.Вычислить константу гидролиза фторида калия, определить степень гидролиза этой соли в 0,01 М растворе и pH раствора.
73.Определить pH 0,02 н раствора кальцинированной соды Na2CO3,
учитывая только первую ступень гидролиза.
74.Сравнить степень гидролиза соли и pH среды в 0,1 М и 0,001 М
растворах цианида калия.
75.При сливании водных растворов Cr(NO3)3 и Na2S образуется осадок гидроксида хрома(III) и выделяется газ. Составить молекулярные и ионные уравнения происходящей реакции.
76.Исходя из значений констант диссоциации соответствующих кислот и оснований, указать реакцию водных растворов следующих солей: NH4CN, NH4F, (NH4)2S.
77.При смешивании растворов CuSO4 и K2CO3 выпадает осадок основной соли (CuOH)2CO3 и выделяется CO2. Составить ионное и молекулярное уравнения происходящего гидролиза.
78.Указать, какие из перечисленных ниже солей подвергаются гидролизу: NaCN, KNO3, KOCl, NaNO2, CH3COONH4, CaCl2, NaClO4, KHCOO, KBr? Для каждой из гидролизующихся солей написать в молекулярной и в ионно-молекулярной форме уравнения гидролиза по каждой ступени, указать реакцию водного раствора соли.
79.Составить ионные и молекулярные уравнения гидролиза солей K2S, Cs2CO3, NiCl2, Pb(CH3COO)2. Какое значение рН ( 7 или 7) имеют растворы этих солей?
80.Раствор NaH2PO4 имеет слабокислую, а раствор Na3PO4 –
сильнощелочную реакцию. Объяснить эти факты и мотивировать их
соответствующими ионно-молекулярными уравнениями.

5. ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ РЕАКЦИИ
Примеры решения задач
Пример 1. Исходя из степени окисления азота, серы, марганца в соединениях NH3, HNO2, HNO3, H2S, H2SO3, H2SO4, MnO2, KMnO4, определить,
какие из них могут быть только восстановителями, только окислителями и какие проявляют и окислительные, и восстановительные свойства.
Решение. Степень окисления азота в указанных соединениях соответственно равна –3 (низшая), +3 (промежуточная), +5 (высшая); степень окисления серы равна –2 (низшая), +4 (промежуточная), +6 (высшая); степень окисления марганца равна +4(промежуточная), +7 (высшая). Отсюда: NH3, H2S
– только восстановители, HNO3, H2SO4, KMnO4 – только окислители, HNO2, H2SO3, MnO2 – окислители и восстановители.
Пример 2. Составить уравнение окислительно-восстановительной реакции, идущей по схеме:
7 |
3 |
2 |
5 |
K Mn O4 |
H3 P O3 H2SO4 |
Mn SO4 |
H3 P O4 K2SO4 H2O . |
Решение. Составление уравнения реакции взаимодействия в данном случае сводится к расстановке коэффициентов. Вычислим, как изменяют свою степень
окисления восстановитель и окислитель и запишем электронные уравнения:
P 3 |
|
|
|
|
|
P 5 процесс окисления |
2e |
||||||
Mn 7 |
|
|
|
|
Mn 2 процесс восстановления. |
|
|
5e |
|||||
Общее число электронов, отданных восстановителем, должно быть равно числу электронов, которое присоединяет окислитель. Наименьшее общее кратное для числа отданных и принятых электронов равно 10. Разделив это число на 5,
получаем коэффициент 2 для окислителя, а разделив на 2, получаем коэффициент 5 для восстановителя. Остальные коэффициенты определяем подбором. В результате уравнение имеет вид:
2KMnO4 5H3PO3 3H2SO4 2MnSO4 5H3PO4 K2SO4 3H2O .

Задачи для самостоятельного решения
81. Исходя из степени окисления хлора в соединениях HCl, HClO3, HClO4
определить, какое из них является только окислителем, только восстановителем
икакое может проявлять как окислительные, так и восстановительные свойства.
82.На основании электронных уравнений расставить коэффициенты в
уравнении реакции, идущей по схеме: KBr KBrO3 H2SO4 Br2 K2SO4 H2O .
83.На основании метода электронного баланса расставить коэффициенты
вуравнении реакции, идущей по схеме:
|
|
|
|
|
Na 2SO3 |
KMnO4 |
H2O Na 2SO4 MnO2 KOH . |
||
84. Методом электронного баланса расставить коэффициенты в |
|||||||||
следующих уравнениях реакций: |
|
||||||||
HClO3 |
H2S |
HCl |
H2SO4 ; |
|
|
|
|||
KJ KJO3 |
H2SO4 |
|
J2 |
K2SO4 |
H2O ; |
||||
FeCl2 |
HClO3 |
HCl |
FeCl3 |
H2O . |
|
||||
85. Окисление или восстановление происходит при переходах: |
|||||||||
NH3 |
NO для азота, |
|
|
|
|
||||
Cr2 (SO4 )3 |
K2CrO4 |
для хрома, |
|
|
|||||
MnSO4 |
|
KMnO4 |
для марганца, |
|
|||||
KMnO4 |
K2MnO4 |
для марганца. |
|
||||||
86. Указать окислитель, восстановитель и подобрать коэффициенты в |
|||||||||
уравнениях: |
|
|
|
|
|
|
|
||
KMnO4 |
Na 2SO3 |
|
H2SO4 |
MnSO 4 |
Na 2SO4 K2SO4 H2O ; |
||||
KClO3 |
|
KClO4 |
HCl ; |
|
|
|
|
||
K2Cr2O7 |
HCl |
|
CrCl3 |
Cl2 |
KCl |
H2O . |
|||
87. Определить степень окисления кислорода в соединениях: ClO2, F2O, H2O, H2O2, CaO, CaO2, PbO, PbO2; хрома в соединениях: Cr2(SO4)3, K2Cr2O7, CrO2Cl2, KCrO2, K2CrO4, CrO3; хлора в соединениях: Cl2, NaOCl, CaOCl2, AlCl3,

HСlO4, NaClO2, Cl2O7. Окислительные или восстановительные свойства проявляют эти соединения?
88. Исходя из степени окисления фосфора в соединениях PH3, H3PO4, H3PO3, определить, какое из них является только окислителем, только восстановителем и какое может проявлять и окислительные, и
восстановительные свойства. На основании метода электронного баланса расставить коэффициенты в уравнении реакции, протекающей по схеме:
PbS HNO3 S Pb(NO3 )2 NO H2O .
89. Исходя из степени окисления хрома, иода и серы в соединениях
K2Cr2O7, KJ, H2SO3 определить, какое из них является только окислителем,
только восстановителем и какое может проявлять и окислительные, и
восстановительные свойства. На основании метода электронного баланса расставить коэффициенты в уравнении реакции, идущей по схеме:
NaCrO2 PbO2 NaOH Na2CrO4 |
Na2PbO4 H2O . |
90. Составить электронные уравнения и |
указать, какой процесс – |
окисление или восстановление – происходит при следующих превращениях:
Mn6+ → Mn2+; Cl5+ → Cl-; N3- → N5+.
На основании метода электронного баланса расставьте коэффициенты в
уравнении реакции, идущей по схеме: Cu 2O HNO3 Cu(NO3 )2 NO H2O .
91. Реакции выражаются схемами:
HNO3 |
Zn N2O Zn(NO3 )2 H2O ; |
FeSO4 |
KClO3 H2SO4 Fe2 (SO4 )3 KCl H2O . |
Составить электронные уравнения, указать, какое вещество является
окислителем и восстановителем, расставить коэффициенты.
92. Реакции выражаются схемами:
K2Cr2O7 HCl Cl2 |
CrCl3 |
KCl H2O ; |
Au HNO3 HCl |
AuCl 3 |
NO H2O . |

Составить электронные уравнения, указать, какое вещество является окислителем и восстановителем, расставить коэффициенты.
93. Указать окислитель, восстановитель и подобрать коэффициенты в уравнениях:
PbO2 |
Mn(NO3 )2 |
HNO3 |
Pb(NO3 )2 |
HMnO4 H2O ; |
||||
Al K2Cr2O7 |
H2SO4 |
Al2 (SO4 )3 Cr2 (SO4 )3 |
K2SO4 H2O . |
|||||
|
94. Методом электронного баланса расставить коэффициенты в |
|||||||
следующих уравнениях реакций: |
|
|
||||||
KBr K2Cr2O7 H2SO4 |
|
Br2 |
Cr2 (SO4 )3 |
K2SO4 |
H2O ; |
|||
CrCl3 |
H2O2 |
KOH |
K2CrO4 |
KCl H2O . |
|
|||
|
95. Реакции выражаются схемами: |
|
||||||
P HJO3 H2O |
H3PO4 |
HJ ; |
|
|
||||
H2S Cl2 |
H2O |
H2SO4 |
HCl . |
|
|
|||
|
Составить электронные уравнения, указать, какое вещество является |
|||||||
окислителем и восстановителем, расставить коэффициенты. |
||||||||
|
96. Реакции выражаются схемами: |
|
||||||
P + HNO3 + H2O |
H3PO4 + NO; |
|
|
|||||
K2S + KMnO4 + H2SO4 |
S + K2SO4 + MnSO4 + H2O. |
|||||||
|
Составить |
электронные уравнения, |
расставьте коэффициенты. Для |
|||||
каждой реакции указать, какое вещество является окислителем, какое − восстановителем; какое вещество окисляется, какое − восстанавливается.
97. Реакции выражаются схемами:
HNO3 + Ca NH4NO3 + Ca(NO3)2 + H2O;
KMnO4 + Na2SO3 + KOH K2MnO4 + Na2SO4 + H2O.
Составить электронные уравнения, расставьте коэффициенты. Для каждой реакции указать, какое вещество является окислителем, какое − восстановителем; какое вещество окисляется, какое − восстанавливается.
98. Реакции выражаются схемами:
