
khimia_metodichka_1
.pdfМинистерство образования Российской Федерации
ЛИПЕЦКИЙ ГОСУДАРСТВЕННЫЙ ТЕХНИЧЕСКИЙ УНИВЕРСИТЕТ
Кафедра химии
ХИМИЯ КОНТРОЛЬНОЕ ЗАДАНИЕ №1
для студентов очно-заочного факультета инженерно-технических специальностей университета
Составители З.А.Мирошник, С.Н.Салтыков, А.В.Дудкин
Липецк 2002
УДК 54(07) М645
Химия. Контрольное задание №1 для студентов очно-заочного факультета инженерно-технических специальностей университета/ Составители: З.А.Мирошник, С.Н.Салтыков, А.В.Дудкин. Липецк: ЛГТУ, 2002. 21с.
Пособие предназначено для студентов очно-заочного факультета технического университета, содержит примеры решения задач по разделам химии, изучаемым в первом семестре, а также задачи для самостоятельного решения, сгруппированные в домашнее задание и распределенные по вариантам.
Табл. 1, Библиогр.: 3 назв. Рецензент А.Е.Середкин
©Липецкий государственный технический университет, 2002.

1. ОСНОВНЫЕ ПОНЯТИЯ И ЗАКОНЫ ХИМИИ
Примеры решения задач
Пример 1. Одна и та же масса металла соединяется с 1,591 г галогена и с
70,2 см3 кислорода, измеренного при нормальных условиях (н.у.). Вычислить эквивалентную массу галогена.
Решение: исходя из объѐма кислорода, рассчитаем эквивалентное количество металла, учитывая, что эквивалент кислорода равен 1/4:
n |
|
|
|
V(O2 ) |
|
|
70,2 10 |
3 л |
|
1,25 10 |
2 |
моль экв . |
|
Э(Me) |
|
|
|
|
|
|
22,4 л/моль 1/4 |
|
|||||
V(O2 ) |
Э |
(O2 ) |
|
|
|||||||||
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Количество эквивалентов металла, согласно закону эквивалентов, равно количеству эквивалентов галогена. Следовательно
M |
|
|
1,591 г |
126,9 г/моль экв |
|||
Э(Me) |
|
|
|
|
|||
1,25 10 |
2 |
моль экв |
|||||
|
|
|
|||||
Пример 2. Найти молекулярную формулу вещества, содержащего 93,75 %
углерода и 6,25 % водорода, если плотность этого вещества по воздуху равна
4,41.
Решение: рассчитаем молярную массу вещества, исходя из того, что
относительная плотность вещества CxHy |
по воздуху рассчитывается как |
||
отношение молярных масс вещества и воздуха: |
|||
D |
M(C H ) |
||
x |
y |
||
|
|
. |
|
|
29 г/моль |
||
Следовательно, M(C |
H |
) 29 г/моль 4,41 127,89 г/моль 128 г/моль . |
x |
y |
|
Масса x атомов углерода в одном моле вещества равна:
MxC |
93,75% 128 г/моль |
1 моль 0,9375 128 г 120 г |
|
100% |
|
||
|
|
|
|
Соответственно масса y атомов водорода равна 128 г – 120 г = 8г.
Остаѐтся найти число атомов углерода и водорода как отношение их массы в одном моле к относительной атомной массе:

x |
120 |
10; y |
8 |
8. |
||
|
|
|
|
|||
12 |
|
1 |
||||
|
|
|
|
|||
Молекулярная формула вещества имеет вид C10H8.
Задачи для самостоятельного решения
1. 1,00 г металла соединяется с 1,78 г серы. Найти эквивалентную массу металла, зная, что эквивалентная масса серы равна 16,0 г/моль.
2.При сгорании 3,24 г металла образуется 9,44 г оксида металла. Определить эквивалентную массу металла.
3.При сгорании 5,0 г металла образуется 9,44 г оксида металла. Определить эквивалентную массу металла.
4.Одно и то же количество металла соединяется с 0,20 г кислорода и с 3,17 г галогена. Определить эквивалентную массу галогена.
5.0,752 г металла при взаимодействии с кислотой вытеснило 0,936 л водорода, измеренного при нормальных условиях (н.у.) Определить эквивалентную массу металла.
6.Масса 1 л кислорода равна 1,4 г. Сколько литров кислорода расходуется при сгорании 21 г магния, эквивалент которого равен 1/2 моля?
7.Некоторое количество металла, эквивалентная масса которого равна
28 г/моль, вытесняет из кислоты 5,6 л водорода, измеренного при н.у. Определить массу металла.
8.Определить эквивалентные массы металла и серы, если 3,24 г металла образует 3,48 г оксида и 3,72 г сульфида.
9.Вычислить относительную атомную массу двухвалентного металла и определить, какой это металл, если 8,340 г металла окисляются 0,680 л кислорода (н.у.).
10.Определить эквивалентный объѐм кислорода.
11.Мышьяк образует два оксида, из которых один содержит 65,2 % (масс.) As, а другой 75,7 % (масс.) As. Определить эквивалентные массы мышьяка в обоих случаях.
12.1,00 г некоторого металла соединяется с 8,89 г брома и с 1,78 г серы. Найти эквивалентные массы брома и металла, зная, что эквивалентная масса серы равна 16,0 г/моль.
13.На нейтрализацию 12,25 г кислоты идѐт 10 г гидроксида натрия. Определить эквивалентную массу кислоты.
14.Эквивалентная масса хлора равна 35,5 г/моль, молярная масса атомов меди равна 63,5 г/моль. Эквивалентная масса хлорида меди равна 99,5 г/моль. Какова формула хлорида меди?
15.Для растворения 16,8 г металла потребовалось 14,7 г серной кислоты. Определить эквивалентную массу металла и объѐм выделившегося водорода
(н.у.).
16.На восстановление 1,80 г оксида металла израсходовано 883 мл водорода, измеренного при нормальных условиях. Вычислить эквивалентные массы оксида и металла.
17.1,60 г кальция и 2,61 г цинка вытесняют из кислоты одинаковое количество водорода. Вычислить эквивалентную массу цинка, зная, что эквивалентная масса кальция равна 20,0 г/моль.
18.На нейтрализацию 9,01 г соляной кислоты идет 10 г щѐлочи. Определить эквивалентную массу щѐлочи.
19.Содержание металла в сульфиде составляет 63,6 %. Определить эквивалентную массу металла, если эквивалентная масса серы 16 г/моль.
20.0,376 г алюминия при взаимодействии с кислотой вытеснили 0,468 л
водорода, измеренного при нормальных условиях. Определить эквивалентный
объѐм водорода, если известно, что эквивалентная масса алюминия равна
8,99 г/моль.

2. СТРОЕНИЕ АТОМА И ПЕРИОДИЧЕСКАЯ СИСТЕМА ЭЛЕМЕНТОВ
Примеры решения задач
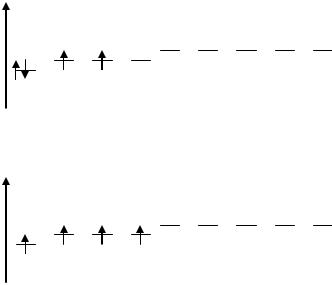
Пример 1. Составить электронную формулу атома магния и диаграмму заполнения электронами валентных орбиталей атома в нормальном и возбужденном состоянии
Решение: составляем электронную формулу атома магния: 1s22s22p63s2.
Валентными орбиталями являются орбитали третьего энергетического уровня,
то есть 3s. В нормальном состоянии одноэлектронные облака отсутствуют, так как в атоме все электроны спарены.
n=3
n=2 



 p
p
n=1
S
При затрате энергии атом магния переходит в возбужденное состояние.
При этом происходит переход одного 3s-электрона на вакантную 3р-орбиталь.
Энергия ионизации возрастает. Электронная конфигурация изменяется
1s22s22p63s13p1. Появляются два одноэлектронных облака, орбитальная диаграмма для атома магния в возбужденном состоянии имеет следующий вид:
n=3
n=2 



 p
p
n=1
S
Размещение электронов на 3s и 3р в соответствии с правилом Гунда:
суммарный спин атома имеет максимальное значение.
Пример 2. На каком основании серу и молибден помещают в одной группе периодической системы Д.И. Менделеева? Каковы особенности заполения электронами атома молибдена?
Решение: электронная конфигурация атома 16S имеет вид 1s22s22p63s23p4, а атома 42Mo – 1s22s22p63s23p64s23d104p65s14d5. Валентные электроны атома серы 3s23p4, молибдена – 5s14d5. В связи с тем, что валентные электроны (количество электронов равно 6) располагаются на различных подуровнях, эти атомы не могут располагаться в одной подгруппе. Но так как количество валентных электронов у них одинаково, атомы этих элементов помещены в одну группу.
Задачи для самостоятельного решения
21. Какие орбитали – 4f или 6S - раньше заполняются электронами ?
Обоснуйте ответ. Составьте электронную формулу атома элемента, порядковый номер которого 43.
22. Что такое относительная электроотрицательность ? Что она характеризует? Пользуясь таблицей значений относительных электроотрицательностей элементов, расположите химические символы перечисленных ниже элементов в порядке последовательного возрастания электроотрицательностей: бор, фосфор, магний, фтор, кислород, цезий,
кремний, углерод.
23.Чем отличаются по электронному строению и свойствам атомы меди от ионов меди Сu2+ ?
24.Что такое квантовые числа ? Какие значения они могут принимать ?
25.Сколько и какие значения может принимать магнитное квантовое число ml при орбитальном числе l = 0,1,2 и 3 ? Какие элементы в периодической системе называются s-,р-, d- и f-элементами? Приведите примеры.
26.Какие орбитали атома заполняются электронами раньше: 4d или 5s;
6s или 5р ? Почему ? Составьте электронную формулу атома элемента,
порядковый номер которого 42.
27. Вычислите абсолютные значения электроотрицательностей элементов лития и фтора по следующим данным: потенциал ионизации лития 6,39 эВ,
фтора - 17,42 эВ; сродство к электрону лития 0,22 эВ, фтора - 3,44 эВ. Какова относительная электроотрицательность фтора, если условно принять электроотрицательность лития равной единице?
28.Что такое энергия ионизации? В каких единицах она выражается? Как изменяется энергия ионизации элементов внутри группы в периодической системе элементов?
29.Напишите электронные формулы атомов элементов с порядковыми номерами 9 и 28. К какому электронному семейству относится каждый из них?
30.Что такое сродство химического элемента к электрону? В каких единицах оно выражается? Как изменяется энергия сродства к электрону внутри периода в периодической системе элементов?
31.Что такое электроотрицательность? Как изменяется электроотрицательность элементов в периоде периодической системы элементов ?
32.Как изменяются химические свойства элементов с увеличением порядкового номера в пределах одного периода? Дайте ответ, исходя из строения атомов элементов.
33.Как изменяются свойства элементов главных подгрупп с увеличением порядкового номера? Ответ мотивируйте.
34.Как изменяется окислительная активность неметаллов в одной .группе периодической системы с увеличением порядкового номера?
35.Исходя из положения металла в периодической системе, укажите,
какой из двух гидроксидов является сильным основанием Ba(OH)2 или
Mg(OH)2; Ca(OH)2 или Fe(OH)2; Cd(OH)2 или Sr(OH)2?
36. Что является мерой металлических и неметаллических свойств
элементов? Какие элементы обладают наиболее выраженными
неметаллическими свойствами? Укажите их положение в периодической
системе.
37.У какого элемента четвертого периода - ванадия или мышьяка - более выражены металлические свойства?
38.У какого из р-элементов пятой группы периодической системы фосфора или сурьмы - сильнее выражены неметаллические свойства ?
39.Напишите электронные формулы атомов элементов 5-го периода VI
группы. Что общего у этих элементов и чем они отличаются в химическом
отношении?
40. Напишите электронные формулы атомов элементов 4-го периода VII
группы. Что общего у этих элементов и что отличает их друг от друга в
химическом отношении?
3. ХИМИЧЕСКАЯ СВЯЗЬ
Примеры решения задач
Пример 1. Объяснить механизм образования молекулы SiF4.
Решение: распределение электронов по атомным орбиталям кремния имеет вид 1S22S22P63S23P2. Энергетические диаграммы атома кремния в основном и возбужденном состояниях:
Si
3d
3p
3s
Si*
3d
3p
3s
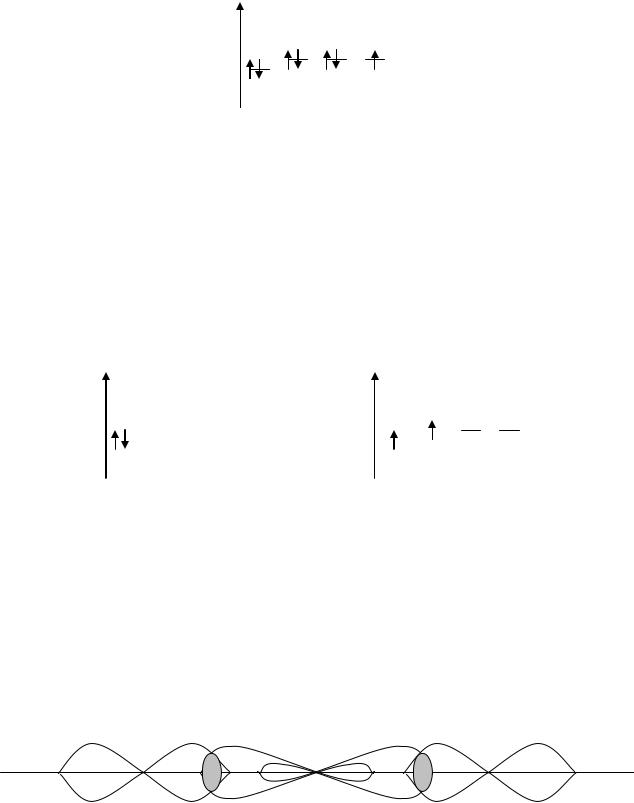
Распределение электронов по атомным орбиталям фтора имеет вид: 1S22S22P5. Энергетическая диаграмма атома фтора:
F
2p
2s
Возбужденное состояние для атома фтора невозможно из-за отсутствия вакантных орбиталей. Таким образом, в возбужденном состоянии атом кремния имеет четыре неспаренных электрона. Атом фтора имеет один неспаренный электрон, поэтому атом кремния способен присоединить четыре атома фтора.
Пример 2. Объяснить механизм образования молекулы BeF2 и изобразить схему перекрытия электронных облаков.
Решение: энергетическая диаграмма атома бериллия в основном и возбужденном состояниях имеет вид:
|
Be |
|
|
|
|
|
|
Be* |
|||
2p |
|
|
|
|
|
2p |
|||||
2s |
|
|
|
|
|
|
|
2s |
|
|
|
|
|
||||||||||
Энергетическая диаграмма атома фтора рассмотрена в предыдущем примере. Атом бериллия в возбужденном состоянии имеет два неспаренных s и p-электрона и способен присоединить два атома фтора, имеющих по одному неспаренному электрону. Для того чтобы связи, образуемые s и p-орбиталями атома бериллия, были равноценны, указанные орбитали подвергаются spгибридизации. В результате схема перекрытия атомных орбиталей будет иметь следующий вид:
Задачи для самостоятельного решения
F |
Be* |
F |
41. Какая из химических связей H-Cl, H-Br, H-I, H-S, H-P является наиболее полярной? Укажите, в какую сторону смещается электронная плотность связи.
