
- •Составитель: т.Н.Ермолаева
- •Определение удельной теплоемкости раствора
- •Методика эксперимента
- •Лабораторная работа 2 Определение теплоты реакции нейтрализации
- •Теоретическое обоснование
- •Методика эксперимента Первый вариант
- •Второй вариант
- •Методика эксперимента
- •Отчет по работе
- •Отчет по работе
- •Лабораторная работа 5 Определение теплоты образования одного моля твёрдого раствора из двух твёрдых компонентов при комнатной температуре
- •Теоретическое обоснование
- •Методика эксперимента
- •Отчет по работе
- •Лабораторная работа 6 определение содержания кристаллизационной воды в CuSo4xH2o
- •Теоретическое обоснование
- •Отчет по работе
- •Лабораторная работа 8 определение теплоты окисления щавелевой кислоты перманганатом калия в кислой среде
- •Теоретическое обоснование
- •Методика эксперимента
- •Отчет по работе
- •Термометрическое титрование
- •Теоретическое обоснование
- •Отчет по работе
Отчет по работе
должен содержать:
- теоретическое обоснование экспериментальной части работы,
- методику эксперимента, включающую схему установки,
- таблицу 3.2 наблюдений,
- графические зависимости температуры от времени, построенные на миллиметровой бумаге,
- расчет теплоты химической реакции,
- расчет относительной и абсолютной погрешности измерений.
Относительная погрешность измерений не должна превышать 5%.
Лабораторная работа 9
Термометрическое титрование
Цель работы: определение концентрации вещества на использовании теплоты, выделяющейся при химических реакциях.
Приборы и реактивы: пробирка, бюретка, термометр Бекмана.
Теоретическое обоснование
Для определения концентрации вещества A можно применять термометрическое титрование, которое основано на использовании теплоты, выделяющейся (или поглощающейся) при химических реакциях. Для этого подбирают вещество B (титрант), который вступает в идущую до конца реакцию с веществом A. К титруемому раствору приливают постепенно титрант. В ходе добавления титранта в результате взаимодействия веществ A и B выделяется или поглощается теплота и температура реакционной смеси меняется до тех пор, пока вещество A не прореагирует полностью. По достижении стехиометрического соотношения A и B дальнейшее приливание титранта не изменяет температуры реакционной смеси и она остаётся постоянной или плавно меняется за счёт теплообмена с окружающей средой. На кривой зависимости изменения температуры реакционной смеси от количества добавленного раствора B появляется точка перегиба, позволяющая определить стехиометрическое количество вещества B.
Термометрическое титрование применяется и тогда, когда другие методы титрования неприменимы. При удачном подборе титрующего реагента метод можно применять для титрования окрашенных, вязких веществ и систем, содержащих смолистые или твёрдые примеси. Термометрическое титрование можно применять для следующих типов реакций:
1) взаимодействие кислот и оснований:
NaOH+HCl=NaCl+H2O; NH4OH+HCl=NH4Cl+H2O.
Концентрация титруемого раствора не должна быть меньше 0,05…0,5 н (при низких концентрациях мало изменение температуры) и не превышать 1 н, так как смешение концентрированных растворов кислот и щелочей кроме теплоты нейтрализации сопровождается выделением теплоты разбавления;
2) реакции, при которых одним из конечных продуктов является практически нерастворимый осадок:
![]() ;
;
![]() .
.
Чем меньше растворимость осадка, тем выше точность результатов титрования. Произведение растворимости вышеприведённых гидроксидов составляет:
![]() ;
;![]() .
.
Незначительная растворимость этих осадков позволяет с достаточной точностью (1%) определить концентрации ионов Li+ и Na+ в 0,05…0,5 н раствора;
3) реакции, при которых одним из продуктов является растворимое устойчивое комплексное соединение:
![]()
Устойчивость комплексного соединения определяется константой нестойкости:
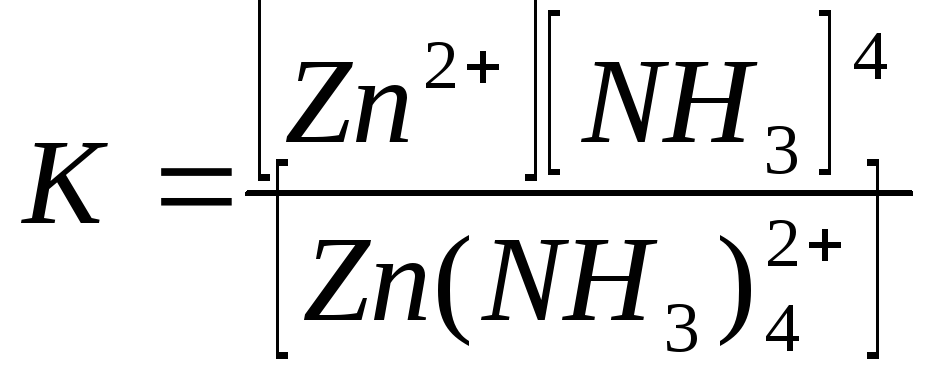 .
.
В данной работе следует определить концентрацию соляной кислоты по тепловому эффекту реакции нейтрализации.
Методика эксперимента
Налить 20 мл титруемого раствора в пробирку со стеклянной оболочкой, закреплённую на штативе, опустить в раствор стеклянную мешалку и термометр Бекмана. В течение 2…3 мин наблюдать за изменением температуры. Скорость изменения температуры не должна превышать 0,02 град/мин. С помощью обычного термометра сравнить температуру титруемого раствора и титранта. Если различие в температурах не превышает 0,1, титрант вылить в бюретку, закреплённую на том же штативе, что и пробирка. Конец бюретки опустить в пробирку таким образом, чтобы титрант не попадал на термометр, и приливать его к титруемому раствору непрерывно. Титруемый раствор всё время размешивать мешалкой. Показания термометра Бекмана записывать после каждого добавленного объёма титранта. На основании полученных данных построить график в координатах температура – объём титранта (рис.6).
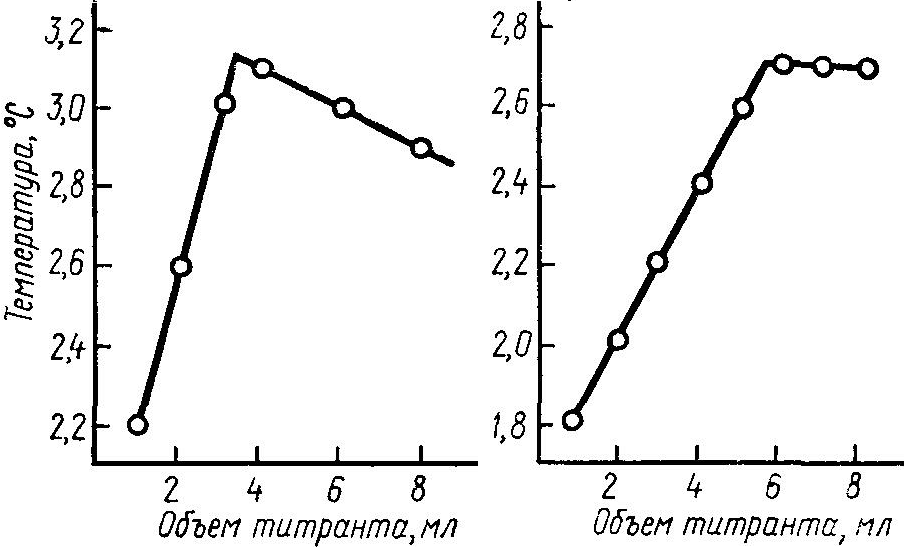
Рис. 3.6. Кривые термометрического титрования.
Точку эквивалентности титрования для первого предварительного опыта определить по графику и на основании полученных данных установить условия для проведения трёх точных опытов, исходя из следующих положений: точка эквивалентности титрования должна лежать в интервале 3…8 мл, так как изменения высоты столба титранта в бюреткек и объёма титруемого раствора уменьшают скорость приливания и дают дополнительный излом на кривой, что затрудняет определение точки эквивалентности. Если точка эквивалентности лежит в интервале 3…8 мл, концентрации титруемого и титрующего раствора оставляют без изменения; для интервала 0…3 мл следует уменьшить концентрацию титранта; для интервала 8 мл и более следует уменьшить концентрацию титруемого раствора. При окончательном титровании записывать показания термометра Бекмана после приливания каждых 0,5 мл раствора. Расхождение между результатами отдельных опытов для определения точки эквивалентности не должно превышать 0,2 мл.
