
- •Требования к оформлению отчета
- •Лабораторная работа №1 электродные потенциалы металлов
- •Лабораторная работа № 2 Контактная коррозия металлов
- •Практическая часть
- •Ход работы
- •Обработка экспериментальных данных
- •Лабораторная работа №3 защита сталей внешним током от коррозии
- •Практическая часть
- •Обработка экспериментальных данных
- •Защита стали от коррозии с помощью анодного протектора
- •Практическая часть
- •Ход работы
- •Приложение 1
Практическая часть
Работу проводят на установке, схема которой представлена на рис. 2.1. Коррозионный элемент составляют из двух различных металлов – цинк и медь. В этой паре анодом будет являться цинк, а катодом – медь. Измеряют рабочую поверхность образца, зачищают ее тонкой наждачной бумагой, обезжиривают фильтровальной бумагой, смоченной органическим растворителем, помещают электрод в одно из колен U-образного сосуда. В другое колено сосуда помещают образец из другого металла, обработанного по такой же методике, и наливают в U-образный сосуд исследуемый электролит.
Ход работы
Перед
началом работы рубильник 7
должен быть разомкнут, а декадный магазин
сопротивлений 8
выключен, что соответствует нулевому
сопротивлению цепи. При разомкнутом
положении рубильника 7 измеряют
вольтметром потенциалы каждого электрода
без протекания тока. Эти значения
соответствуют потенциалам
![]() и
и![]() .
Затем замыкают рубильник7
и измеряют вольтметром потенциалы
электродов, определяют их полярность
и записывают показания вольтметра и
микроамперметра. Увеличивая пошагово
сопротивление декадного магазина 8,
последовательно уменьшают величину
тока пары на 20 мкА и измеряют потенциалы
анода (
.
Затем замыкают рубильник7
и измеряют вольтметром потенциалы
электродов, определяют их полярность
и записывают показания вольтметра и
микроамперметра. Увеличивая пошагово
сопротивление декадного магазина 8,
последовательно уменьшают величину
тока пары на 20 мкА и измеряют потенциалы
анода (![]() )
и катода (
)
и катода (![]() )
при каждом значении тока. Минимальное
значение тока, при котором измеряют
потенциалы анода и катода, получают при
полностью введенном сопротивлении
декадного магазина8.
Затем выключают рубильник 7
и снова измеряют потенциалы электродов.
)
при каждом значении тока. Минимальное
значение тока, при котором измеряют
потенциалы анода и катода, получают при
полностью введенном сопротивлении
декадного магазина8.
Затем выключают рубильник 7
и снова измеряют потенциалы электродов.
Все
измерения производят после трехминутной
выдержки
при каждом значении тока. После окончания
измерения
электроды отключают, извлекают и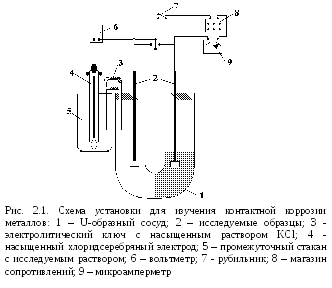 з
сосуда и выливают
электролит из сосуда. Электроды промывают
водой и сушат фильтровальной бумагой,
сосуд ополаскивают водой.
з
сосуда и выливают
электролит из сосуда. Электроды промывают
водой и сушат фильтровальной бумагой,
сосуд ополаскивают водой.
Обработка экспериментальных данных
Результаты измерений записывают в таблицу 2.1.
Потенциал электрода по отношению к стандартному водородному электроду рассчитывают по формуле (1.12).
Таблица 2.1
Катод
материал………………………………………………………
линейные размеры…………………±……………………мм
площадь поверхности S = ……......……………………см2
Анод
материал………………………………………………………
линейные размеры…………………±……………………мм
площадь поверхности S =………......……………………см2
Электролит…………………………..……………………………….
Температура электролита t = ………±……………………………°С
|
Величина тока I, мкА |
Потенциалы по отношению к хлоридсеребряному электроду, В |
Потенциалы по водородной шкале, В |
Примечание | ||
|
катода Ек |
анода Еа |
катода Ек |
анода Еа | ||
|
|
|
|
|
|
|
На основании полученных опытных данных строят коррозионную диаграмму Еa = f(I) и Ек = f(I), используя которую определяют максимальный ток (Iмакс) изучаемой гальванической пары и по формулам (2.1-2.3) рассчитывают степень анодного, катодного и омического контроля.
По результатам работы делают выводы о контролирующем факторе контактной коррозии исследуемых металлов в условиях испытания.
Лабораторная работа №3 защита сталей внешним током от коррозии
Цель работы:исследовать эффективность электрохимической защиты сталей от коррозии в электролитах в зависимости от плотности налагаемого постоянного электрического тока.
Существуют два вида электрохимической защиты металлов от коррозии с помощью постоянного электрического тока, налагаемого на металл от внешнего источника: катодную и анодную защиту.
Катодная защита .внешним током – это способ, при котором защищаемый металл присоединяют к отрицательному полюсу внешнего источника постоянного тока (т. е. в качестве катода), а к положительному полюсу присоединяют дополнительный электрод, который является анодом. При таких условиях поверхность защищаемого металла поляризуется катодно, ее потенциал смещается в отрицательную сторону, что приводит к уменьшению или полному прекращению коррозионного разрушения. Анодный процесс при этом протекает на дополнительном электроде – аноде. Для полного прекращения электрохимической коррозии чистого металла его нужно катодно заполяризовать до значения обратимого потенциала (Еме)обр, а многокомпонентный сплав - до значения обратимого потенциала его наиболее отрицательной составляющей. Катодную защиту внешним током широко применяют как дополнительное (к изолирующему покрытию), а иногда и как самостоятельное средство защиты от коррозии подземных металлических сооружений - трубопроводов, газопроводов, резервуаров, подводных поверхностей металлических конструкций в морской воде - обшивки судов, свай и др.
Анодная защита внешним током – это способ, при котором защищаемый металл присоединяют к положительному полюсу внешнего источника постоянного тока (т. е. в качестве анода), а к отрицательному полюсу присоединяют дополнительный электрод, который является катодом. При этом поверхность защищаемого металла поляризуется анодно, ее потенциал смещается в положительную сторону, что обычно приводит к увеличению электрохимического растворения металла. Однако, при достижении определенного значения потенциала может наступить пассивное состояние металла, что приводит к значительному снижению скорости электрохимической коррозии металла. Для длительного сохранения пассивного состояния требуется незначительная плотность анодного тока. На дополнительном электроде – катоде при этом протекает катодный процесс. При больших плотностях анодного тока возможно достижение значений потенциала, при которых наступает явление перепассивации (транспассивности), то есть растворение металла с переходом в раствор ионов высшей валентности, в результате чего образуются растворимые или неустойчивые соединения (железо и хром образуют ионы FeО42- и СгО42-), что приводит к нарушению пассивного состояния и увеличению скорости коррозии металла.
Эффективность электрохимической защиты, металлов от коррозии, характеризуют величиной защитного эффекта z (%) и коэффициентом защитного действия kз (г/А):
 ,
(3.1)
,
(3.1)
где
![]() -
отрицательный показатель изменения
массы металла в электролите без
электрохимической защиты, г/(м2.ч);
-
отрицательный показатель изменения
массы металла в электролите без
электрохимической защиты, г/(м2.ч);
![]() -
отрицательный показатель изменения
массы металла в том же электролите при
применении электрохимической защиты,
г(м2.ч),
-
отрицательный показатель изменения
массы металла в том же электролите при
применении электрохимической защиты,
г(м2.ч),
![]() ,
(3.2)
,
(3.2)
где
![]() -
удельная убыль массы металла в электролите
без электрохимической защиты, г/м2;
-
удельная убыль массы металла в электролите
без электрохимической защиты, г/м2;
![]() -
удельная убыль массы металла в том же
электролите при применении электрохимической
защиты, г/м2;
-
удельная убыль массы металла в том же
электролите при применении электрохимической
защиты, г/м2;
i – плотность тока А/м2.
Значение отрицательного показателя изменения массы рассчитывают по формуле:
![]() ,
(3.3)
,
(3.3)
где m0 и m1 – масса металла до и после коррозии соответственно, S – площадь рабочей поверхности, t – продолжительность коррозионного процесса.
