
- •I. Строение атома
- •2. Квантово-механическая теория строения атома.
- •2.1. Три основополагающие идеи (положения) квантовой механики:
- •2. Двойственная природа (корпускулярно–волновой дуализм) электрона.
- •3. Принцип неопределенности Гейзенберга
- •2.2. Основные особенности квантового состояния электрона и электронной структуры атомов.
- •Периодический Закон химических элементов д.И.Менделеева
- •II. Химическая связь
- •II. Химическая связь
- •Химическая связь
- •1. Определение, основные типы и природа химической связи. Количественные характеристики химической связи на основе квантово-механической теории.
- •Основные количественные характеристики
- •Химической связи
- •По квантово-механической теории:
- •Энергия, длина связи, валентный угол
- •2. Типы химической связи
- •2.4. Гибридизация ковалентной связи.
- •3.2. Примеры решения типовых задач
- •Химическая термодинамика и самопроизвольное протекание процесса
- •Химическая кинетика. Химическое равновесие
- •Скорость гомогенной и гетерогенной химических реакций.
- •Химическое равновесие
- •Учебно-методическое и информационное обеспечение дисциплины «химия»
- •Содержание дисциплины «Химия»
- •Содержание лекций
- •1. Порядок работы:
- •1Фотона
- •3. Газовые законы (стехиометрические):
- •7. Правила и формулы расчета молярных эквивалентных масс (мэ)
- •7.4.1. Эквивалентная масса оксида:
- •7.4.2. Эквивалентная масса основания:
- •7.4.3. Эквивалентная масса кислоты:
- •7.4.4. Эквивалентная масса соли:
- •3. Закон Авогадро (а. Авогадро, 1811):
- •3.3.Из закона Авогадро выведено несколько важных следствий:
- •4. Закон идеального газового состояния (Менделеева–Клапейрона, 1834 - 1874).
- •I. Химическая термодинамика (энергетика химичес- ких процессов)
- •Термохимия -
- •Термохимические уравнения
- •Законы термохимии
- •Процессы в живых организмах
- •Теплоемкость
- •Второе начало (закон) термодинамики
- •Энтропия – мера приближения системы к равновесию
- •III. Дисперсные системы. Растворы.
- •2. Основные классы неорганических соединений
- •2.1. Оксиды
- •2.2. Гидроксиды
- •2.3. Кислоты
- •2.4. Соли
- •2.5. Комплексные (координационные) соединения
- •2.6. Соединения- объекты супрамолекулярной химии Примеры супер- и супрамолекул
- •2.5. Некоторые правила построения графических формул химических соединений:
- •2.6. Отличительные электрофизические свойства металлов, полупроводников, диэлектриков.
- •3. Комплексные соединения (к.С.) -
- •3.1. Супер- и супрамолекулярные соединения -
- •1. Первые (до Томсона) модели атома.
- •2. Спектры испусканния электронов в полупроводниках, светодиоды.
- •3. Радиоактивность: понятие, виды, характеристики.
- •1. Протонно-нейтронная теория строения атома.
- •2. Квантово-механическая теория строения атома.
- •2.1. Три основополагающие идеи (положения) квантовой механики:
- •2. Двойственная природа (корпускулярно–волновой дуализм) электрона.
- •2.2. Основные особенности квантового состояния электрона и электронной структуры атомов.
- •II. Химическая связь
- •1. Определение, основные типы и природа химической связи. Количественные характеристики химической связи на основе квантово-механической теории.
- •2. Типы химической связи
- •2.4. Гибридизация ковалентной связи.
- •3.2. Примеры решения типовых задач
3.2. Примеры решения типовых задач
Задача 1.
Какую валентность и степень окисления имеют элементы в соединениях Na3N, F2, BCl? Показать направление перекрывания электронных облаков, конфигурацию молекул и типы связей по направлениям.
Решение.
а) Na3N: поскольку Na в соединениях всегда имеет степень окислениия (с.о.), равную +1, то с.о.(N) = – 3.
П остроимэлектронные
формулы Na
и N
и краткие
электронно-графические
формулы,
иначе –
схемы заполнения электронами их АО
внешнего энергетического уровня:
остроимэлектронные
формулы Na
и N
и краткие
электронно-графические
формулы,
иначе –
схемы заполнения электронами их АО
внешнего энергетического уровня:
В алентность
элемента определяется количеством
неспаренных электронов на внешнем
энергетическом уровне, поэтому валентностьNa
равна 1. Поскольку валентный электрон
находится в s–состоянии,
формой его электронного облака является
сфера.
алентность
элемента определяется количеством
неспаренных электронов на внешнем
энергетическом уровне, поэтому валентностьNa
равна 1. Поскольку валентный электрон
находится в s–состоянии,
формой его электронного облака является
сфера.
Атом
азота имеет три неспаренных р–электрона
на внешнем энергетическом уровне,
поэтому его валентность В
= 3. Поскольку у азота в соединении Na3N
степень
окисления (по модулю) и валентность
численно совпадают, то гибридизации
атома не будет. Три валентных р–электрона
имеют форму электронного облака в виде
гантели и располагаются в околоядерном
пространстве п о
взаимно перпендикулярным осям:
о
взаимно перпендикулярным осям:
В молекулеNa3N
каждый
валентный р–электрон
азота перекрывается с валентным
s–электроном
каждого из трех атомов натрия. Таким
образом, конфигурация молекулы будет
следующей:
молекулеNa3N
каждый
валентный р–электрон
азота перекрывается с валентным
s–электроном
каждого из трех атомов натрия. Таким
образом, конфигурация молекулы будет
следующей:
Поскольку перекрывание s– и р– электронов находится на оси, соединяющей центры атомов, то по всем направлениям имеет место σ– связь.
б) F2 – простое вещество, поэтому степень окисления его (с.о.) равна 0.
Электронная формула атома фтора и схема заполнения его валентных АО:
Н а
внешнем энергетическом уровне атомаF
находится один неспаренный рX
–электрон.
Поэтому валентность фтора, В(F) = 1;
рX
–электрон
имеет конфигурацию электронного облака
а
внешнем энергетическом уровне атомаF
находится один неспаренный рX
–электрон.
Поэтому валентность фтора, В(F) = 1;
рX
–электрон
имеет конфигурацию электронного облака
![]() .
В молекулеF2
каждый из рX
–электронов
атомов фтора перекрывается друг с другом
посредством σ–
связи:
.
В молекулеF2
каждый из рX
–электронов
атомов фтора перекрывается друг с другом
посредством σ–
связи:
в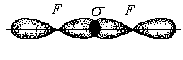
 ) В
молекулеBCl3
степени
окисления хлора и бора: с.о.(Cl)
= –1, с.о.(В) = +3. Построим электронные
формулы и схемы заполнения валентными
электронами АО (B
и
Cl):
) В
молекулеBCl3
степени
окисления хлора и бора: с.о.(Cl)
= –1, с.о.(В) = +3. Построим электронные
формулы и схемы заполнения валентными
электронами АО (B
и
Cl):
Поскольку атом бора имеет один неспаренный рX –электрон на внешнем энергетическом уровне, то в невозбужденном состоянии его валентность В = 1. Степень окисления бора в соединении BCl3 не совпадает с этой валентностью, значит, при взаимодействии атома бора с хлором происходит его возбуждение, распаривание s–электронов, переход одного из них во вторую ячейку р–подуровня и гибридизация.
Электронная формула атома бора в возбужденном состоянии и схема распределения валентных электронов по АО имеют следующий вид:

Химическая термодинамика и самопроизвольное протекание процесса
Любой самопроизвольный процесс протекает в направлении, при котором система переходит из менее вероятного состояния в более вероятное, сопровождающееся увеличением энтропии, т.е.
∆S > 0.
Это – условие, критерий самопроизвольного протекания процессов в изолированной системе.
Чтобы ответить на главный вопрос: как с по-мощью 2-го начала термодинамики предсказать возможность самопроизвольного химического или физико-химического процесса – используют две термодинамические (характеристические) функции – 2 т/д-ких потенциала –
– в зависимости от условий протекания процесса:
1) При p, T = const используют изобарно–изотер-мичеcкий потенциал G - свободную энергию Гиббса: G = H – TS;
2) При V,T = const используют изохорно–изотер-мичеcкий потенциал F - свободную энергию Гельмгольца: F = U – TS
Все потенциалы имеют размерность энергии Е (кДж) и все они не имеют абсолютного значения (в отличие от энтропии)
Зависимость т/д-ких потенциалов от их естественных переменных (Р, V, Т) описывается основным уравнением т/д-ки, которое объединяет 1-е и 2-е начала. Это уравнение записывают в эквивалентных формах: 1) ∆G = V∆р - S∆Т
2) ∆F = - S∆Т - р∆V
Энергия Гиббса (Р, Т = соnst).
Направление, в котором любой физический или химический процесс протекает самопроизвольно, определяется совместным действием двух факторов: 1) энтальпийным, т.е. тенденцией к переходу системы в состояние с наименьшей внутренней энергией (или энтальпией) ∆Н< 0;
и 2) энтропийным, т.е. тенденцией к достижению наиболее вероятного состояния, т.е. максимального числа частиц системы, большего беспорядка в ней.
Энергия Гиббса - термодинамическая функция состояния, учитывающая влияние энтальпийного и энтропийного факторов (∆Н < 0, ∆S > 0) на возможность и направле-ние протекания любого самопроизвольного химического процесса в изобарно-изотерми-ческих условиях:
∆G = ∆Н – Т∆S.
Стандартную энергию Гиббса образования (∆fG0) относят к 1 молю вещества и обычно выражают в кДж/моль; при этом ∆fG0образования наиболее устойчивой модификации простого вещества принимают равной нулю.
Условия стандартного состояния веществ
Состояние веществ - Стандартное состояние
1. Простое твердое - Кристаллическое состоя-
вещество ние
2. Простое жидкое - Чистая жидкость
вещество
3. Газообразное - Давление (парциаль-
вещество ное рi или относительное,
рi/100 кПа )
4. Растворенное - Молярная концентрация
вещество СМ = 1 моль/л
Во многих случаях значениями ∆fG0298 можно пользоваться для приближенной оценки направ-ленности химического процесса в нестандартных условиях, принимая, что ∆fG0Т = ∆fG0298 .
Для любой химической реакции при стандартных условиях ( или близких к ним) изменение энергии Гиббса определяется уравнением:
∆G0х.р.=∑ni ∆G0i (продукты) - ∑ni ∆G0i (реагенты)
Критерием возможности (самопроизво-льности) протекания процесса, идущего при
р, Т = const, при любых иных условиях, явля-ется уменьшение энергии Гиббса (∆G < 0).
∆G – энергия Гиббса, т.е. свободная энергия химической реакции, любого физико-химического процесса, идущего при р, Т = const, - «движущая сила» процесса.
Убыль свободной энергии реакции, идущей при р, Т = const, т.е. энергия Гиббса, не зависит от пути процесса и равна максимальной полезной работе реакции:
– ∆G = Амах .
Самопроизвольный процесс протекает до тех пор, пока система не достигнет минимального значения энергии Гиббса (Gmin = 0).
При ∆G = 0 система переходит в состояние термодинамического равновесия.
Из выражения ∆G = ∆Н – Т∆S, видно, что при температурах, близких к 0 К (Т∆S = 0), знак и величина ∆G0 определяются изменением энта-льпии реакции, т.е. при низких температурах направление реакции определяется разницей в прочности химических связей продуктов и исходных веществ.
Например, тот факт, что х.р.:
Н2(г) + Cl2(г) = 2 HCl(г), ∆Н0х.р.= -184,8 кДж
- протекает с уменьшением энтальпии, указывает на то, что связи в HCl(г) прочнее, чем средние значения связей в молекулах исходных веществ.
Разрыв химических связей всегда требует затраты энергии, равной сумме энергий разрушаемых свя-зей. Соединение атомов в молекулы сопровожда-ется выделением энергии, равной сумме энергий образующихся связей. Разность между энергией, затраченной на разрушение связей в реагентах, и энергией, полученной при образовании новых свя-зей в молекулах продуктов, и составляет энталь-пию химической реакции ∆Н0х.р..
Тема:
