
Механика_Термодинамика_290311
.pdf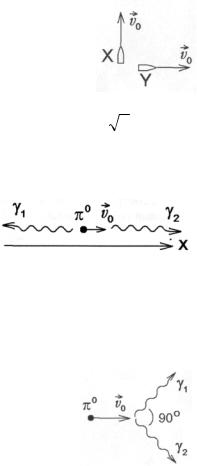
80
3. Ракета с космонавтом Х летит со скоростью V = 0,8c (c – скорость света в вакууме) мимо наблюдателя Y на неподвижной планете. Космонавт Х нажимает на кнопку радиопередатчика в течении 60 секунд по часам ракеты. По часам наблюдателя Y этот процесс длится в течение интервала времени (в секундах) … .
а) 36 б) 100 в) 60 г) 48
Ответ: б)
4. Ракеты X и Y разлетаются во взаимно перпендикулярных направлениях с одинаковыми по величине скоростями V0 = 0,8·c (с – скорость света в вакууме). Относительно ракеты Х ракета Y движется со скоростью … .
а) c б) 0,6·V0 в) 1,17·V0 г) 
 2 V0
2 V0
Ответ: в)
5. Летевший со скоростью v0 = 0,8c вдоль оси 0х (с – скорость света в вакууме)
π0-мезон распался в два γ- кванта (фотона): π0→γ1+γ2, разлетающихся вдоль оси 0х
(см. рисунок). Проекция скорости фотона γ1 на ось 0х равна … .
а) – с б) – 0,2 с в) 0,8 с г) – 1,8 с
Ответ: а)
6. Летевший со скоростью v0 = 0,8с вдоль оси 0х (с – скорость света в вакууме) π0-мезон распался в два γ- кванта (фотона): π0→ γ1+γ2, разлетающихся под углом 90° (см. рисунок). Величина скорости, с которой фотон γ1
|
81 |
|
|
|
|
|
удаляется от фотона γ2, равна: |
|
|
|
|
|
|
а) |
б) √2 ∙ |
в) |
√2 ∙ |
с |
г) |
с |
|
|
Ответ: г) |
||||
7. Частицы 1, 2 и 3 все время находятся на одной прямой. Частица 2 удаляется от частицы 1 со скоростью v0 = 0,6с (с – скорость света в вакууме). Частица 3 удаляется от частицы 2 со скоростью v′ = 0,8с. Тогда частица 3 удаляется от частицы 1 со скоростью:
а) с б) 1,4с в) 0,946с г) 0,7с
Ответ: в)
10.ПЕРВОЕ НАЧАЛО ТЕРМОДИНАМИКИ
10.1.Основные понятия термодинамики
10.2.Нулевое начало термодинамики
10.3.Внутренняя энергия. Первое начало термодинамики
10.1.Предметом изучения термодинамики являют-
ся термодинамические системы. Термодинамической системой называют большую (n=1019…1023 см-3) совокупность частиц, находящихся в хаотическом движении, при котором все направления перемещения равновероятны.
Различают термодинамические системы:
- изолированные (без обмена энергией с внешней средой) и неизолированные; - открытые (имеет место обмен веществом с окружающей средой) и закрытые;
- гомогенные (однородные) и гетерогенные и т.д. В каждой данный момент равновесная система
может быть охарактеризована термодинамическими параметрами. К основным параметрам относят: давление,
82
температуру, объем, удельный объем, плотность и т. д. Параметры делят на внешние и внутренние. Вели-
чины, определяемые положением не входящих в рассматриваемую термодинамическую систему внешних тел, называют внешними параметрами. Они являются функциями координат внешних тел. Величины, определяемые совокупным движением и распределением в пространстве образующих систему частиц, называют внутренними параметрами.
Термодинамическим или тепловым равновесием называют такое состояние термодинамической системы, при котором все ее параметры не изменяются во времени, а также отсутствуют любые потоки (массы, энергии, импульса, электрического заряда и т. п.).
Переход системы из одного равновесного состояния в другое происходит посредством термодинамического процесса. Если процесс протекает так, что проходит через последовательный ряд равновесных состояний, то его называют равновесным или квазистатическим.
10.2. Всякая термодинамическая система, находящаяся в неизмененных внешних условиях, стремится к состоянию теплового равновесия и остается в нем сколь угодно долго.
Переход к состоянию теплового равновесия (релаксация) происходит по-разному в различных системах. Отклонения параметров системы от равновесных значений называют флуктуациями. Как правило, флуктуации малы и ими пренебрегают. Однако теоретически при бесконечно большом времени наблюдения возможны гигантские флуктуации, приводящие к самопроизвольному выходу системы из состояния равновесия. В реальных системах из-за конечного времени наблюдения это практически невозможно.
83
Состояние теплового равновесия характеризуют особым внутренним параметром – температурой. К определению температуры можно прийти следующим образом. Приведем в контакт две системы, каждая из которых находится в состоянии теплового равновесия. При этом либо ничего не произойдет, либо системы будут переходить в новое состояние теплового равновесия. В первом случае говорят, что системы имеют одинаковые температуры, во втором – температуры систем различны. Существенно, что введенный таким образом параметр температура не зависит ни от размеров, ни от формы системы, ни от ее внутреннего строения.
10.3. Кроме параметров состояния в термодинамике вводятся функции состояния. Функция состояния –
это такая функция параметров системы, изменение которой не зависит от вида процесса перехода системы из одного состояния в другое, а определяется только параметрами начального и конечного=состояний0 . То есть, если F – функция состояния, то .
Одной из самых важных функций состояния является внутренняя энергия системы U. Внутренней энерги-
ей системы называют сумму средней кинетической энергии хаотического движения частиц, составляющих систему (например, молекул), энергии внутримолекулярного движения и потенциальной энергии взаимодействия частиц.
Во внутреннюю энергию не входят ни кинетическая, ни потенциальная энергия системы как целого.
Существуют два способа изменения внутренней энергии системы: работа и теплообмен.
1. Работа – это способ изменения внутренней
энергии системы, связанный с упорядоченным воздей-
ствием на неё. Этот способ всегда сопряжён с изменени-
84
ем внешних параметров. Количество энергии, передаваемой этим способом, называют работой.
2. Теплообмен – неупорядоченный способ изменения внутренней энергии. При реализации этого спо-
соба не происходит изменение внешних параметров. Количество энергии, передаваемой этим способом, называют теплотой.
Работа и количество теплоты, сообщаемые системе в ходе некоторого процесса, зависят не только от параметров начального и конечного состояний, но и от вида процесса перехода системы из начального в конечное состояние, т.е. работа и теплота функциями состояния не являются. Их называют функционалами процесса.
В 1842 г. Майером и в 1847 г. Гельмгольцем было сформулировано первое начало термодинамики: изме-
нение внутренней энергии системы равно сумме количества теплоты, сообщенной системе, и работы, совершенной над системой внешними телами:
dU Q A' ,
где A' – элементарная работа внешних сил, или
U Q A' .
Если вместо работы внешних сил ввести в рассмотрение работу самой системы над внешними телами, то есть
A' A ,
то первое начало термодинамики запишется в виде:
Q dU A , или Q U A .
Первое начало термодинамики тогда можно сформулировать в виде следующего утверждения: количество теплоты, сообщенное системе, идет на изменение внутренней энергии системы и совершение системой работы против внешних сил.
Рассмотрим применение первого начала термодинамики к изопроцессам в идеальном газе. Идеальный газа

85
– это модельный термодинамический объект. Идеальным газом называют газ, молекулы которого не взаимодействуют друг с другом на расстоянии и имеют исчезающе малые собственные размеры.
Изопроцессами называются такие равновесные процессы в идеальном газе, при которых масса газа и один из его параметров не изменяются.
Изохорический процесс (рис. 17).
|
V const , |
p T const , A pdV 0 , следова- |
|||||
тельно, U Q . Найдем теплоёмкость идеального газа |
|||||||
при изохорическом процессе. |
|||||||
p |
|
Теплоемкость системы численно рав- |
|||||
|
на количеству теплоты, которое необ- |
||||||
|
|
|
1 |
|
|
ходимо сообщить системе, чтобы ее |
|
|
|
|
|
||||
|
|
||||||
|
|
|
|
|
|
температура увеличилась на 1 Кель- |
|
|
|
|
2 |
|
|
вин. Если система получила количе- |
|
|
|
|
|
|
|
|
|
V |
|
ство теплоты Q , и ее температура из |
|||||
|
|
||||||
|
|
|
|
|
|||
|
|
|
|
|
менилась на dT, то теплоемкость этой |
||
|
|
|
|
|
|||
|
Q |
|
Рис. 17 |
системы будет |
равна с |
. |
(11) |
|
|
|
|
|||
|
dT |
|
|
|
Если под системой понимается 1 моль вещества, то теплоемкость называют молярной и её обозначают С. Молярная теплоемкость при постоянном объеме равна:
С |
|
Q |
|
dU |
. |
|
|
||||
V |
|
dT dT |
|||
|
|
||||
При рассмотрении |
|
молекулярно-кинетической |
|||
теории газов покажем, что СV 2i R , где i – число степе-
ней свободы одной молекулы, а R – универсальная газовая постоянная.
m
U Q M СV T .

86
Числом степеней свободы называют минимальное число независимых координат, необходимых для полного описания положения системы в каждый момент времени.
Число степеней свободы молекул: i in iвр 2ik ,
где in – число степеней свободы поступательного движения молекулы, iвр – число степеней свободы её враща-
тельного движения; ik – число степеней свободы колебательного движения атомов, составляющих молекулу.
Для одноатомного газа: i in 3 .
Для газа, молекулы которого состоят из двух атомов, не совершающих колебательного движения: in 3 ,
iвр 2 , i 3 2 5 .
Для газа, молекулы которого состоят из трех и более атомов, не участвующих в колебательном движении, число степеней свободы равно: i 3 3 6 , т. к. iвр 3 .
Изобарический процесс (рис. 18). p const , V 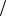 T const ,
T const ,
p |
|
|
|
A p V2 V1 , Q d U A , |
|||||||||||||
|
|
|
|
|
|
С |
p |
|
Q |
|
|
dU A |
С |
|
pdV |
|
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|||||||||
|
1 |
2 |
|
|
|
dT |
|
dT |
V |
|
dT |
||||||
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
Уравнение состояния идеально- |
||||||||
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
V |
го газа, записанное для одного моля, |
|||||||||||
|
|
|
|
|
имеет вид |
pdV RdT . |
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
||||||||
Рис. 18 Тогда получаем, что
Сp СV R (уравнение Майера) и
m
Q M Сp T ,

87
где Сp – молярная теплоемкость при постоянном давле-
нии.
Изотермический процесс (рис. 19).
p |
|
1 |
|
T const , |
pV const , |
|
|
|
|
|
|||
|
|
dT 0 , |
dU СV dT 0 , |
Q A , |
|||||||||
|
|
||||||||||||
|
|
|
|||||||||||
|
|
|
|
V2 |
|
V2 |
mRT |
|
mRT |
V |
|||
|
|
|
|
Q A |
|
pdV |
|
|
|
|
2 |
|
|
|
|
|
|
|
|
dV |
|
ln |
|
. |
|||
|
|
2 |
|
M V |
M |
V |
|||||||
|
|
V1 |
|
V1 |
|
|
|
|
1 |
|
|||
|
|
|
V |
СT , |
так как Q 0 , а dT 0 . |
||||||||
|
|
|
|||||||||||
Рис. 19
Адиабатический процесс
Адиабатическим называют процесс, происходящий в теплоизолированной от внешней среды си-
стеме, то есть в отсутствии теплообмена. Из первого начала термодинамики следует, что A dU , то есть при адиабатическом процессе система совершает работу за счет изменения её внутренней энергии.
Из уравнения Менделеева-Клапейрона и первого начала термодинамики следует уравнение адиабатического процесса (уравнение Пуассона):
pV const ,
где |
С p |
|
i 2 |
. С |
|
0 , так как Q 0 , а |
dT 0 |
|||||||||
|
|
|
||||||||||||||
|
СV |
|
i |
адиаб |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
m |
|
|
p1V1 |
|
|
|
|
V1 |
1 |
|
|
|
|
A U |
C |
T |
|
|
|
|
|
|
. |
|||||
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
M |
V |
|
1 |
|
|
V |
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
Процесс с постоянной теплоемкостью называют
политропическим процессом. Молярную теплоемкость политропического процесса обозначим как С. Уравнение политропического процесса
88
pV n const или TV n 1 const ,
где n C Cp называют показателем политропического
C CV
процесса. Теплоемкость политропического процесса рав-
на C |
n CV C p |
. Рассмотренные ранее процессы явля- |
|
||
|
n 1 |
|
ются частными случаями политропического процесса: изобарический процесс n 0 ;
изотермический процесс n 1 ; адиабатический процесс n ;
1
изохорический процесс n ( p n V const ).
ТЕСТЫ К РАЗДЕЛУ 10
1. На (P,V) – диаграмме изображены два циклических процесса. Отношение работ АI/AII, совершенных в этих циклах, равно … .
а) 2 б) –1/2 в) –2 г) 1/2
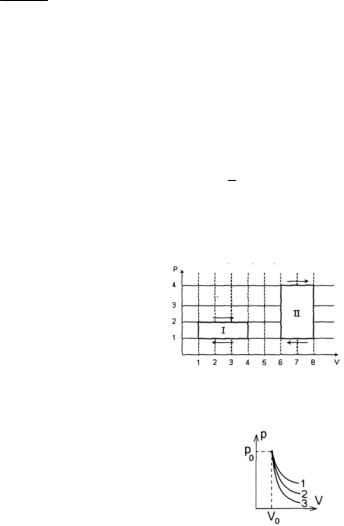
Ответ: г) 2. Три идеальных газа – одноатомный, двухатом-
ный и многоатомный – имеют одинаковое начальное давление р0 и объем V0 и совершают процесс адиабатического расширения. Кривые этих процессов показаны на (p,V)-диаграмме. Расширению одноатомного (двухатомного, трехатомного) газа соответствует кривая … .
а) 1 б) 2 в) 3
г) при адиабатическом расширении p должно рас-

89
ти, и поэтому приведенные графики не верны
Ответ: в) (б, а) 3. Молярные теплоемкости азота в
процессах 1→2 и 1→3 равны С1 и С2 соответственно. Величина отношения (С2 – С1)/С1 равна … .
а) 1/3 б) 2/5 в) 2/3 г) 1/5
Ответ: б) 4. Молярные теплоемкости идеального газа в процессах 1→2 и 1→3 равны С1 и
С2 соответственно. Их отношение С1/С2 имеет наибольшую величину … .
а) для одноатомного газа б) для двухатомного газа в) для трехатомного газа
г) для любого идеального газа отношение С1/С2 одинаково
Ответ: в)
5. Молярные теплоемкости идеального газа в процессах 1→2 и 1→3 равны С1 и С2 соответственно. Их отношение С2/С1 = 1,33. Молекулы этого газа … .
а) одноатомны |
б) двухатомны |
в) многоатомны |
г) отношение С2/С1 не может |
иметь указанную величину
Ответ: в)
6.Молярные теплоемкости кислорода
впроцессах 1→2 и 1→3 равны С1 и С2 соответственно. Их отношение С2/С1 равно … .
а) 3/5 б) 5/3 в) 5/7 г) 7/5
Ответ: г)
