
5432 / 5432
.pdfМинистерство образования и науки Российской Федерации Федеральное государственное бюджетное образовательное учреждение высшего профессионального образования žКузбасский государственный технический университет имени Т. Ф. Горбачева¤
Кафедра углехимии, пластмасс и инженерной защиты окружающей среды
КИНЕТИКА ХИМИЧЕСКИХ РЕАКЦИЙ
Методические указания к лабораторным работам по дисциплине žФизическая химия¤ для студентов специальностей:
240401 €Химическая технология органических веществ“,
240301 €Химическая технология неорганических веществ“,
240403 €Химическая технология природных энергоносителей
иуглеродных материалов“, 240502 €Технология переработки пластических масс и эластомеров“, 280705 €Инженерная
защита окружающей среды“
всех форм обучения
Составители Н. М. Ким Н. П. Лесникова
Утверждены на заседании кафедры Протокол № 5 от 17.12.2012 Рекомендованы к печати учебно-методической комиссией специальностей 240401, 240502 Протокол № 12 от 14.12.2012 Электронная копия находится в библиотеке КузГТУ
Кемерово 2012
0
1
Основные теоретические положения по кинетике химических реакций и катализу
Химическая кинетика – раздел физической химии, в котором изучается химический процесс, его механизм и закономерности протекания во времени. В химической кинетике рассматривается зависимость скорости химической реакции от концентрации реагентов, температуры, свойств среды и других факторов. Большое влияние на скорость реакции оказывает введение в реакционную систему катализатора.
Механизм химических реакций. Если реакция протекает путём прямого превращения молекул исходных веществ в молекулы продуктов реакции, то такая реакция называется элементарной (простой). Элементарная реакция является совокупностью большого числа однотипных элементарных актов химического превращения одной или нескольких частиц. Большинство химических реакций являются сложными. Механизм сложной реакции представляет собой совокупность связанных друг с другом элементарных реакций, из которых состоит сложная реакция.
Реакционное пространство. Физико-химические процессы могут протекать в системах, состоящих из одной или нескольких фаз. Химическая реакция, протекающая в пределах одной фазы, называется гомогенной. Реакционным пространством в этом случае является жидкая, газообразная или твердая часть системы. Химическая реакция, протекающая на границе раздела фаз, называется гетерогенной, а реакционное пространство есть поверхность раздела фаз.
Скорость элементарной химической реакции ( w ) равна числу однотипных элементарных актов химического превращения, совершающихся в единицу времени в единице объёма или на единице поверхности реакционного пространства. Непосредственно определить число элементарных актов, совершающихся при протекании химической реакции, невозможно. Поэтому скорость реакции обычно выражают через величину, пропорциональную числу элементарных актов, – количество вещества, реагирующего или образующегося за счёт реакции в единицу време-
2
ни в единице объёма реакционного пространства. Однако изменение количества вещества в реакционном пространстве может быть обусловлено как протеканием реакции, так и обменом вещества с окружающей средой. Поэтому рассматривают отдельно закрытые и открытые системы.
В закрытой системе изменение количества вещества с течением времени происходит только за счёт протекания в ней реакции. В закрытой системе при постоянном объёме и равномерном распределении реагентов по всему объёму реактора скорость химической реакции прямо пропорциональна изменению концентрации реагентов во времени.
Следует различать скорость реакции по данному веществу и скорость химической реакции.
Рассмотрим реакцию, протекающую в газовой фазе или растворе:
1 А1 2 А2 3 А3 4 А4 . |
(1) |
Скорость реакции (скорость реакции во всем реакционном объёме) можно определить как скорость возрастания степени завершенности реакции (величину называют также химической переменной, пробегом реакции, глубиной протекания реакции):
|
d |
, |
(2) |
|
|||
|
dt |
|
|
где t – время протекания реакции. |
|
||
Свяжем величину с величиной, которую можно реально измерить – концентрацией вещества. Количество i - го реагента (моль) в момент времени t 0 обозначим n0,i , а в момент време-
ни t 0 – ni . Изменение количества i - го вещества за это время
ni ni n0,i , |
(3) |
тогда, количество i - го компонента (моль) к моменту времени t
ni n0,i ni . |
(4) |
Изменения количеств каждого из реагентов не являются независимыми, а связаны между собой стехиометрическими соотношениями:
|
|
|
|
|
3 |
|
|
|
|
|
n1 |
|
n2 |
|
n3 |
|
n4 |
|
ni |
. |
(5) |
1 |
2 |
3 |
4 |
|
||||||
|
|
|
|
i |
|
|||||
В уравнении (5) учитывается правило знаков: для исходных веществ стехиометрические коэффициенты принимаются отрицательными, а для продуктов реакции – положительными. Из уравнения (5) получаем выражение для изменения количества i - го вещества:
|
ni i , |
|
|
(6) |
|||||||
уравнение (6) подставляем в уравнение (4), получаем |
|
||||||||||
ni n0,i i . |
(7) |
||||||||||
Дифференцируем уравнение (7) по времени, учитывая, что |
|||||||||||
n0,i const : |
|
|
|
|
|
|
|
||||
|
dni |
i |
d |
. |
|
(8) |
|||||
|
|
|
|
dt |
|||||||
|
dt |
|
|
|
|
||||||
Учитывая уравнение (2), получаем выражение для скорости |
|||||||||||
реакции во всем объёме V реакционного пространства: |
|
||||||||||
|
d |
|
1 |
|
dni |
. |
(9) |
||||
|
|
|
|||||||||
|
|
dt |
i |
dt |
|
||||||
Если учесть, что молярная |
концентрация ci ni /V , |
то |
|||||||||
ni ciV . Если в системе изменяются объём V |
и концентрация |
||||||||||||
вещества, то уравнение скорости принимает вид |
|
||||||||||||
1 |
|
d c V |
1 |
|
dV |
1 |
|
dc |
|
||||
|
|
|
i |
|
|
c |
|
|
|
V |
i |
. |
(10) |
|
|
dt |
|
|
|
|
|||||||
i |
|
i |
i dt |
i |
|
dt |
|
||||||
В химической кинетике важным понятием является скорость химической реакции w , отнесенная к единице объёма
реакционного пространства:
w |
|
. |
(11) |
|
V
С учётом уравнения (10) – скорость реакции в единице объёма при переменном объёме определяется уравнением

|
|
|
|
4 |
|
|
|
|
|
w |
1 |
c |
d lnV |
|
1 |
|
dci |
. |
(12) |
|
dt |
|
|
||||||
i |
i |
i dt |
|
||||||
Если объём реакционного пространства является постоянной величиной, то скорость реакции в единице объёма определяется уравнением
w |
1 |
|
dci |
. |
(13) |
|
|
i dt
Вуравнении (13) учитывается правило знаков. Скорость ре-
акции является положительной величиной w 0 , так как у исходных веществ dci / dt 0 и стехиометрический коэффициент берется со знаком минус, а у продуктов реакции dci / dt 0 и стехиометрический коэффициент берется со знаком плюс. Скорость реакции имеет одинаковое значение для данной реакции независимо от того, через изменение концентрации какого реагента она выражена
|
|
w |
1 |
|
|
dc1 |
|
|
1 |
|
dc2 |
|
1 |
|
dc3 |
|
1 |
|
dc4 |
. |
(14) |
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||
|
|
|
1 dt |
|
2 |
dt |
3 |
dt |
4 |
|
dt |
|
||||||||||||||||||||||
Например, для реакции 3H2 N2 |
|
2NH3 |
|
выражение скоро- |
||||||||||||||||||||||||||||||
сти реакции имеет вид |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
|
|
w |
1 dcH |
2 |
|
dcN |
2 |
|
|
1 dcNH |
3 |
, |
|
(15) |
||||||||||||||||||||
|
|
|
|
|
dt |
|
|
|
|
2 |
|
|
dt |
|
|
|||||||||||||||||||
|
|
|
3 |
|
|
|
|
|
|
|
|
|
dt |
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
т.е. H2 |
3, |
N2 |
|
1, |
NH3 |
2 . |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||
Скорость реакции по данному веществу в единице объёма при постоянном реакционном объёме определяется уравнением
wi dci , (16) dt
где ci – концентрация рассматриваемого i - го вещества в данный момент времени.
Из уравнений (13) и (16) получается уравнение, связывающее скорость химической реакции w и скорость реакции по данному веществу wi :
5
w |
1 |
w |
(17) |
|
|||
i |
i |
|
|
или |
|
|
|
wi i w . |
(18) |
||
Из формальных соображений, поскольку для исходных веществ стехиометрические коэффициенты отрицательны, а скорость реакции всегда положительная величина, скорость реакции по исходному i - му веществу является отрицательной величиной, а по продукту реакции – положительной.
Методы определения скорости реакции. Для экспериментального определения скорости реакции, протекающей в закрытой системе, необходимо определить концентрацию i - го реагента ci в различные моменты времени путем отбора проб из реакционного объёма и анализа их на содержание реагентов. Экспериментальную зависимость ci f (t) представляют в виде много-
члена, например ci c0,i at bt2 , коэффициенты уравнения на-
ходят методом наименьших квадратов. Дифференцированием этой зависимости определяют первые производные dci / dt , а затем по уравнению (13) рассчитывают скорость реакции.
Экспериментальные данные можно представить в виде графической зависимости ci f t , называемой кинетической кри-
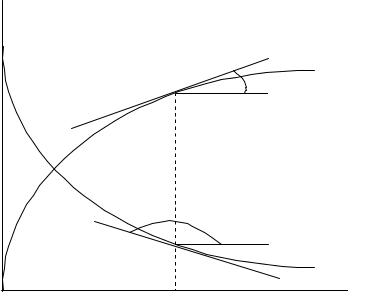
вой (рис. 1).
К кинетическим кривым проведены касательные, тангенсы углов наклона которых равны скорости по данному веществу:
tg |
dc1 |
w |
и tg |
2 |
|
dc2 |
w . |
|
|
||||||
1 |
dt |
1 |
|
|
dt |
2 |
|
|
|
|
|
|
|
Скорость реакции по исходному веществу (тангенс тупого угла) является отрицательной, а скорость реакции по продукту (тангенс острого угла) является положительной величиной. Видно, что скорость реакции снижается по мере протекания реакции, т.е. с уменьшением концентрации реагента в реакционном пространстве.
|
6 |
|
c |
|
|
c1 |
|
2 |
|
|
|
c2 |
|
1 |
|
|
|
|
t |
t |
|
|
|
Рис. 1. Кинетические кривые для исходного вещества |
||
c1 и продукта |
c2 для |
реакции A1 A2 |
Зависимость скорости реакции от концентрации реагирующих веществ называют основным законом химической кинетики или законом действующих масс. Скорость бимолекулярной элементарной реакции пропорциональна произведению концентраций реагентов в степени, равной абсолютному значению их стехиометрических коэффициентов в уравнении реакции (закон действующих масс). Позже выяснилось, что этот закон строго и теоретически обоснованно справедлив только для элементарных реакций или элементарных стадий сложных реакций.
Для любой бимолекулярной элементарной реакции |
|
|
1A1 2 A2 Продукты |
(19) |
|
закон действующих масс запишется в форме |
|
|
w kc 1c 2 , |
(20) |
|
1 |
2 |
|
где 1, 2 – стехиометрические коэффициенты (положительные значения).
Показатели степени 1, 2 в уравнении (20) называются порядками реакции по веществам A1, A2 соответственно или частными порядками. Сумма 1 2 называется общим порядком
7
реакции. Следовательно, порядок реакции равен сумме показателей степеней в уравнении зависимости скорости реакции от концентрации исходных веществ. Так как вероятность одновременной встречи четырех частиц практически равна нулю, то порядок элементарной реакции не бывает больше трех. Уравнение (20), выражающее зависимость скорости реакции от концентрации, называется кинетическим уравнением.
Введем понятие формально простых реакций. К формально простым реакциям относят любые сложные реакции, для которых кинетическое уравнение в требуемом интервале изменения концентраций может быть получено на опыте приближенно в виде степенной зависимости:
w kcn1 cn2 |
, |
(21) |
|
1 |
2 |
|
|
где n1, n2 – порядок реакции по веществам A1, A2 . Общий порядок реакции n n1 n2 . При этом значения n1, n2 могут быть не равны стехиометрическим коэффициентам, они могут принимать целые, дробные и отрицательные значения, а также быть равными нулю.
Коэффициент пропорциональности ( k ) в уравнении (21) называется константой скорости реакции. По физическому смыслу константа скорости реакции это скорость реакции при единичных концентрациях реагирующих веществ, поэтому ее называют также удельной скоростью. Это указывает на то, что величина константы зависит от всех факторов, влияющих на скорость реакции, за исключением концентрации реагирующих веществ. Числовое значение константы скорости зависит от выбора единиц времени и концентрации. Размерность константы скорости определяется тем кинетическим уравнением, по которому производится ее расчет, т.е. зависит от порядка реакции (n ):
1 n |
1 |
. |
k c |
t |
Молекулярность реакции имеет ясный физический смысл, указывает на конкретное число частиц (атомов или молекул), участвующих в элементарной реакции. Реакции бывают мономолекулярные, бимолекулярные и тримолекулярные. Поскольку вероятность одновременного столкновения четырех и более моле-
8
кул близка к нулю, то четырехмолекулярных реакций нет Понятие žмолекулярность¤ неприменимо к сложной реакции.
Рассмотрим кинетику реакций первого и второго порядков. Вначале рассмотрим реакции первого порядка. Запишем одностороннюю реакцию первого порядка:
A Продукты . |
(22) |
|||||||||||
Согласно закону действующих масс кинетическое уравне- |
||||||||||||
ние для односторонней реакции первого порядка имеет вид |
|
|||||||||||
|
w kc1. |
(23) |
||||||||||
Скорость реакции по исходному веществу определяется со- |
||||||||||||
отношением |
1 |
|
|
dc1 |
|
dc1 |
|
|
||||
w |
|
|
|
. |
(24) |
|||||||
1 |
|
|
|
|
||||||||
|
|
|
dt |
|
|
dt |
|
|||||
Подставляем это выражение в уравнение (23), опускаем для |
||||||||||||
простоты индекс 1: |
|
dc |
|
|
|
|
|
|
|
|||
|
|
|
kc . |
(25) |
||||||||
|
|
|
||||||||||
|
|
dt |
|
|
|
|
|
|
|
|
||
Разделяем переменные и интегрируем уравнение в пределах |
||||||||||||
от c0 до с и от 0 до t : |
c |
|
dc |
t |
|
|||||||
|
|
|
||||||||||
|
|
|
|
|
|
|
kt , |
(26) |
||||
|
c |
|
|
|||||||||
|
c |
|
|
|
|
0 |
|
|
|
|||
получаем |
0 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
ln c ln c0 |
kt |
(27) |
||||||||||
или |
|
|
|
|
|
|
|
|
|
|
|
|
ln c ln c0 |
kt . |
(28) |
||||||||||
Из уравнения (28) следует, что концентрация исходного вещества экспоненциально уменьшается с течением времени (рис. 1). Аналогично изменяется и скорость реакции. Из уравнения (28) получим уравнение для расчёта константы скорости реакции:
k |
1 |
ln |
c0 |
. |
(29) |
|
|
||||
|
t c |
|
|||
9
Размерность константы скорости: k время–1; поэтому её
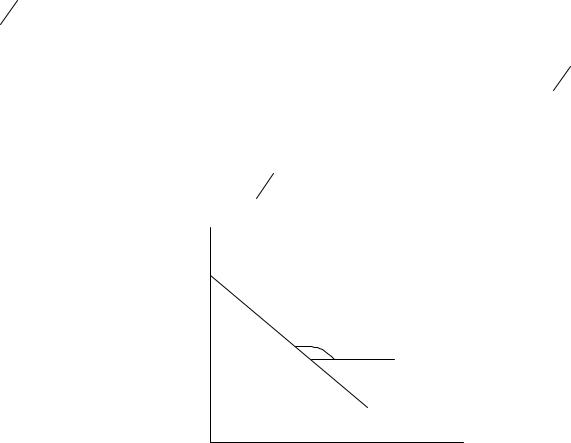
числовое значение зависит от единиц, в которых выражается время. Значения константы скорости химической реакции можно также вычислить по тангенсу угла наклона прямой, построенной
по |
опытным данным в координатах ln c t (рис.2), тогда |
tg k . |
|
|
Определим период полураспада (время полупревращения) |
t 1 |
– промежуток времени, в течение которого прореагирует по- |
2 |
|
ловина взятого количества вещества. Время полупревращения
можно рассчитать, если подставить в уравнение (28) |
t t 1 и |
|||||
|
c0 |
|
|
|
|
2 |
c |
, тогда получим: |
|
|
|
|
|
|
|
|
|
|
||
2 |
|
|
c0 |
|
|
|
|
|
t 1 |
|
. |
(30) |
|
|
|
|
||||
2 |
|
2k |
|
|||
|
|
ln c |
|
|
|
|
|
|
ln c0 |
|
|
|
|
t |
|
Рис. 2. Зависимость ln c исходного реагента |
|
от времени для реакции первого порядка |
|
Рассмотрим реакции второго порядка, протекающие по |
|
уравнению |
|
A1 A2 Продукты |
(31) |
При постоянном объеме скорость реакции в закрытых системах можно выразить по основному закону кинетики через кон-
