
Физическая химия Часть 1 учебное пособие
.pdf
80
dTdp = ∆HTRTиспp ,
после преобразований получаем выражение
d ln p |
= ∆Hисп , |
(2.1.8) |
dT |
RT 2 |
|
где ∆Hисп – молярная теплота испарения.
Поскольку все величины в правой части уравнения положительны, производная d ln p / dT > 0 , т. е. с ростом температуры дав-
ление насыщенного пара над жидкостью всегда увеличивается. Аналогичные выводы можно сделать для процесса возгонки,
для которого уравнение Клаузиуса – Клапейрона имеет вид
d ln p |
= ∆Hвозг . |
dT |
RT 2 |
Интегрирование уравнений (2.1.8) и (2.1.9) ∆Hисп и ∆Hвозг не зависят от температуры, дает:
ln p =C − ∆HRисп T1 ;
ln p =C − ∆HRвозг T1 ,
(2.1.9)
при условии, что
(2.1.10)
(2.1.11)
где C – константа интегрирования. Зависимость ln p от 1/T имеет
линейный характер.
По наклону двух прямых вычисляем теплоту испарения
и возгонки.
Интегрируем уравнения (2.1.8) и (2.1.9) в пределах от p1 до p2 и соответственно от T1 до T2 , считая, что теплоты фазовых перехо-
дов в узком интервале температур не зависят от температуры, получаем
ln |
p 2 |
= |
∆Hисп |
T2 −T1 |
, |
ln |
p 2 |
= |
∆Hвозг |
T2 −T1 |
. (2.1.12) |
p |
|
p |
T T |
||||||||
|
|
R T T |
|
|
|
R |
|
||||
|
1 |
|
2 1 |
|
|
1 |
|
|
2 1 |
|
|
81
Отсюда можно рассчитать теплоты фазовых переходов. При точных расчетах нужно учитывать зависимость теплоты фазового перехода от температуры, т. е. использовать уравнение Кирхгоффа.
2.1.4. Диаграммы состояния однокомпонентных систем
Для однокомпонентной системы, на равновесие которой из внешних факторов влияет только давление и температура, правило фаз Гиббса выражается уравнением
С =1 −Ф + 2 = 3 −Ф. |
(2.1.13) |
Следовательно, максимальное число фаз, находящихся в равновесии, при Сmin = 0 равно трем. Чаще всего это твердая фаза,
жидкая и газообразная, между этими фазами возможны гетерогенные равновесия:
тв ж; ж г; тв г
Определим число и характер переменных при Фmin =1,
C = 3 −1 = 2. Состояние однокомпонентной вполне определяется двумя независимыми параметрами, например давлением и температурой. Объем системы можно рассчитать, зная зависимость V = f (p,T ). Если по трем координатным осям отложить, соответст-
венно, давление, температуру и объем системы, то полученная пространственная диаграмма, выражающая зависимость состояния системы и фазовых равновесий в ней от внешних условий, называется
диаграммой состояния или фазовой диаграммой. Пространствен-
ные диаграммы трудно строить и использовать. Поэтому чаще используют плоскую фазовую диаграмму, представляющую собой проекцию пространственной диаграммы состояния на плоскость
Р– Т. Плоская фазовая диаграмма описывает состояния однокомпонентной системы и фазовые равновесия в ней при различных Р и Т и постоянном V (применяются и плоские фазовые диаграммы
Р– V, Т – V).
Воснове анализа диаграмм лежат два принципа Курнакова:
принцип непрерывности и принцип соответствия. Согласно прин-
ципу непрерывности при непрерывном изменении параметров, определяющих состояние системы, свойства отдельных фаз изменяются также непрерывно, свойства же всей системы в целом изме-
82
няются непрерывно лишь до тех пор, пока не меняется число или природа фаз. При исчезновении старых или появлении новых фаз свойства системы в целом изменяются скачкообразно.
Согласно принципу соответствия на диаграмме состояния при равновесии каждому комплексу фаз и каждой фазе в отдельности соответствует свой геометрический образ: плоскость, линия, точка. По диаграмме состояния можно установить число фаз, их химическую природу и границы существования фаз.
На плоской диаграмме состояния каждой фазе отвечает участок плоскости (область или поле). Равновесия двух фаз на диаграмме состояния изображаются линиями пересечения областей. Равновесия трех фаз – точкой пересечения этих линий, называемой тройной точкой.
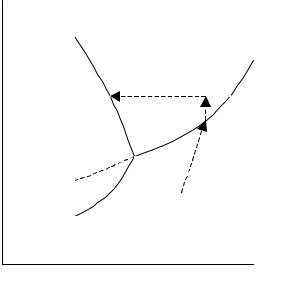
На рис. 2.1 приведена диаграмма состояния воды в области средних давлений (до 1 МПа). Три кривые разбивают диаграмму три поля, каждое из которых отвечает одному из агрегатных состояний воды – пару, жидкости или льду.
Кривые отвечают равновесию между соответствующими двумя фазами. Кривая ОС характеризует зависимость давления насыщенного пара жидкой воды от температуры и называется кривой испарения. Иначе: зависимость температуры испарения от внешнего давления. Кривая зависимости соответствует уравнению Клаузиуса – Клапейрона для процесса испарения.
Кривая ОА характеризует зависимость давления насыщенного пара льда от температуры и называется кривой возгонки. Иначе: зависимость температуры возгонки от внешнего давления. Кривая зависимости описывается уравнением Клаузиуса – Клапейрона для процесса возгонки.
Вдоль кривых испарения и возгонки при повышении температуры или внешнего давления совершаются процессы кипения или возгонки. При понижении температуры или внешнего давления вдоль этих кривых происходят обратные процессы конденсации пара, т. е. переход его в жидкую или твердую фазу.
Кривая ОВ характеризует зависимость температуры замерзания воды от внешнего давления и называется кривой плавления. Кривая зависимости описывается уравнением Клаузиуса – Клапейрона для процесса плавления.
83
p |
Жидкость |
|
|
В |
|
|
|
4 |
3 |
С |
|
Лед |
|
|
|
|
2 |
|
|
D |
О |
|
|
1 |
Пар |
||
А |
|||
|
|
||
|
|
T |
Рис.4.3. Диаграмма состояния воды
.
Вдоль кривой плавления происходит переход твердой фазы в жидкую фазу. Для веществ типа воды, у которых объем твердой фазы больше объема жидкой фазы, температура плавления при повышении давления уменьшается, и кривая плавления имеет направление, указанное на рис. 2.1. У большинства веществ объем твердой фазы меньше объема жидкой фазы, поэтому кривая плавления имеет иное направление: с повышением давления температура плавления растет.
Кривая OD определяет давление насыщенного пара над переохлажденной водой. Такое состояние неустойчивое, так как переохлажденная вода всегда обладает большим давлением пара, т. е. большим химическим потенциалом, чем лед при той же температуре. Переохлажденная вода находится в метастабильном равновесии с паром. При внесении в такую воду нескольких кристалликов льда произойдет ее быстрое замерзание.
В точке O в равновесии сосуществуют три фазы и число степеней свободы С = 3 −Ф = 3 −3 = 0 , т. е. система безвариантна. Это означает, что фазы воды могут находиться в равновесии только при определенных условиях: р = 6,1 гПа и Т = 273,1576 К (0,0076 ºС). При атмосферном давлении (1013 гПа) лед тает при более низкой температуре, чем в тройной точке. Это объясняется тем, что кривая равновесного сосуществования воды и льда наклонена влево и удельный вес льда больше, чем воды.
84
Если к системе в тройной точке подводить теплоту, то она будет расходоваться на плавление льда, но ни температура, ни давление не изменятся до тех пор, пока в системе существуют три фазы, так как в тройной точке С = 0. Когда весь лед расплавится, то останутся две равновесные фазы: жидкость и пар. Система становится одновариантной (С = 3 – 2 = 1) и при дальнейшем нагревании процесс пойдет в соответствии с кривой испарения ОС. Охлаждение в тройной точке вызовет образование льда. Пока вся вода не превратится в лед, температура и давление будут оставаться постоянными. При дальнейшем охлаждении системы, когда останутся две фазы (лед и пар), система станет одновариантной и процесс конденсации пара пойдет в соответствии с кривой ОА.
Проследим за фазовыми превращениями вещества по мере изменения давления и температуры. Рассмотрим движение фигуративной точки, характеризующей состояние системы. Пусть в исходном состоянии система парообразна (точка 1). Будем изменять температуры и давление (С = 2) так, чтобы фигуративная точка сис-
темы двигалась вверх по прямой линии 1 → 2 . Когда эта точка попадет на кривую ОС (точка 2), начнется конденсация пара, и система становится двухфазной и моновариантной. В процессе конденсации фигуративной точкой будет точка 2, пока не исчезнет последняя порция пара. Далее состояние системы может изменяться по одному из двух направлений. Если увеличивать давление по прямой 2 → 3, сохраняя достигнутую температуру постоянной, то фигуративная точка перейдет в поле жидкости. Здесь число степеней свободы вновь становится равным двум, и, чтобы, например, вызвать кристаллизацию жидкости, надо уменьшить температуру по линии 3 → 4 . В точке 4 появятся первые кристаллы твердой фазы. Если же повышать давление от точки 2 (температура тоже может изменяться в соответствии с уравнением Клаузиуса – Клапейрона), то фигуративная точка системы будет двигаться от точки 2 вверх по кривой
ОС.
2.1.5. Диаграммы состояния двухкомпонентных систем
Физико-химический анализ. Термический анализ.
Вхимии используется несколько методов изучения природы
исвойств вещества. Наиболее широко используется препаративный
85
метод, он основан на выделении из системы данного вещества различными способами (кристаллизация, перегонка и др.) и изучение его состава и свойств (оптических, магнитных, электрических и т. д.). Однако этот метод оказался недостаточным при изучении многих систем, таких как растворы, расплавы, смолы, стекла и другие многокомпонентные системы.
Для изучения этих систем разработан метод физико- химического анализа. Этот метод основан на изучении зависимости физических свойств химической системы, определяющих ее равновесие. В качестве изучаемых свойств используются тепловые, электрические, магнитные, оптические и др. Особенно широкое применение находит метод исследования, основанный на изучении зависимости физических свойств системы от ее состава.
По определению Курнакова метод физико-химического анализа есть «геометрический метод исследования химических превращений». В этом методе применяют геометрический анализ диаграмм, построенных в координатах физическое свойство – фактор равновесия (давление, температура, состав). Анализ таких диаграмм позволяет установить протекающие в системе качественные изменения, характер взаимодействия между компонентами, область существования и составы равновесных фаз.
Одним из наиболее распространенных видов физикохимического анализа является термический анализ, в котором экспериментально определяется температура, соответствующая изменению числа фаз.
Для двухкомпонентных систем (К = 2) правило фаз выражается формулой
|
C = К −Ф + 2 = 4 −Ф. |
(2.1.14) |
Так как |
Сmax = 4 −Фmin = 4 −1 = 3, |
(2.1.15) |
то диаграмма состояния должна изображаться в пространственной системе координат температура – давление – состав. Но диаграмму состояния можно построить на плоскости. Если компоненты нелетучие или малолетучие, то влияние давления не учитывается. В этом случае уравнение (2.1.14) имеет вид
С = 3 −Ф, |
(2.1.16) |
86
следовательно, вариантность уменьшается на единицу. Число равновесных фаз не может быть больше Ф = 3 (при С = 0), а число степеней свободы не может быть больше С = 2 (при Ф = 1). Переменными являются температура и состав фаз.
Диаграммы состояния двойных систем с твердыми фазами получают при постоянном (атмосферном) давлении методом термического анализа, поэтому их называют диаграммами плавкости. Диаграммы плавкости применяют для изучения равновесия кристаллы – жидкость. Эти диаграммы выражают зависимость температур плавления смесей от их состава.
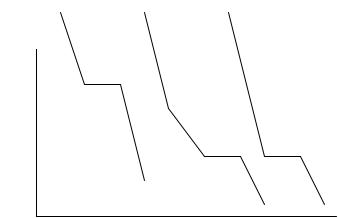
Для построения диаграммы плавкости снимают кривые охлаждения как для чистых веществ, так и для смесей различного состава. Расплавленную смесь охлаждают, измеряя через равные промежутки времени температуру. Далее в координатах время – температура строят кривую охлаждения. Процессы, сопровождающиеся выделением теплоты (кристаллизация, химические реакции, полиморфные превращения и т. д.), отражаются на кривой охлаждения горизонтальными участками с постоянной температурой или с участками с замедленной скоростью охлаждения. Некоторые типы кривых охлаждения приведены на рис. 2.2. На кривой охлаждения а до точки первого перегиба протекает процесс охлаждения расплава чистого вещества, при этом С = К −Ф +1 =1 −1 +1 =1, так как состав зафиксирован (чистое вещество), поэтому изменяется температура. После появления первых кристаллов чистого вещества С =1 − 2 +1 = 0 температура становится постоянной, так как при кристаллизации выделяется тепло. После окончания кристаллизации остается одна твердая фаза и С = 1, поэтому температура вновь начинает понижаться. Вторая кривая б характерна для смеси неизоморфных веществ. До точки первого перегиба протекает процесс охлаждения расплава. Затем начинается кристаллизация того компонента, которого в смеси больше, чем в эвтектической смеси, выделяющееся при этом тепло уменьшает скорость охлаждения. Так как С = 1, температура изменяется. После достижения точки второго излома начинается одновременная кристаллизация обоих веществ, но так как вещества неизоморфные и не растворимы в твердом состоянии, то при кристаллизации они образуют две твердые фазы. Так как в точке второго излома С = 0, то на кривой появляется горизонтальный участок.
87
Т а б в
Время
Рис.4.6. Типы кривых охлаждения: а – чистое вещество; б – смесь двух
неизоморфных веществ; в – эвтектическая смесь веществ
После окончания кристаллизации в системе остается две твердые фазы и С = 1, поэтому температура начинает снова понижаться. Третья кривая в является типичной для охлаждения эвтектической смеси (эвтектическая смесь – легкоплавкая). До точки первого излома происходит охлаждение смеси, затем начинается одновременная кристаллизация двух веществ, образующих две твердые фазы. Пока не исчезнет расплав, температура смеси не понижается, так как С = 0, после исчезновения расплава происходит охлаждение двух твердых фаз веществ. Для построения диаграммы плавкости на координатную сетку температура – состав наносят все температурные остановки и точки излома на кривых охлаждения и соединяют полученные точки.
Системы с эвтектикой.
Если компоненты заметно отличаются структурой кристаллов, то они относятся к классу неизоморфных веществ, не растворимых в твердом состоянии. При затвердевании расплава кристаллизуется один компонент, в то время как другой остается в расплаве. Поэтому неизоморфные смеси в твердом состоянии неоднородны и состоят из двух твердых фаз. Компоненты этой смеси не образуют между собой химическое соединение. Диаграмма состояния рассматривается для расплава, все сказанное о ней справедливо и для раствора.
88
Температуры плавления чистых компонентов A и B отмечены точками ТА и ТВ (рис. 2.3).
Т |
М |
|
Т |
ТА |
|
М |
|
|
|
||
|
|
|
|
а2 |
|
ТВ |
а |
|
|
|
|
а0 |
b1 |
|
|
b2 |
|
b |
|
|
|
||
b0 |
|
|
|
TE F d0 |
E |
G |
d1 |
d |
A |
Состав |
B |
Время |
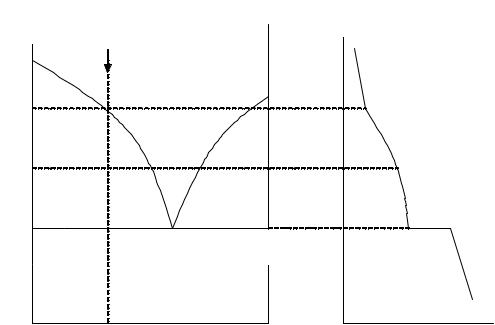
Рис. 4.7. Диаграммасостояниясистемысэвтектикой
Кривая ТАЕ соответствует составу расплава; каждая точка на
ней характеризует равновесие расплава с кристаллами вещества A, т. е. показывает растворимость вещества A в расплаве при данной температуре. Кривая ТВЕ указывает состав расплава, который при
соответствующей температуре находится в равновесии с кристаллами вещества B ; каждая точка на данной кривой отражает растворимость вещества B в расплаве. Кривые ТАЕ и ТВЕ называются
линиями ликвидуса.
Точка E пересечения линий ликвидуса показывает температуру и состав расплава, который одновременно находится в равновесии с кристаллами вещества А и вещества В. Точка E называется эвтектической точкой. Расплав, соответствующий точке E , называется эвтектическим расплавом, а температура ТЕ называется эв-
тектической температурой. Смесь кристаллов веществ A и B , которая одновременно выпадает при температуре ТЕ, называется твер-
89
дой эвтектикой. Твердая эвтектика состоит из двух твердых фаз (кристаллов A и B ).
Каждая точка на прямой FG показывает состав системы, состоящей из расплава (точка Е) и двух твердых фаз: кристаллов A и B . Линия FG называется эвтектической прямой или линией солидуса. Ниже этой прямой жидкая фаза отсутствует.
Линиями ликвидуса и солидуса диаграмма делится на четыре участка. Площадь выше линии ликвидуса – одна фаза (расплав). Площадь ТАFT – расплав + кристаллы A; площадь ТВGE – рас-
плав + кристаллы B ; площадь AFGB – смесь кристаллов A и B . Рассмотрим процесс охлаждения, заданного фигуративной
точкой М на диаграмме. Фигуративной точкой называется любая точка на диаграмме, характеризующая температуру и состав системы в целом. В точке М имеем расплав с двумя степенями свободы. При понижении температуры до точки а0 начинается выпадение
первых кристаллов вещества A из расплава. Так как C =1, можем менять произвольно только температуру, а состав расплава при каждой температуре определяется кривой ТАЕ. На кривой охлажде-
ния в точке а наблюдается излом.
При дальнейшем охлаждении системы продолжается выпадение кристаллов из расплава. Для определения состава расплава в точке b0 проводим через точку b0 горизонтальную линию b2b1, ко-
торая называется коннодой (нодой). По точке b2 определяем состав твердой фазы (кристаллы A), а по точке b1 – состав расплава при
данной температуре. Кривая охлаждения на участке ad более пологая, чем на участке Ma. Это объясняется выделением теплоты при кристаллизации вещества A. При дальнейшем охлаждении система достигает фигуративной точке d0 . При этом состав расплава в точке
E становится эвтектическим и начинается выпадение твердой эвтектики., т. е. смеси кристаллов A и B . В точке d0 (после выпаде-
ния первых кристаллов B ) находятся в равновесии три фазы: одна жидкая и две твердых и число степеней свободы равно С = 3 − 3 = 0 , т. е. система безвариантная. На кривой охлаждения выпадение твердой эвтектики представлено прямой dd1. Твердая эвтектика
имеет мелкокристаллическое строение. Ранее выпавшие кристаллы A были сравнительно крупных размеров. Процесс кристаллизации в фигуративной точке d0 при температуре ТЕ заканчивается полным
