- •И.А. Короткий Научные основы криологии
- •Кемерово 2005
- •Предисловие
- •Введение
- •1. Базовые термодинамические понятия и законы. Применение первого и второго закона термодинамики
- •1.1. Принцип сохранения массы, материальный баланс
- •1.2. Принцип сохранения энергии. Энергетический баланс
- •1.3. Принцип возрастания энтропии. Уравнение энтропийного баланса. Необратимость и затрата работы
- •1.4. Принцип недостижимости абсолютного нуля термодинамической температуры
- •Контрольные вопросы:
- •2. Термодинамические диаграммы и процессы криогенных систем
- •2.1. Равновесные состояния и фазовые переходы чистых веществ
- •2.2. Рабочие диаграммы криогенных систем
- •2.3. Равновесные состояния и фазовые переходы бинарных систем
- •Контрольные вопросы и задания:
- •3. Основные процессы для получения низких температур
- •3.1. Процессы внешнего и внутреннего охлаждения
- •3.2. Сжатие реальных газов в обратных термодинамических циклах
- •Контрольные вопросы и задания:
- •4. Процессы, сопровождающиеся понижением температуры
- •4.1. Дросселирование газов, паров и жидкостей
- •4.2. Равновесное адиабатное расширение газа в детандере
- •Контрольные вопросы и задания:
- •5. Идеальные циклы криогенных систем
- •5.1. Криогенное термостатирование
- •5.2. Криогенное охлаждение
- •5.3. Криогенная конденсация и кристаллизация
- •5.4. Ожижение криогенных газов
- •5.5. Разделение газовых смесей
- •Контрольные вопросы и задания:
- •6. Реальные циклы криогенных систем
- •6.1. Классификация криогенных циклов
- •6.2. Основные характеристики реальных циклов низкотемпературных систем
- •6.3. Энергетический баланс отдельных ступеней охлаждения
- •6.4. Ступени охлаждения криогенных систем
- •6.4.1. Ступень внешнего охлаждения
- •6.4.2. Ступень с расширением потока в детандере
- •6.4.3. Ступень с расширением потока в дроссельном устройстве
- •Контрольные вопросы и задания:
- •7. Основные циклы низкотемпературных установок
- •7.1. Дроссельные циклы ожижения
- •7.1.1. Цикл с простым дросселированием
- •7.1.2. Цикл с предварительным охлаждением и дросселированием
- •7.1.3. Цикл с двойным дросселированием и циркуляцией части потока
- •7.1.4. Цикл с двойным дросселированием и предварительным охлаждением
- •7.2. Комбинированные циклы с дросселированием и расширением рабочего вещества в детандерах
- •7.2.1. Циклы среднего и высокого давления
- •7.2.2. Цикл низкого давления с турбодетандером
- •7.2.3. Цикл с расширением в детандере, дросселированием и предварительным охлаждением
- •Контрольные вопросы и задания:
- •8. Газовые холодильные машины
- •Контрольные вопросы и задания:
- •9. Разделение газовых смесей
- •9.1. Равновесные составы фаз идеальной системы
- •9.2. Процесс ректификации бинарной смеси
- •9.3. Ректификационная колонна
- •9.4. Колонна однократной ректификации
- •9.5. Двукратная ректификация
- •Контрольные вопросы и задания:
- •10. Теплообменные аппараты криогенных установок
- •10.1. Особенности теплообменника в криогенных системах
- •10.2. Теплообменные аппараты, их классификация и виды теплообменных поверхностей
- •10.3. Эффективность теплообменников
- •10.4. Теплоизоляция криогенных систем
- •Библиографический список
- •Оглавление
- •Научные основы криологии
- •650056, Г. Кемерово, б-р Строителей, 47
- •650010, Г. Кемерово, ул. Красноармейская, 52
2.2. Рабочие диаграммы криогенных систем
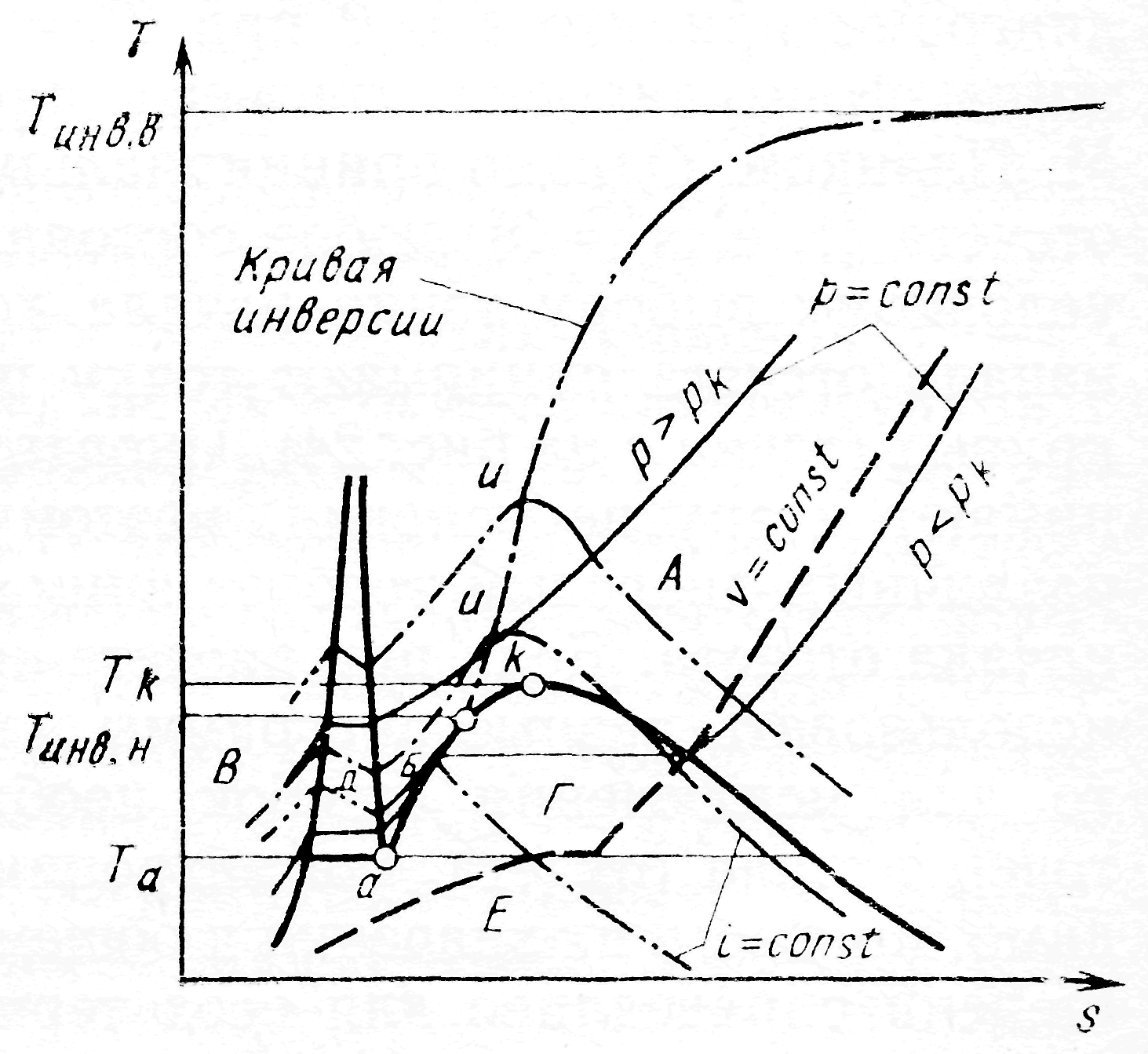
Рабочими диаграммами являются Т-s и i-s диаграммы.
Диаграмма T-s. Общий вид диаграммы Т-s для чистого вещества представлен на рис. 4. Основное преимущество диаграммы Т-s заключается в наглядности и простоте изображения важнейших рабочих процессов (изоэнтропы - вертикальные линии; изотермы - горизонтальные линии; количества теплоты - площади под линиями процессов; изобары в первом приближении отражают процессы в теплообменниках). Угловые коэффициенты изобар и изохор определяются следующим образом:
(dT/ds)p = T/cp; (dT/ds)v = Т/сp. (11)
Производная (dT/ds)p всегда положительная, поэтому изобары для однофазных состояний - всегда восходящие кривые. Для двухфазных состояний ср не имеет смысла. В области насыщения для чистого вещества изобары совпадают с изотермами.
Изохора, исходящая из одной точки с изобарой в области перегретого пара, располагается круче, поскольку ср всегда больше cv и
(dT/ds)n > (dT/ds)p . (12)
В области насыщения сp не теряет своего физического смысла, но численно изменяется, поэтому изохоры при вхождении в область насыщения обычно имеют точку перелома на линии насыщения; в этой точке изменяется угловой коэффициент. При пересечении с изотермой тройной точки (Та) изохора имеет разрыв.
Угловой коэффициент изоэнтальпы в координатах Т-s определим из следующего выражения:
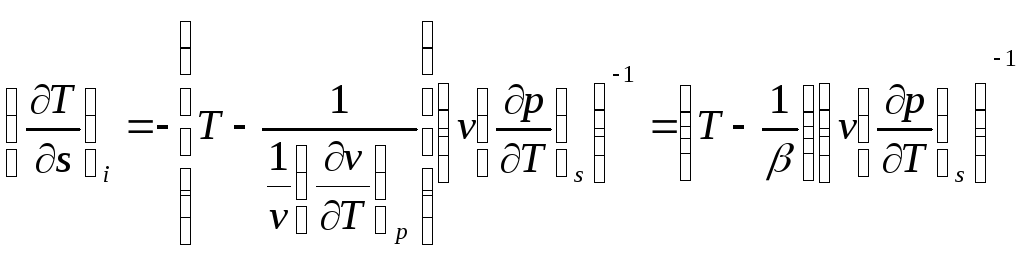 , (13)
, (13)
где - температурный коэффициент объемного расширения.
Знаменатель этого выражения положительный, и характер изоэнтальп определяется соотношением T и 1/. В той части области газообразных состояний и области насыщения, где 1/ <<T, изоэнтальпы представляют собой падающие кривые. При больших плотностях, наоборот, 1/ > T , и в этой области состояний изоэнтальпы - восходящие линии. В точках экстремума (максимума) угловой коэффициент (dT/ds)i =0, и уравнение кривой, являющейся геометрическим местом точек экстремумов, в соответствии с выражением (13) имеет вид:
(dv/dT)p = v/T (14)
и представляет собой уравнение линии инверсии. В этих точках частная производная (дТ/др)i также обращается в нуль. При построении диаграмм Т-s существенно определение абсолютных значений s или выбор начала отсчета. Для ряда диаграмм принято s–0 при Т=0.
|
|
Основанием для этого служила фор-мулировка третьего начала термодинамики, данная М. Планком. Однако принципиально возможно принять за начало отсчета (т.е. s = 0) любое состояние. Такой прием равноценен условному выбору точки начала координат. Например, часто за начало отсчета принимают точку пересечения двух пограничных кривых (точка а на рис. 4). |
|
Рис. 4. Общий вид диаграммы Т-s для чистого вещества (А-Е - области): А - газообразных состояний; Б - жидких состояний; В - твердых состояний; Г - кипения-конденсации; Д - плавления-затвердевания; Е - сублимации |
Иногда при построении диаграмм принимают и другие условия, поэтому практическое использование различных диаграмм требует внимательного отношения к выбору начала отсчета. Если при расчете криогенной системы приходится использовать разные диаграммы для одного и того же вещества, то для исключения ошибок необходимо проверить совпадение точек начала отсчета для энтропии и энтальпии и, если необходимо, привести их значения к общему началу отсчета. Это в равной степени справедливо для всех термодинамических диаграмм.
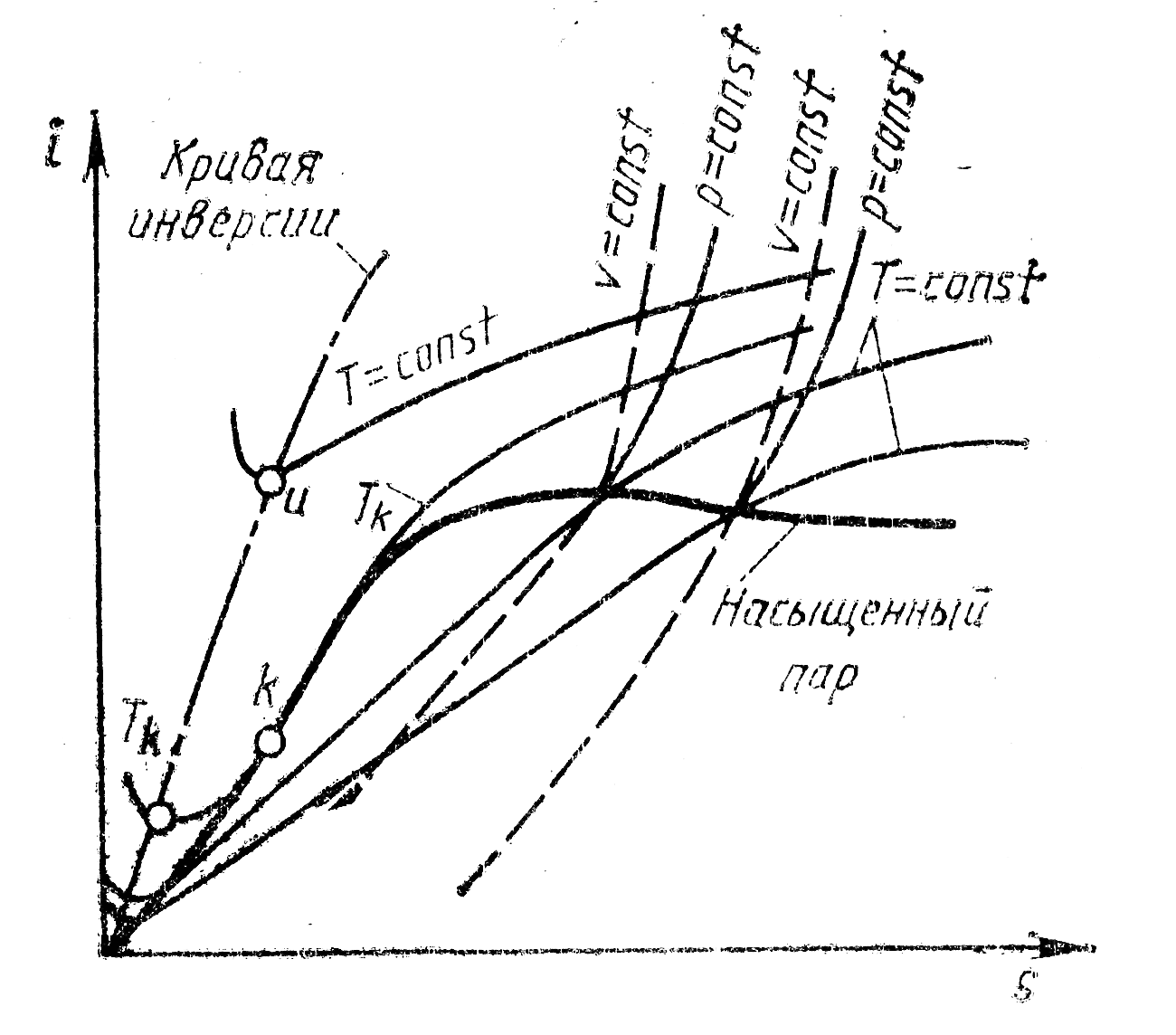
Диаграмма i-s. Угловой коэффициент изотермы в координатах i-s составляет:
![]() .
(15)
.
(15)
В области Т > 1/ изотермы являются восходящими кривыми, а в области Т < 1/ - падающими. Таким образом, по характеру прохождения изотермы в диаграмме i-s обратны изоэнтальпам в координатах T-s. В точках инверсии производная (di/ds)T обращается в нуль. Изохоры в координатах i-s проходят круче изобар (рис. 5).
|
|
В области двух-фазных состояний (dv/dT)p →, поэтому di/ds)T=(di/ds)p=T=const. Изотермы совпадают с изобарами и являются прямыми линиями. С повышением температуры угол наклона прямых увеличивается. Диаграмму i-s используют при расчетах и исследовании детандерных машин. |
|
Рис. 5. Общий вид диаграммы i-s |