- •И.А. Короткий Научные основы криологии
- •Кемерово 2005
- •Предисловие
- •Введение
- •1. Базовые термодинамические понятия и законы. Применение первого и второго закона термодинамики
- •1.1. Принцип сохранения массы, материальный баланс
- •1.2. Принцип сохранения энергии. Энергетический баланс
- •1.3. Принцип возрастания энтропии. Уравнение энтропийного баланса. Необратимость и затрата работы
- •1.4. Принцип недостижимости абсолютного нуля термодинамической температуры
- •Контрольные вопросы:
- •2. Термодинамические диаграммы и процессы криогенных систем
- •2.1. Равновесные состояния и фазовые переходы чистых веществ
- •2.2. Рабочие диаграммы криогенных систем
- •2.3. Равновесные состояния и фазовые переходы бинарных систем
- •Контрольные вопросы и задания:
- •3. Основные процессы для получения низких температур
- •3.1. Процессы внешнего и внутреннего охлаждения
- •3.2. Сжатие реальных газов в обратных термодинамических циклах
- •Контрольные вопросы и задания:
- •4. Процессы, сопровождающиеся понижением температуры
- •4.1. Дросселирование газов, паров и жидкостей
- •4.2. Равновесное адиабатное расширение газа в детандере
- •Контрольные вопросы и задания:
- •5. Идеальные циклы криогенных систем
- •5.1. Криогенное термостатирование
- •5.2. Криогенное охлаждение
- •5.3. Криогенная конденсация и кристаллизация
- •5.4. Ожижение криогенных газов
- •5.5. Разделение газовых смесей
- •Контрольные вопросы и задания:
- •6. Реальные циклы криогенных систем
- •6.1. Классификация криогенных циклов
- •6.2. Основные характеристики реальных циклов низкотемпературных систем
- •6.3. Энергетический баланс отдельных ступеней охлаждения
- •6.4. Ступени охлаждения криогенных систем
- •6.4.1. Ступень внешнего охлаждения
- •6.4.2. Ступень с расширением потока в детандере
- •6.4.3. Ступень с расширением потока в дроссельном устройстве
- •Контрольные вопросы и задания:
- •7. Основные циклы низкотемпературных установок
- •7.1. Дроссельные циклы ожижения
- •7.1.1. Цикл с простым дросселированием
- •7.1.2. Цикл с предварительным охлаждением и дросселированием
- •7.1.3. Цикл с двойным дросселированием и циркуляцией части потока
- •7.1.4. Цикл с двойным дросселированием и предварительным охлаждением
- •7.2. Комбинированные циклы с дросселированием и расширением рабочего вещества в детандерах
- •7.2.1. Циклы среднего и высокого давления
- •7.2.2. Цикл низкого давления с турбодетандером
- •7.2.3. Цикл с расширением в детандере, дросселированием и предварительным охлаждением
- •Контрольные вопросы и задания:
- •8. Газовые холодильные машины
- •Контрольные вопросы и задания:
- •9. Разделение газовых смесей
- •9.1. Равновесные составы фаз идеальной системы
- •9.2. Процесс ректификации бинарной смеси
- •9.3. Ректификационная колонна
- •9.4. Колонна однократной ректификации
- •9.5. Двукратная ректификация
- •Контрольные вопросы и задания:
- •10. Теплообменные аппараты криогенных установок
- •10.1. Особенности теплообменника в криогенных системах
- •10.2. Теплообменные аппараты, их классификация и виды теплообменных поверхностей
- •10.3. Эффективность теплообменников
- •10.4. Теплоизоляция криогенных систем
- •Библиографический список
- •Оглавление
- •Научные основы криологии
- •650056, Г. Кемерово, б-р Строителей, 47
- •650010, Г. Кемерово, ул. Красноармейская, 52
5.5. Разделение газовых смесей
Затраты работы при разделении газовой смеси на составные части зависят от применяемого способа. Однако и в этом случае существует минимальный теоретический предел затрат работы.
Состав разделяемой смеси обычно выражают через объемные, массовые или мольные доли.
Молярная доля компонента 1 в смеси определяется по формуле:
![]() ,
(41)
,
(41)
где М1,…Мn - количество молей компонентов в смеси.
Молярные доли компонентов в смеси связаны равенством:
x1 + x2 + …+ xn = 1. (42)
Рассмотрим процесс разделения идеальной газовой смеси. Примем бинарную смесь, состоящую из компонентов 1 и 2.
|
|
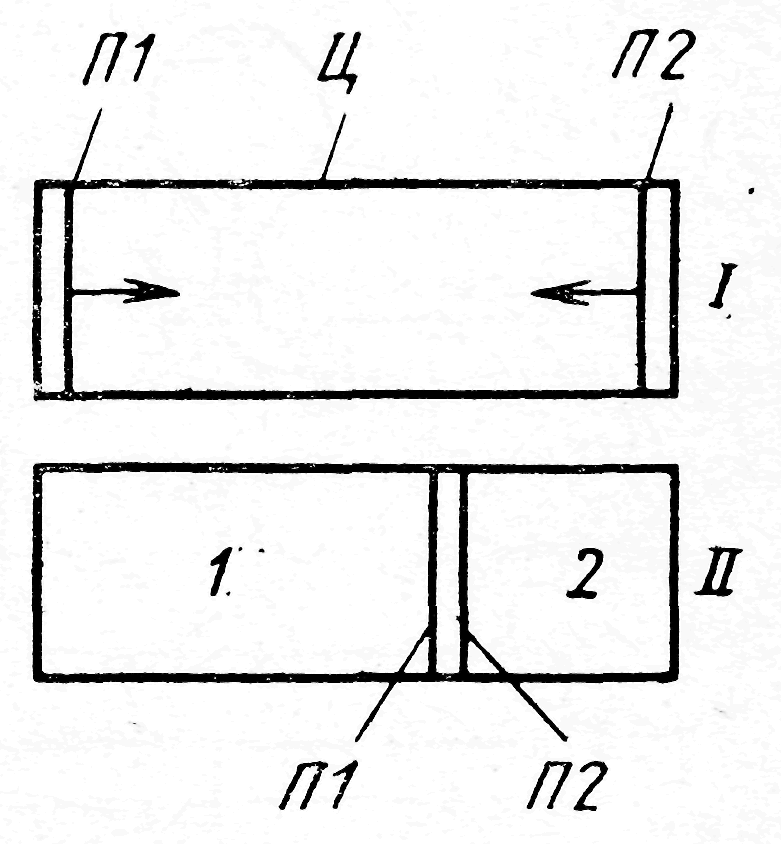
Пусть в цилиндре Ц (рис. 18) (положение I) при давлении p0 и температуре Т0 содержится смесь в количестве М, включающая компонент 1 в количестве М1=x1∙М и компонент 2 количестве М2=x2∙М (рис. 18). Парциальные давления этих газов в смеси можно определить по закону Дальтона:
p1= х1 р0 и p2= х2 р0 = (1-х1)р0.
В цилиндре расположены два полупроницаемых поршня, перемещающихся без трения, причем П1 проницаем для газа 1, а П2 - для газа 2. Медленно перемещая поршни таким образом, чтобы давление и температура во всех частях системы не изменялись, достигнем положения II. Когда оба поршня сойдутся, тогда в |
|
Рис. 18. Схема процесса разделения в цилиндре с полупроницаемыми поршнями |
левой части цилиндра соберется чистый компонент 1, давление которого будет р0, а в правой - чистый компонент 2, давление которого также будет р0. Таким образом, если процесс изотермичен, то затраты работы равны сумме работ изотермического сжатия составляющих газовых смесей от их парциальных давлений до общего давления р0.
Если М = 1 моль, то
![]() . (43)
. (43)
Согласно
закону Дальтона
![]() ,
тогда
,
тогда
![]() . (44)
. (44)
В качестве примера вычислим минимальную работу разделения воздуха на азот и кислород.
Ry=8,314 Дж/(Моль К); xкислород=0,209; xазот =0,791; Т=303.
![]() =
-8,314∙303 (0,209 ln0,209+0,791
ln0,731)=1291
Дж/моль.
=
-8,314∙303 (0,209 ln0,209+0,791
ln0,731)=1291
Дж/моль.
Реальные затраты работы существенно больше. Степень термодинамического совершенства установки разделения газовой смеси определяются по формуле:
![]() ,
(45)
,
(45)
где l - суммарные затраты работы.
В воздухоразделительных установках часто приходится совмещать процессы разделения смесей и ожижения одного из получаемых продуктов. При определении минимальной работы для получения сжиженного кислорода и газообразного азота из воздуха процесс можно представить в виде двух последовательных процессов: разделение воздуха на газообразный азот и кислород и ожижение кислорода, тогда минимальная работа, отнесенная к одному молю определяется следующим образом:
![]() , (46)
, (46)
где lожmin - минимальная работа ожижения воздуха.
При разделении воздуха (при р0 = 0,1 МПа) на азот и кислород и получении из него жидких кислорода или азота для определения минимальной работы lтiп можно использовать данные, приведенные в табл. 2.
Таблица 2
Минимальная работа, кДж/моль, получения 1-го моля жидких кислорода
и азота из воздуха при полном его разделении на чистые О2 и N2
(начальная температура То = 303 К, воздух принят за бинарную смесь О2 - N2)
|
Продукт |
( lp min)i (разделение воздуха) Дж/моль |
lожmin (ожижение продукта) Дж/моль |
lmin* (получение жидкого продукта из воздуха) |
|
Кислород |
6,18 |
20,74 |
26,92 |
|
Азот |
1,63 |
22,12 |
23,75 |