
Коллоквиум1
.pdf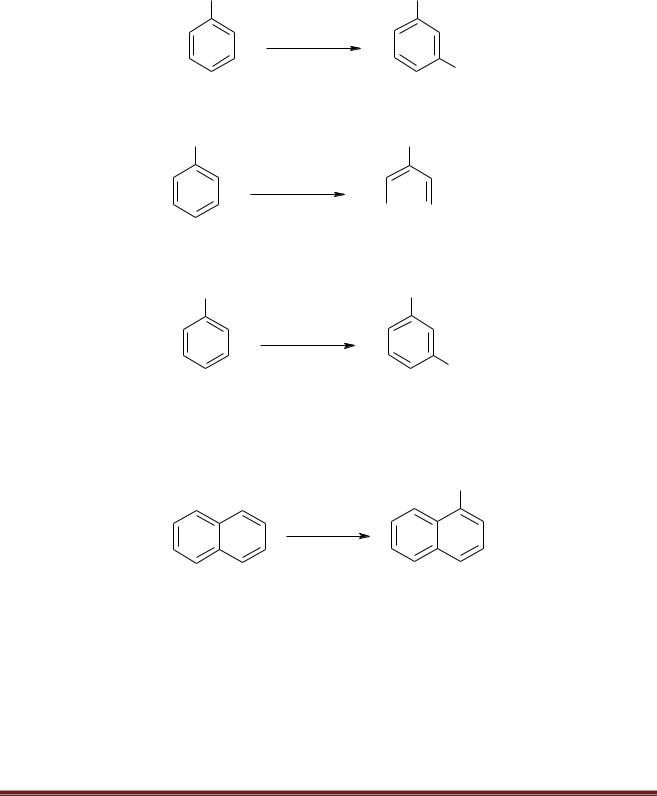
Кроме того, фенол можно обнаружить, добавляя FeCl3: при этом развивается тѐмнофиолетовое окрашивание.
NB! Электрофилы атакуют орто и пара-положения толуола, анилина и фенола. Реакции идут в более мягких условиях, чем с бензолом.
COOH |
COOH |
Br2 FeBr3
- HBr
Br
м-бромбензойная кислота
COOH |
COOH |
H2SO4
-H2O 
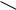 SO3H
SO3H
м-сульфобензойная кислота
COOH |
COOH |
CH3Br FeBr3
- HBr
CH3
м-метилбензойная кислота
NB! Электрофилы атакуют мета-положение молекулы бензойной кислоты. Реакция идѐт в более жѐстких условиях, чем с бензолом.
Cl
Cl2, AlCl3
-HCl
Нафталин |
1-хлорнафталин ( -нафталин) |
http://norgchem.professorjournal.ru |
Нижник Я.П. |
Страница 51 |
80oC H2SO4 160oC
SO3H

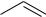
 SO3H
SO3H
1-нафталинсульфокислота |
2-нафталинсульфокислота |
||||
( -нафталинсульфокислота) |
( -нафталинсульфокислота) |
||||
|
CH3Cl, AlCl3 |
|
|
CH3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
-HCl |
|
|
|
|
|
|
|
|
|
|
1-метилнафталин ( -метилнафталин)
|
Br2 |
|
|
|
|
|
|
|
|
|
|
|
N |
- HBr |
|
N |
Br |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
H |
|
|
H |
|
|
|
|
|
|
|
|
|
|
|
2-бромпиррол |
|
( -бромпиррол) |
|
|
|
|
||||
|
Br2 |
|
|
|
|
Br2 |
|
|
|
|
|
|
O |
- HBr |
|
O |
Br |
|
- HBr |
|
Br |
O |
Br |
|
|
|
|
|
|
|
|
|
|
|||||
|
|
2-бромпиррол |
|
|
|
2,5-дибромпиррол |
|
|
||||
|
|
|
|
|
|
|
|
|
|
Cl |
|
Cl |
|
Cl2 |
|
|
|
Cl2 |
|
|
|
|
|
|
|
S |
- HCl |
S |
Cl |
- |
HCl |
|
Cl |
S |
Cl |
Cl |
S |
Cl |
|
|
|
|
|
|
|||||||
|
|
2-хлорпиррол |
|
|
2,5-дихлорпиррол |
|
2,3,4,5-тетрахлорпиррол |
|||||
http://norgchem.professorjournal.ru |
Нижник Я.П. |
Страница 52 |
|
H2SO4 |
|
|
S |
- H O |
S |
SO3H |
|
|||
|
2 |
|
|
|
|
2-тиофенсульфокислота |
|
|
H2SO4 |
|
|
O |
- H O |
O |
SO3H |
|
|||
|
2 |
|
|
|
|
2-фурансульфокислота |
|
|
N |
|
|
|
SO3 |
|
SO3H |
N |
|
N |
|
- |
|
||
|
H |
|
|
H |
N |
|
|
2-пирролсульфокислота
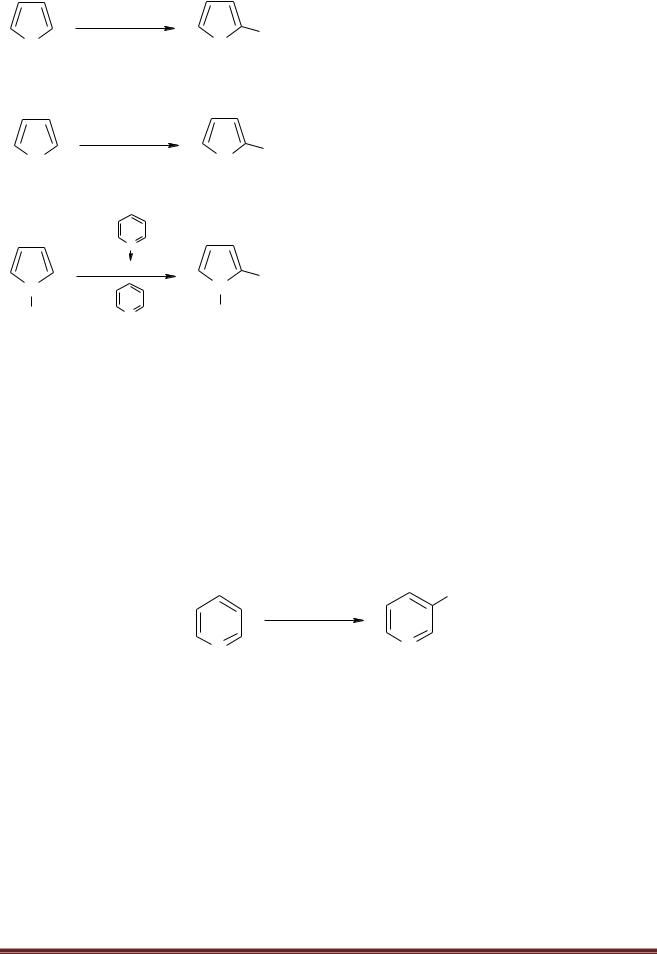
NB! электрофилы атакуют положение 2 пятичленных гетероциклов: пиррола, фурана и тиофена, реакции идут в мягких условиях.
Пиррол нельзя сульфировать серной кислотой, поскольку пиррол ацидофобен («кислотобоязлив») — быстро разрушается в кислой среде с образованием смолы. Поэтому для сульфирования пиррола используют комплекс пиридина с серным ангидридом.
NB! электрофилы атакуют положение 3 шестичленного гетероцикла пиридина, реакции идут в жѐстких условиях.
Br
Br2
N |
- HBr |
N |
|
Как определить ориентирующее действие заместителя?
При наличии одного заместителя введение второго заместителя осуществляется либо в орто/пара, либо в мета положения.
В зависимости от характера заместителя реакция протекает либо быстрее чем с бензолом, либо наоборот — медленнее. В первом случае заместитель активирует, во втором дезактивирует ароматическую систему.
По ориентирующему и активирующему/дезактивирующему действию заместители можно разделить на 3 группы
http://norgchem.professorjournal.ru |
Нижник Я.П. |
Страница 53 |

Заместители первого рода: направляют электрофильное замещение в орто и пара-положения и активируют реакцию — она протекает быстрее, чем с незамещѐнным бензолом.
Эти заместители являются электронодонорами (алкильные группы, OH, NH2, CH3O, пиррольный атом азота)
Заместители второго рода: направляют электрофильное замещение в мета- положения и дезактивируют реакцию — она протекает медленнее, чем с незамещѐнным бензолом.
Эти заместители являются электроноакцепторами (COOH, CHO, CONH2, SO3H, NO2, пиридиновый атом азота)
Галогены. Направляют электрофильное замещение в орто и пара-положения и дезактивируют реакцию (F, Cl, Br, I).
10.Дайте определение понятиям кислотность и основность по БрѐнстедуЛоури.
Теория |
Основание |
Кислота |
|
|
|
Аррениус |
Вещество, |
Вещество, |
|
диссоциирующее в воде с |
диссоциирующее в воде с |
|
образованием гидроксид- |
образованием протонов |
|
ионов |
|
|
|
(H2SO4, HNO3, CH3COOH) |
|
(NaOH, KOH) |
|
|
|
|
Брѐнстед-Лоури |
Акцептор протона |
Донор протона |
|
(NH3, H2O, амины, анионы |
(HCl, CH3COOH, H2O и др.) |
|
и др.) |
|
|
|
|
Льюис |
Донор электронов |
Акцептор электронов |
|
(NH3, H2O, амины, анионы, |
(H+, AlCl3, BF3, бензохинон |
|
алкены, бензол и др.) |
и др.) |
|
|
|
Кислоты Брѐнстеда-Лоури— это молекулы или ионы, способные отдавать протон.
Основания Брѐнстеда-Лоури — это молекулы или ионы, способные принимать протон.
Кислота, отдавая протон, превращается в основание, а основание, принимая протон, превращается в кислоту.
Диада Инь-Янь хорошо иллюстрирует взаимосвязь кислоты и основания.
http://norgchem.professorjournal.ru |
Нижник Я.П. |
Страница 54 |

|
|
- |
+ H O+ |
|
CH COOH + H O |
|
CH COO |
||
|
||||
3 |
2 |
3 |
3 |
|
кислота |
основание |
|
сопряжѐнное |
сопряжѐнная |
|
|
|
основание |
кислота |
Какие факторы влияют на кислотность?
Чем лучше делокализован отрицательный заряд в сопряжѐнном основании, тем сильнее кислота. Факторы, приводящие к делокализации отрицательного заряда и поляризации связи A-H приводят к увеличению силы кислоты.
1.Чем больше электроотрицательность атома, с которым связан протон, тем больше кислотность. Зависимость действует для кислотных центров – атомов
одного периода.
Электроотрицательность : C < N < O < F Кислотность: CH4 < NH3 < H2O < HF
.
2.Чем больше поляризуемость атома кислотного центра, тем больше кислотность. Зависимость хорошо работает для водородных соединений элементов одной группы таблицы Менделеева.
Поляризуемость — способность частицы поляризоваться под действием внешнего электрического поля. Чем больше электронов в атоме и чем дальше
они от ядра, тем больше поляризуемость.
Например, кислотность в ряду галогеноводородных кислот увеличивается в следующей последовательности:
HF < HCl < HBr < HI
(а порядок ЭО противоположный! Обратите внимание, что это водородные соединения элементов одной группы – седьмой группы, главной подгруппы)
Такой же порядок в случае воды и сероводорода: H2O < H2S (сера и кислорода также элементы одной группы)
3.Электроноакцепторные заместители увеличивают кислотность,
электронодонорные уменьшают.
ЭА увеличивают делокализацию отрицательного заряда в сопряжѐнном основании, увеличивают его стабильность и, следовательно, увеличивают силу кислоты.
Вопрос: какое соединение сильнее как кислота – этанол или этилмеркаптан
Ответ: метилмеркаптан (см. пункт 2)
Вопрос: какое соединение сильнее как кислота — уксусная кислота или
хлоруксусная
Ответ: хлоруксусная (см. пункт 3, хлор — ЭА)
http://norgchem.professorjournal.ru Нижник Я.П. Страница 55

Вопрос: какое соединение сильнее как кислота – фенол или п-нитрофенол?
Ответ: п-нитрофенол (см. пункт 3, нитрогруппа — ЭА)
Сравните кислотные свойства соединений в группах:
Фенол и п-аминофенол:
|
OH |
OH |
|
|
|
|
|
|
|
|
|
NH2
Аминогруппа является ЭД. Следовательно, фенол является более сильной кислотой (см. пункт 3).
Фенол и п-оксифенол:
|
OH |
OH |
|
|
|
|
|
|
|
|
|
OH
Гидроксигруппа является ЭД. Следовательно, фенол является более сильной кислотой (см. пункт 3).
н-пропиловый спирт, 2-хлорпропанол-1, 2-метилпропанол-1:
H3C |
|
CH |
|
CH2 |
OH H3C |
|
|
CH |
|
CH2 |
OH |
H3C |
|
|
CH |
|
CH2 |
OH |
|
2 |
|
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
Cl |
|
|
CH3 |
||||||||
Cl — ЭА, CH3 – ЭД.
Следовательно, 2-хлорпропанол-1 — самая сильная кислота в списке, 2- метилпропанол-1 — самая слабая (см. пункт 3).
Этиловый спирт, этилмеркаптан, уксусная кислота:
|
|
|
|
|
|
|
|
|
O |
CH |
|
CH2 |
OH |
CH |
|
CH2 |
SH |
CH3 |
C |
3 |
3 |
||||||||
|
|
|
|
|
|
|
|
|
OH |
Поляризуемость серы больше, следовательно, этилмеркаптан является более сильной кислотой, чем этиловый спирт (см. пункт 2). Уксусная кислота в карбоксильной группе содержит карбонильную группу — очень сильный ЭА (-М, -I), следовательно, она будет самой сильной кислотой из списка (см. пункт 3).
http://norgchem.professorjournal.ru |
Нижник Я.П. |
Страница 56 |

н-пропиловый спирт, глицерин:
H3C CH2 CH2 OH H2C CH CH2 OH OH OH
Гидроксигруппы в данном случае являются ЭА (-I эффект), следовательно, кислотность глицерина больше, чем н-пропилового спирта.
Более сильные кислотные свойства многоатомных спиртов проявляются в реакции с гидроксидом меди (II): при добавлении глицерина Cu(OH)2 растворяется с образованием хелатного комплекса
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2- |
H2C |
|
OH |
|
|
|
H2C |
|
|
|
O |
O |
|
|
|
|
|
|
CH2 |
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
|
|
|
Cu |
|
|||||||||||||||||||
2 HC |
|
OH |
+ Cu(OH) + |
2 NaOH |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
+ 4H O |
||||
|
+ |
|
HC |
|
|
|
O |
O |
|
|
|
|
CH |
||||||||||
|
|
|
|
|
|
|
|
||||||||||||||||
|
|
|
|
2 |
|
2 Na |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
H2C |
|
OH |
|
|
|
H2C |
|
OH |
HO |
|
|
|
CH2 |
|
|||||||||
|
|
|
|
|
|
|
|
|
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Факторы, влияющие на основность.
Факторы, увеличивающие основность, противоположны факторам увеличивающим кислотность.
Чем меньше делокализована неподелѐнная электронная пара (НЭП) на основном центре и больше отрицательный заряд, тем сильнее основание.
1)Чем больше электроотрицательность атома основного центра, тем сильнее удерживается НЭП, тем меньше основность. Зависимость действует для оснόвных центров – атомов одного периода.
Электроотрицательность : N < O < F основность: NH3 > H2O > HF,
Поэтмоу аммониевые основания сильнее, чем оксониевые.
2)Чем больше поляризуемость атома основного центра, тем меньше основность.
Порядок основности: H2O > H2S , поэтому оксониевые основания сильнее,
чем сульфониевые.
3)Электронодонорные заместители увеличивают основность,
электроноакцепторные уменьшают.
Вопрос: выберите наиболее сильное основание из списка:
Метиламин, метанол.
CH3 |
NH2 |
CH3 |
OH |
Ответ: Метиламин (см. пункт 1)
Вопрос: выберите наиболее сильное основание из списка:
Метиламин, диметиламин.
http://norgchem.professorjournal.ru |
Нижник Я.П. |
Страница 57 |
CH3 |
NH2 |
CH |
|
N |
|
CH3 |
|
3 |
|
||||||
|
|
|
|||||
|
|
|
|
H |
|
|
|
Ответ: диметиламин, т.к. метил является ЭД (см. пункт 3)
Сравните основность соединений в группах:
Диэтиловый эфир, диэтилсульфид, диэтиланилин.
C2H5 N C2H5
CH |
|
CH2 |
O |
|
CH |
|
CH3 |
CH |
|
CH2 |
S |
|
CH |
|
CH3 |
3 |
|
2 |
3 |
|
2 |
Диэтиловый эфир – более сильное основание чем, диэтилсульфид (см. пункт 2), диэтиланилин – более сильное основание, чем диэтиловый эфир (см. пункт 1) Следовательно: порядок изменения основности:
диэтилсульфид < диэтиловый эфир < диэтиланилин
для наиболее сильного основания написать реакцию образования
солянокислой соли. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
H |
|
|||||||||||||
|
|
|
|
|
C2H5 |
N C2H5 |
C2H5 |
N+ |
C2H5 |
|
||||||||||||||||||||||
|
|
|
||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
+ HCl |
|
|
|
|
|
|
|
|
|
|
|
Cl |
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Хлорид диэтиланилиния |
|||||||||||||||||
Сравните основность соединений: |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||
|
|
|
|
|
|
CH2 |
|
|
|
CH |
|
NH2 |
N |
|
|
|
|
|
|
|
|
|
C |
|
|
|
N |
C2H5 |
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
C2H5 |
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
CH3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
O |
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||
фенамин |
|
|
|
|
|
|
|
|
|
|
|
кордиамин |
|
|||||||||||||||||||
Вфенамине аминогруппа (основный центр) связана с алкильным радикалом (ЭД)
Вкордиамине атом азота амидной группы проявляет ОЧЕНЬ слабые основные
свойства, т.к. связан с карбонильной группой, которая является сильным ЭА. Пиридиновый атом азота в кордиамине находится в состоянии sp2-гибридизации (т.е. его ЭО увеличена, основность понижена).
Следовательно, фенамин — более сильное основание, чем кордиамин.
http://norgchem.professorjournal.ru |
Нижник Я.П. |
Страница 58 |

Приведите формулу сернокислой соли фенамина.
|
|
|
|
|
|
|
|
|
|
|
+ |
|
|
SO 2- |
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
2 |
|
|
|
|
|
|
|
CH |
|
|
CH |
|
NH |
|
|
||
|
|
|
2 |
|
3 |
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
4 |
|||||
|
|
|
|
|
|
|
|
|
|
|
CH3 |
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Сравните основность соединений:
HO |
|
|
|
|
|
|
|
|
CH |
|
CH2 |
NH2 |
HO |
|
|
|
|
|
|
|
|
CH |
|
CH2 |
NH |
|
CH3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
OH |
|
|
|
|
|
|
|
|
OH |
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||
|
HO |
|
HO |
||||||||||||||||||||||||
|
|
норадреналин |
|
|
|
|
|
|
|
адреналин |
|||||||||||||||||
Адреналин отличается от норадреналина наличием одной метильной группы. Метил является ЭД, следовательно, адреналин является более сильным основанием.
Для наиболее сильного основания напишите реакцию получения солянокислой соли.
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
+ |
|
|
|
Cl |
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
HO |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
HO |
|
|
|
|
|
|
|
CH |
|
CH |
|
|
NH |
|
|
CH |
|
+ HCl |
|
|
|
|
|
|
|
|
|
|
|
CH |
|
|
CH2 |
NH2 |
CH3 |
||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
2 |
|
|
3 |
||||||||||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
OH |
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
OH |
|
|
|
|
|
|
|
|
|
|
|
|
|
HO |
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||
|
HO |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||
|
|
Сравните основность соединений: |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||
|
|
|
|
|
|
|
H2N |
|
|
|
|
|
|
|
|
|
|
|
COOC2H5 |
|
|
|
|
|
|
|
|
|
|
|
|
CH |
|
|
|
|
CH |
|
NH |
|
CH3 |
|
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
OH |
|
|
|
CH3 |
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
анестезин |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
эфедрин |
|
|
|
||||||||||||||||||||||||
аминогруппа в анестезине является ЭД (-I < +M), следовательно, она связана с ЭА заместителем (бензольное кольцо).
Аминогруппа в эфедрине связана с двумя алкильными заместителями (ЭД). Следовательно, эфедрин является более сильным основанием, чем анестезин.
По какому атому прошло протонирование и почему?
http://norgchem.professorjournal.ru |
Нижник Я.П. |
Страница 59 |

|
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
C2H5 |
|
|
||||
2 |
|
|
|
|
|
3 |
.HCl |
|||||||||||||||
H2N |
|
|
|
|
|
|
|
C |
|
NH |
|
CH |
|
CH |
|
N |
|
|
||||
|
|
|
|
|
|
|
|
|
||||||||||||||
|
|
|
|
|
|
|
|
2 |
2 |
C2H5 |
||||||||||||
|
|
|
|
|
|
|
|
|
||||||||||||||
|
|
|
|
|
|
|
|
|
O |
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
новокаинамид
1.Атом азота №1 связан с ЭА заместителем.
2.Атом азота №2 связан с ЭД заместителем и мощным ЭА заместителем (C=O).
3.Атом азота №3 связан с 3-я ЭД заместителями.
Следовательно, протон присоединѐн к атому азота №3.
Объясните амфотерный характер спиртов и связанное с ним явление межмолекулярной ассоциации. Как это явление влияет на температуру кипения и растворимость спиртов?
1.Спирты имеют протонизированный атом водорода, который может отрываться основаниями с образованием алкоксид-ионов.
2.Спирты, как и кислоты, взаимодействуют с металлами (очень активными) с выделением водорода:
2 C2H5OH + 2 Na |
2 C2H5ONa + H2 |
3. Атом кислорода гидроксигруппы обладает двумя НЭП, и, следовательно, может быть акцептором протона, т.е. основанием.
Таким образом, спирты являются амфотерными соединениями и для них, как и для воды, характерно явление автопротолиза.
Молекула спирты могут образовывать водородные связи, как донор, так и акцептор, в том числе и с другими молекулами спирта. В результате, в чистом спирте наблюдается межмолекулярная ассоциация молекул спирта:
O |
|
H |
O |
|
H |
O |
|
H |
O |
|
H |
||||
|
|||||||||||||||
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
CH2 |
|
CH2 |
|
CH2 |
|
CH2 |
||||||||
CH3 |
CH3 |
CH3 |
CH3 |
||||||||||||
Такой ассоциации не наблюдается в простых эфирах, т.к. эфиры могут быть лишь акцепторами протона, но не донорами.
В результате температура кипения спиртов значительно больше, чем у изомерных им простых эфиров. Например: температура кипения этанола +78 oС, а изомерного ему диметилового эфира -24 oС.
http://norgchem.professorjournal.ru |
Нижник Я.П. |
Страница 60 |
