
Вариант № 63.
Задача №1. До какого давления нужно сжать адиабатически смесь воздуха и паров бензина от давления Р1 = 1 бар и температуры t1 = 150C, чтобы от повышения температуры наступило самовоспламенение? Температура воспламенения приблизительно t2 = 5600C, k = 1,39. Дать схему процесса в P-v– координатах.
Решение:
Соотношение параметров для адиабатного процесса:
T2/T1 = (P2/P1)(k-1)/k,
Тогда:
Р2(k-1)/k = P1(k-1)/k·Т2/Т1,
Р2(1,39-1)/1,39 = (0,1·106)(1,39-1)/1,39· (560+273)/(15+273),
Р20,281 = 73,49→ Р2 = 3,35·106 Па.
Для того, чтобы произошло самовоспламенение, смесь воздуха и паров бензина необходимо сжать адиабатно до давления 3,35 МПа.
И
 зображение
процесса сжатия вP-v–
координатах.
зображение
процесса сжатия вP-v–
координатах.








Задача №2. В цилиндре с поршнем заключено 2 кг этилена (С2Н4). При давлении Р = 3,5 бар и температуре t1 = 400C газ подогревается до температуры t2 = 3000C. Определить количество тепла, истраченного при изобарном процессе и величину полученной работы.
Решение:
Определяем газовую постоянную.
RC2H4 = R /μC2H4 = 8314/28 = 297 Дж/(кг·К),
где R = 8314 Дж/(кг·К) – универсальная газовая постоянная;
μC2H4 = 28кг/кмоль – мольная масса C2H4.
Определяем начальный объём газа.
Используем уравнение состояния:
P1·V1 = M·RC2H4 ·T1
V1 = M· RC2H4·T1/P1 =2·297· (273+40)/(0,35·106) = 0,53 м3.
Определяем конечный объём газа.
Из соотношения для изобарного процесса:
V1/ V2 = Т1/Т2 : V2 = V1·Т2/Т1 = 0,53· (300+273)/(40+273) = 0,97 м3.
Работа процесса.
L = M·P· (V2 – V1) = 2·0,35·106· (0,97 – 0,53) = 308·103 Дж.
Количество тепла, истраченного при изобарном процессе.
Q = M·Cpm· (T2 – T1),
где Cpm = μCp/μС2Н4 = 37,68/28 = 1,35 кДж/(кг·К) – массовая изобарная теплоёмкость этилена [1];
μCp = 37,68 кДж/(кмоль·К) – мольная изобарная теплоёмкость трёх- и многоатомных газов [1].
Q = 2 ·1,35·103· (573 – 313) = 702·103 Дж.
Задача №3. Компрессор сжимает воздух от давления Р1 = 1 бар до давления Р2 = 5бар по политропе с показателем n = 1,32. Объёмный коэффициент ηv = 0,87.
Как изменится объёмный коэффициент, если у такой же модели компрессора сжатие будет происходить от давления Р1 = 1 бар до давления
Р3 = 9 бар?
Решение:
Объёмный коэффициент:
ηv = 1 – α· [(P2/P1)1/n-1],
где α – коэффициент вредного пространства.
α = (1- ηv) / [(P2/P1)1/n-1] = (1- 0,87) / [(5/1)1/1,32-1] =0,055.
Объёмный коэффициент при изменении конечного давления:
ηv* = 1 – α· [(P2/P1)1/n-1] = 1 – 0,055· [(9/1)1/1,32-1] = 0,71.
Следовательно, с увеличением конечного давления объёмный коэффициент компрессора уменьшается.
Задача №4. Рассчитать основной цикл двигателя внутреннего сгорания – ДВС с подводом тепла при постоянном давлении. Определить параметры (Р, v, T) характерных точек цикла. Для всех процессов цикла рассчитать количество тепла, работу, изменение внутренней энергии, энтальпии, энтропии рабочего тела. Определить термический КПД. Расчёт произвести для 1 кг рабочего тела, которое обладает свойствами воздуха.
Начальное состояние воздуха: Р1 = 1 бар; Т1 = 330К. Степень повышения давления β = Р2/Р1 = 4,5; степень предварительного расширения
ρ = v3/v2 = 1,5. Теплоёмкость воздуха принять постоянной, как для двухатомного газа. Результаты расчёта представить в таблице.
Изобразить цикл в Pv и TS –диаграммах.
Решение:
Цикл ДВС с изобарным подводом теплоты.
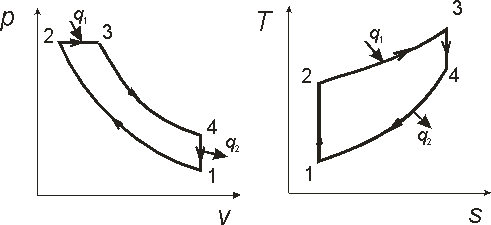
1-2 – адиабатное сжатие, 2-3 – изобарный подвод теплоты,
3-4 – адиабатное расширение, 4-1 – изохорный отвод теплоты.
Определяем параметры в характерных точках цикла.
Точка 1.
Р1 = 1·105 Па, Т1= 330К.
Удельный объём определяем из уравнения состояния
V1 = R·T1/ Р1 = 287·330/(1·105)= 0,93 м3/кг.
где R = 287 Дж/(кг·К) – газовая постоянная для воздуха [1].
Точка 2.
Степень повышения давления β = Р2/Р1 = 4,5 → Р2 = Р1· β = 1·105·4,5 = =4,5·105 Па.
Из уравнения адиабаты (линия 1-2)
Р2/Р1 = (v1/v2)к → v2к = Р1 · (v1)k /Р2 = 1·0,931,4/4,5 = 0,2; v2 = 0,32 м3/кг.
T2 = v2· Р2/R = 0,32·4,5·105/287 = 502K.
Точка 3.
Так как 2 – 3 – изобара, то Р3= Р2 = 4,5·105 Па.
Степень предварительного расширения ρ = v3/v2 = 1,5→ v3 = 1,5·v2
v3 = 1,5·0,32 = 0,48 м3/кг.
T3 = v3 Р3/R = 4,5·105·0,48/287 = 753 K.
Точка 4.
V4= V1 = 0,93 м3/кг.
Р4 = Р3 · (v3/v4)k = 4,5·105· (0,48/0,93)1,4 = 1,78·105 Па.
T4 = v4· Р4/R = 1,78·105·0,93/287 = 577 K.
Результаты расчётов сведём в таблицу.
Параметры в характерных точках цикла.
-
Точка
Т, К
Р, Па
V,м3/кг
1
330
1·105
0,93
2
502
4,5·105
0,32
3
753
4,5·105
0,48
4
577
1,78·105
0,93
Определение количества тепла, работы, изменения внутренней энергии, энтальпии, энтропии рабочего тела для всех процессов цикла.
Процесс 1-2.
Количество тепла:
Так как процесс адиабатный, то q12 = 0.
Работа:
l12 = (R /(k – 1)) · (T1 - T2) = (287 / (1,4 – 1)) · (330 - 502) = - 123410Дж/кг.
Изменение внутренней энергии:
Так как по первому закону термодинамики q = l + ∆u,
и q12 = 0, то ∆u12 = - l12 = 123410Дж/кг.
Изменение энтальпии:
∆h12 = Ср· (Т2 – Т1),
где Cр - удельная массовая изобарная теплоёмкость; для воздуха Cр = 1,01 кДж/(кг·К)[1].
∆h12 = 1,01·103· (502– 330) = 173720 Дж/кг.
Изменение энтропии:
При адиабатном процессе ∆s12 = 0.
Процесс 2-3.
Количество тепла:
q23 = Cр· (T3 – T2) = 1,01·103· (753 – 502) = 253510 Дж/кг .
Работа:
l23 = R· (T3 – T2) = 287· (753 – 502) = 72037 Дж/кг .
Изменение внутренней энергии:
Так как по первому закону термодинамики q = l + ∆u,
∆u23 = q23 - l23 = 253510 – 72037 = 181473 Дж/кг.
Изменение энтальпии:
∆h23 = q23 = 253510 Дж/кг.
Изменение энтропии:
∆s23 = Cp·ln(T3 /T2) = 1,01·103·ln(753/502) = 410 Дж/(кг·К).
Процесс 3-4.
Количество тепла:
Так как процесс адиабатный, то q34 = 0.
Работа:
l34 = (R/(k – 1)) · (T3 – T4) = (287 / (1,4 – 1)) · (753 - 577) = 126280 Дж/кг.
Изменение внутренней энергии:
Так как по первому закону термодинамики q = l + ∆u,
и q34 = 0, то ∆u34 = - l34 = - 126280 Дж/кг.
Изменение энтальпии:
∆h34 = Ср· (Т4 – Т3) = 1,01·103· (577 – 753) = - 177760 Дж/кг.
Изменение энтропии:
При адиабатном процессе ∆s34 = 0.
Процесс 4-1.
Количество тепла:
q41 = Cv· (T1 – T4) = 0,72·103· (330 – 577) = -177840Дж/кг .
где Cv – удельная массовая изохорная теплоёмкость; для воздуха Cv = 0,72 кДж/(кг·К)[1];
Работа:
Так как процесс изохорный, l41 = 0.
Изменение внутренней энергии:
Так как по первому закону термодинамики q = l + ∆u,
и l41 = 0, то ∆u41 = q41 = -177840 Дж/кг.
Изменение энтальпии:
∆h41 = q41 + v4 · (P1 – P4) = -177840 + 0,93· (1 – 1,78) ·105 = - 250380 Дж/кг.
Изменение энтропии:
∆s41 = Cv·ln(P1/P4) = 0,72·103·ln(1/1,78) = - 415 Дж/(кг·К).
Результаты расчётов сведём в таблицу.
Количество тепла, работы, изменение внутренней энергии, энтальпии, энтропии рабочего тела для всех процессов цикла.
|
Процесс |
q, кДж/кг |
l, кДж/кг |
∆u, кДж/кг |
∆s, кДж/(кг·К) |
∆h,кДж/кг |
|
1 - 2 |
0 |
-123,41 |
123,41 |
0 |
173,72 |
|
2 - 3 |
253,510 |
72,037 |
181,473 |
0,410 |
253,510 |
|
3 - 4 |
0 |
126,280 |
-126,280 |
0 |
-177,760 |
|
4– 1 |
-177,840 |
0 |
-177,840 |
- 0,415 |
- 250,380 |
Тепло, подведённое в цикле
q1 = q2-3 = 253510 Дж/кг .
Тепло, отведённое в цикле
q2 = q4-1 = 177840 Дж/кг.
Полезная работа цикла;
l0 = q1 – q2 = 253510 – 177840 = 75670 кДж/кг.
Термический КПД цикла:
ηt = l0 = q1 =75670/253510 = 0,30.
