
DZ_Khimikam_elektroliz
.docДЗ сдавать на третьей неделе после смены расписания
Электролиз растворов
Пример. Электролиз водного раствора хлорида олова с инертными электродами:
SnCl 2 = Sn 2+ + 2Cl —
( -)
Kатод
Sn
2 +, H2O
(+) Aнод
Cl
—,
H2O
-)
Kатод
Sn
2 +, H2O
(+) Aнод
Cl
—,
H2O
![]() =
-
0,136 B
;
=
-
0,136 B
;
![]() =
-1B.
=
-1B.
![]() =
1,36 В ;
=
1,36 В ;
![]() »
1,8 B.
»
1,8 B.
Так
как
![]() >
>
![]() ,
Так как
,
Так как
![]() <
<
![]() , идет
идет процесс
восстановления процесс
окисления ионов Сl
-:
, идет
идет процесс
восстановления процесс
окисления ионов Сl
-:
ионов олова: Sn2+ + 2 ē = S n 2Cl — - 2 ē = Cl 2
Количественные соотношения при электролизе определяют в соответствии с законами, открытыми М. Фарадеем (1834).
Обобщенный закон Фарадея связывает количество вещества, образовавшегося при электролизе, со временем электролиза и силой тока:
![]() ,
,
где m - масса образовавшегося вещества , г;
М - молярная масса вещества, г/ моль;
n - количество электронов, участвующих в электродном процессе;
I - сила тока, А;
- время электролиза, с;
F - константа Фарадея (96500 Кл/моль).
Для
газообразных веществ, выделяющихся при
электролизе, формулу использют в виде
![]() ,
,
где V- объем газа, выделяющегося на электроде; V 0 - объем 1 моль газообразного вещества при нормальных условиях (22,4 л/моль).
Пример. Рассчитать массу олова и объем хлора при нормальных условиях, выделившихся при электролизе раствора хлорида олова с инертными электродами в течение 1 часа при силе тока 4А.
Решение.
![]()
![]()
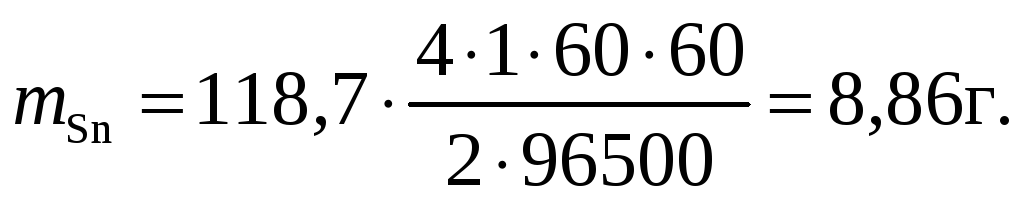
![]()
Задания
Рассмотрите катодные и анодные процессы при электролизе водных растворов веществ. Процессы на электродах обоснуйте значениями потенциалов. Составьте схемы электролиза с инертными электродами водных растворов предложенных соединений (отдельно два раствора) с инертными электродами либо растворимым анодом. Рассчитайте массу или объем (при нормальных условиях для газов) продуктов, выделяющихся на электродах при пропускании через раствор в течение 1 часа тока силой 1 А.
|
11. Al2(SO4)3; NaCl |
|
12. Cо(NO3)2; KI |
|
13. NiSO4; NaNO2 |
|
14. FeBr2; NaOН |
|
15. ZnCl2; CoBr2 |
|
16. NiSO4; MgCl2 |
|
17. BeSO4; Ba(NO2)2 |
|
18. Mg(NO3)2; Na2CO3 |
|
19. KOH; ZnSO4 |
|
20. CaI2; Cr2(SO4)3 |
