
- •Свойства
- •Введение
- •1 Общая характеристика растворов
- •2 Внутреннее строение растворов
- •3 Процесс растворения. Растворимость. Энергетика процесса растворения
- •4 Концентрации растворов
- •4.7 Расчеты, связанные с взаимным переходом одних форм выражения концентраций в другие
- •4.8 Расчеты, связанные со смешиванием растворов разных концентраций; из сухих солей и воды
- •Общие примеры решения задач при смешивании и разбавлении растворов
- •4.9 Расчеты по уравнениям реакций. Закон эквивалентов
- •5 Диффузия и осмос
- •6 Давление насыщенного пара растворов. Тонометрический закон рауля
- •7 Температура кипения
- •И кристаллизация растворов.
- •Эбулиоскопический и криоскопический
- •Законы рауля
- •8 Свойства растворов электролитов. Методы определения стеПени электролитической диссоциации
- •9 Рекомендации для самостоятельной работы, контрольные вопросы и требования к знаниям и умениям
- •9.1. Рекомендации
- •9.2. Вопросы для самоконтроля
- •9.3 Требования к знаниям и умениям
- •10 Задачи и упражнения
- •10.1 Растворимость. Энергетика процесса растворения
- •10.2 Процентная концентрация
- •10.3. Молярная и эквивалентная концентрация. (молярность, нормальность)
- •10.4. Моляльная концентрация (моляльность) , мольная доля, титр
- •10.5. Свойства растворов неэлектролитов, зависящие от концентрации частиц
- •10.5.1. Осмотическое давление разбавленных растворов неэлектролитов. Закон Вант-Гоффа
- •10.5.2. Давление насыщенного пара растворов. Тонометрический закон Рауля.
- •10.5.3. Температура кипения и кристаллизации растворов. Эбулиоскопический и криоскопический законы Рауля.
- •10.6 Свойства растворов электролитов. Методы определения степени электролитической диссоциации
- •11 Экспериментальная часть приготовление растворов заданной концентрации
- •Варианты расчетов
- •Библиографический список
- •Содержание
- •Свойства растворов электролитов и неэлектролитов
- •450062, Республика Башкортостан, г.Уфа, ул. Космонавтов,1
6 Давление насыщенного пара растворов. Тонометрический закон рауля
Пар, находящийся в равновесии с жидкостью, называется насыщенным. Каждой жидкости присуще определенное давление пара, которое увеличивается с повышением температуры. Жидкость закипает, когда давление ее пара достигает внешнего (атмосферного) давления.
Давление пара растворов ниже давления пара чистых растворителей при той же температуре. Понижение давления пара объясняется тем, что поверхность раствора частично занята сольватированными молекулами растворенного вещества, благодаря чему уменьшается концентрация самого растворителя, а следовательно, и интенсивность его испарения.
Пусть р0 - давление пара растворителя, а р -давление пара раствора, тогда р0 - р = ∆р покажет понижение давления пара. Отнеся эту разность к давлению пара чистого растворителя, получим так называемое понижение давления пара растворителя.
![]()
Согласно закону Рауля относительное понижение давления пара растворителя равно отношению числа молей растворенного вещества к общему числу молей в растворе (растворенного вещества и растворителя):
![]()
где n - число молей растворенного вещества;
N - число молей растворителя.
Отсюда 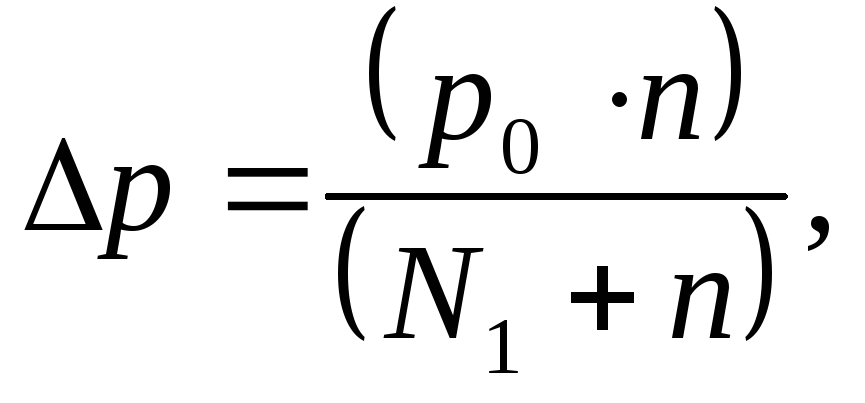
![]() -
мольная доля
растворенного вещества, если n
мало, т.е. концентрация мала, то можно
записать
-
мольная доля
растворенного вещества, если n
мало, т.е. концентрация мала, то можно
записать ![]()
Другими словами, понижение давления пара над раствором пропорционально мольной доле растворенного вещества Мд: ∆р=р0·Мд.
Пример 19. Вычислить давление пара раствора, содержащего 45 г глюкозы С6H12O6 в 720 г воды при 25 °С.
Давление пара воды при 25 °С составляет 3167 Па.
Решение: р = р0 - ∆р,
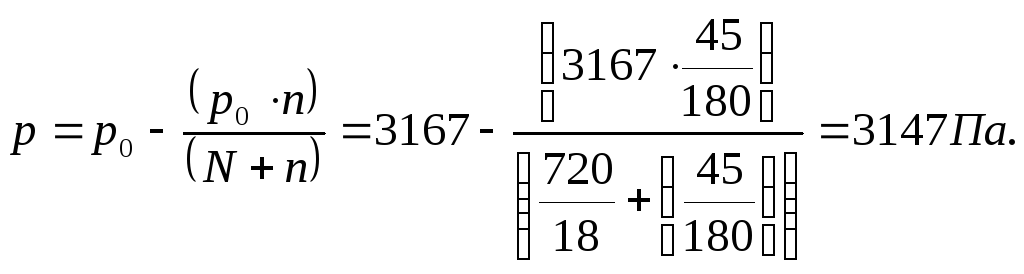
7 Температура кипения
И кристаллизация растворов.
Эбулиоскопический и криоскопический
Законы рауля
101 ,3кПа
∆t
кип
t кип.
Температура, ° С
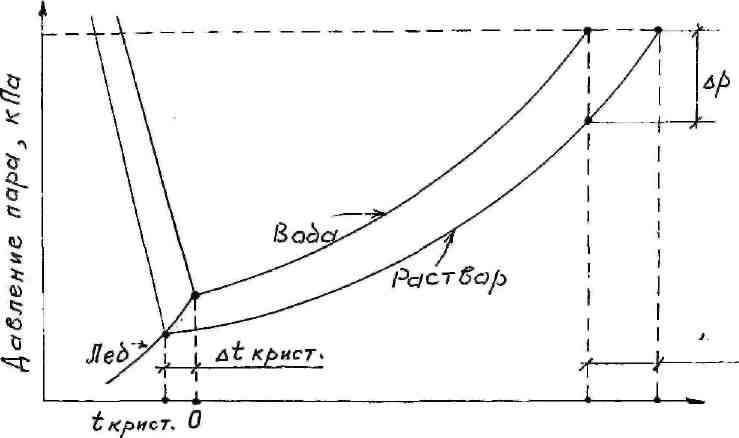
Рисунок 3-Диаграмма состояния воды и водного раствора нелетучего вещества
Разность между температурами кипения раствора и температурой кипения чистого растворителя называется повышением температуры кипения (∆t кип.).
Жидкость всегда кристаллизуется (затвердевает, застывает), когда давление ее пара становится равным давлению насыщенного пара соответствующей твердой фазы. При температуре кристаллизации чистого растворителя давление насыщенного пара растворителя над раствором не достигает давления пара кристаллов и из раствора чистый растворитель кристаллизуется при более низкой температуре. Разность между температурами кристаллизации чистого растворителя и раствора называется понижением температуры кристаллизации (замерзания) (∆t крист.)
Повышение температуры кипения и понижение температуры кристаллизации растворов зависят от концентрации растворов. Зависимость эта выражается вторым законом Рауля:
Повышение температуры кипения и понижение
температуры кристалиизации раствора пропорциональны
моляльной концентрации раствора.
∆t кип.= Е∙Сm;
∆t крист.= К∙Сm,
где Е - эбулиоскопическая константа - показывает повышение температуры кипения раствора при Сm= 1 моль/кг (таблица Б 2);
Ккр - криоскопическая константа – показывает понижение температуры кристаллизации при Сm= 1 моль/кг (таблица Б 3);
Сm- моляльная концентрация раствора.
Определив опытным путем ∆t кип. или ∆t крист. растворов, концентрации которых нам известны, можно вычислить молярные массы растворенных веществ.
Пример 20. Определить температуры кипения и замерзания раствора, содержащего 1 г нитробензола С6H5NO2 в 10 г бензола. Температура кипения чистого бензола равна 80,2 °С, а замерзания -5,4°С.
Решение: Исходя из закона Рауля,
∆t
кип. = Е∙Сm;
∆t
зам. = К∙Сm;
Сm=
![]()
где m1-масса растворенного вещества, г;
М - молярная масса растворенного вещества;
m2- масса растворителя, г;
Э и Ккр. по таблицам Б 2 и Б 3 в приложении.
M(С6H5NO2) = 123г,
∆t
кип.= ![]()
Температура кипения раствора
t кип.= t кип.бензола +∆t кип.= 80,2 + 2,1= 82,3ºС.
∆t
зам.= ![]()
Температура замерзания раствора
t зам. = t зам. бензола - ∆t зам. = 5,4 - 4,18 = 1,22 °С.
Пример 21. Определить молярную массу камфоры, если раствор
0,552 г камфоры в 17 г эфира кипит при температуре на 0,461 °С выше, чем чистый эфир (∆t кип. =0,461°С . Е эфира = 2,16 °С.)
Решение: Молярную массу эфира определяем пользуясь соотношением (см. пример 20)
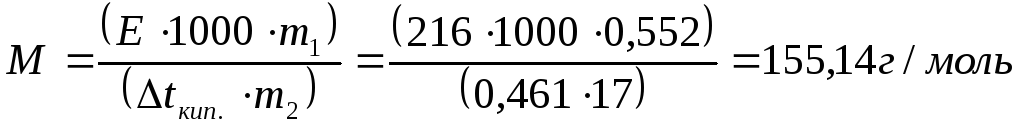
Молярная масса камфоры 155,14 г/моль.
