
Введениебиохимия
.docxМинистерство сельского хозяйства РФ
ФГБОУ ВПО «Санкт-Петербургская государственная академия ветеринарной медицины»
Кафедра биохимической и органической химии.
Реферат.
На тему: теории ферментативного катализа.
Выполнила: студентка 2 курса 9 группы ФВМ
Бабанова А.А.
Проверила: Бахта О.А.
Санкт-Петербург
2013.
Содержание.
Введение
Теория индуцированного соответствия
Теория ферментативного катализа
Теория Фишера (ключ-замок)
Список использованной литературы
Введение.
Катализ – это процесс ускорения реакции в присутствии катализатора. Катализатор может быть неорганической или органической природы. По современным представлениям о катализаторах их ускоряющее действие на скорость реакции связано с контактом катализатора и превращаемого вещества.
По типу различают:
-
Гомогенный катализ – реакция идёт в одной фазе и во всём объёме среды, при отсутствии поверхности раздела.
-
Гетерогенный катализ – при наличии поверхности раздела фаз, взаимодействие происходит только на её поверхности и носит многоэтапный характер.
Ферментативный катализ относится к микрогетерогенному катализу т.к. субстрат взаимодействует с его активным центром.
Все теории катализа сводятся к теории промежуточных соединений, за счёт чего реакция становится многоэтапной, происходит уменьшение энергии активации.
Существует несколько теорий ферментативного катализа теория Фишера, Кошланда, Михаэлиса-Менте.
.
Теория индуцированного соответствия.
Согласно теории индуцированного соответствия, выдвинутой Кошландом, в свободном ферменте (в отсутствие субстрата) каталитически активные группы Х и Х` расположены так, что они не могут одновременно взаимодействовать с субстратным фрагментом У:
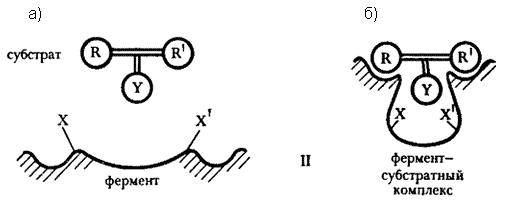
Рис. 6.1. Схематическое изображение конформационных изменений в ферменте, индуцированных субстратом.
Поскольку молекула фермента довольно гибкая, а субстрат имеет жесткую структуру, энергетически менее предпочтительная, но каталитически активная конформация активного центра образуется лишь в фермент-субстратном комплексе (схема б). На образование ее тратится часть свободной энергии сорбции.
Можно рассмотреть индуцированное соответствие на примере фосфорилирующего белка - гексокиназы - его субстрату. Этот белок переносит фосфатную группу с АТФ на глюкозу. Но эта же фосфатная группа может быть перенесена и на воду; однако этого не происходит. В попытке ответить на вопрос, Кошланд предположил следующее.
1) До связывания с субстратом фермент находится в "открытой" форме (в которой он может захватить субстрат из воды, но не способен провести его фосфорилирование).
2) После связывания с субстратом домены поворачиваются, щель закрывается, вода из нее вытесняется, а все компоненты каталитического центра сходятся вместе: фермент - переходит в "закрытую", каталитически-активную форму, но вода вытеснена из активного центра и потому не конкурирует с субстратом за фосфорилирование.
3) После каталитического акта фермент снова открывается, и фосфорилированный субстрат уходит.
Впоследствии опыт полностью подтвердил эту гипотезу, но только для тех белков, которым нужно скрыть обрабатываемый субстрат от конкурирующей с ним воды.
Индуцированное соответствие достигается смещением либо крупных блоков, либо целых белковых доменов, - а не полной перестройкой укладки белковой цепи. А смещения эти происходят в основном путем мелких локальных деформаций.
Теория ферментативного катализа
(теория Михаэлиса-Ментен)
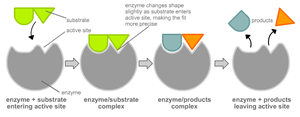
Существующие теории, объясняя взаимодействие фермента и субстрата, допускают временное их соединение с образованием промежуточного фермент-субстратного комплекса. Теория ферментативного катализа предполагает следующие этапы.
I этап. Между субстратом и ферментом возникает связь, в результате чего образуется фермент-субстратный комплекс ES, в котором компоненты связаны между собой ковалентной, ионной, водородной и другими связями.
II этап. Субстрат под влиянием присоединенного фермента активируется, становясь доступным для соответствующих реакций катализа ES.
III этап. Осуществляется катализ ES*.
IV этап. Освобождается молекула фермента E и продукты реакции Р.
I II III IV
E + S « ES « ES* « E + P
Теория ферментативного катализа подтверждена экспериментально. Так, из хрена выделен фермент, расщепляющий пероксид водорода - пероксидаза коричневого цвета. После соединения фермента E с субстратом H2O2 (S) возникает фермент-субстратный комплекс ES зеленого цвета. Через некоторое время субстрат активируется, образуя фермент-активированный субстрат ES* красного цвета. Он расщепляется на коричневый фермент E и продукты распада P.
Скорость реакции или скорость образования конечного продукта очевидно пропорциональна концентрации фермент-субстратного комплекса.
Также скорость реакции пропорциональна числу активных центров фермента, вовлекаемых молекулами субстрата.
В образовании фермент-субстратного комплекса участвуют водородные связи, гидрофобные и электростатические взаимодействия, временно образующие ковалентные связи.
Установлено, что при образовании фермент-субстратного комплекса молекулы фермента и субстрата, сближаясь, определенным образом ориентируются относительно друг друга. В присутствии субстрата происходят конформационные изменения молекулы фермента, что обеспечивает ориентацию в пространстве функциональных групп активного центра, оптимальным образом подходящую к взаимодействию с соответствующими группами субстрата. Эти конформационные взаимодействия получили название «индуцированного соответствия». Вероятно, оно увеличивает скорость ферментативных реакций, приводя к возникновению менее стабильных разрываемых связей в субстрате. Для химических ферментативных реакций важное значение имеет и электрофильно-нуклеофильный катализ. Активные центры ряда ферментов имеют электрофильные и нуклеофильные группировки, принимающие участие в химическом катализе. Электрофильные группировки - это акцепторы электронных пар, а нуклеофильны - это доноры электронных пар. В реакциях нуклеофильного замещения происходит образование ковалентных промежуточных соединений. При этом нуклеофильная группировка занимает место замещаемой группы, образуя ковалентный интермедиат, который неустойчив и легко распадается на конечные продукты реакции.
Теория Фишера (ключ-замок).
Существует определенное сродство фермента к определенному субстрату. В этом случае достигается максимальная фиксация субстрата на активных центрах фермента. Впервые это утверждение высказал в 1890г. Э. Фишер, который считал, что пространственные структуры активного центра фермента и его субстрата должны иметь стерическое соответствие, чтобы произошла химическая реакция. С этого времени возникла формулировка о соответствии фермента и субстрата, как ключа и замка. В настоящее время считают, что активные центры многих ферментов не представляют собой жесткие структуры. Форма их активного центра становится комплементарной лишь после связывания с субстратом.
Список литературы.
1. Кононский А.И. Биохимия животных. - Киев: Высшая школа. Главное изд-во, 1980..
2.Зайцев С.Ю.,Конопатов Ю.В.Биохимия животных. Фундаментальные и клинические аспекты. - Издательство «Лань».
3.Глинка Н.Л. Общая химия. Под ред. А.И. Ермакова. - изд.30-е, исправленное - М.: Интеграл-Пресс. 2004.
4.Болдырев А.И. Физическая и коллоидная химия. - 2-е изд., перераб. и доп. - М.: Высшая шк., 1983. .
5.Саверина Е.С. Биохимия – 3-е издание, исправленное. – Москва издательская группа ГЭОТАР- Медиа, 2006.
