
Обмен Белки
.docx-
Белки ф.:
1) каталитическая (ферментативная). Все ферменты, участвующие в любой реакции в организме, — белки (химотрипсин, рибонуклеаза, лизоцим);
2) транспортная(гемоглобин, сывороточный альбумин, трансферрин, белкт трансмембранного транспорта)
3) пищевая и запасная (резервная). Пример: яичный альбумин, казеин молока и глиадин пшеницы;(белки, предназначенные для питания развивающегося зародыша)
4) рецепторная. Пример: белки биомембран;
5) сократительная и двигательная. Пример: актин и миозин — белки мышечной ткани;
6) структурная. Пример: кератин волос, ногтей, коллаген (соединительная ткань), эластин (связки), фосфолипопротеины (белки биологических мембран), белки нуклеосом;
7) защитная. Пример: антитела сыворотки крови;( иммуноглобулины)
8) регуляторная. Пример: регуляция содержания глюкозы в крови инсулином;(белковые гормоны, белки, регулирующие действие генов, делковые ингибиторы и активаторы ферментов и др. белков)
9) когенетическая. Участие в хранении и передаче наследственной информации совместно с нуклеиновыми кислотами, сохранение онкотического давления в клетках крови, поддержание физиологического значения рH внутренней среды организма.
Азотистый баланс:
Аминокислоты (свободные и в составе белков) содержат почти 95% всего азота, поэтому именно они поддерживают азотистый баланс организма. Азотистый баланс - разница между количеством азота, поступающего с пищей, и количеством выделяемого азота (преимущественно в виде мочевины и аммонийных солей). Если количество поступающего азота равно количеству выделяемого, то наступает азотистое равновесие. Такое состояние бывает у здорового человека при нормальном питании. Азотистый баланс может быть положительным (азота поступает больше, чем выводится) у детей, а также у пациентов, выздоравливающих после тяжёлых болезней. Отрицательный азотистый баланс (выделение азота преобладает над его поступлением) наблюдают при старении, голодании и во время тяжёлых заболеваний.
Полноценные и неполноценные белки
Биологически полноценными называются те белки, в которых в достаточном количестве содержатся все аминокислоты, необходимые для синтеза белка животного организма. В состав полноценных белков, необходимых для роста организма, входят следующие незаменимые аминокислоты: лизин, триптофан, треонин, лейцин, изолейцин, гистидин, аргинин, валин, метионин, фенилаланин. Из этих аминокислот могут образоваться другие аминокислоты, гормоны и т. д. Из фенилаланина образуется тирозин, из тирозина путем превращений — гормоны тироксин и адреналин, из гистидина — гистамин. Метионин участвует в образовании гормонов щитовидной железы и необходим для образования холина, цистеина и глютатиона. Он необходим для окислительно-восстановительных процессов, азотистого обмена, усвоения жиров, нормальной деятельности головного мозга. Лизин участвует в кроветворении, способствует росту организма. Триптофан также необходим для роста, участвует в образовании серотонина, витамина РР, в тканевом синтезе. Лизин, цистин и валин возбуждают сердечную деятельность. Малое содержание цистина в пище задерживает рост волос, увеличивает содержание сахара в крови.
Биологические неполноценными называются те белки, в которых отсутствуют хотя бы даже одна аминокислота, которая не может быть синтезирована животными организмами.
Биологическая ценность белка измеряется количеством белка организма, которое образуется из 100 г белка пищи.
Белки животного происхождения, содержаться в мясе, яйцах и молоке, наиболее полоненные (70-95%). Белки растительного происхождения имеют меньшую биологическую ценность, например белки ржаного хлеба, кукурузы (60%), картофеля, дрожжей (67%).
Белок животного происхождения – желатина, в котором нет триптофана и тирозина, является неполноценным. В пшенице и ячмене мало лизина, в кукурузе мало лизина и триптофана.
Некоторые аминокислоты заменяют друг друга, например фенилаланин заменяет тирозин.
Два неполноценных белка, в которых недостает разлчных аминокислот, вместе могут составить полноценное белковое питание.
Заменимые аминокисолоты синтезируются в клетках в необходимых количествах( ала, асп, асн, глу, глн, про, гли, сер)
Аланин нормализует метаболизм углеводов. Является составной частью таких незаменимых нутриентов как пантотеновая кислота и коэнзим А.
Аргинин замедляет рост опухолей, в том числе раковых, за счет стимуляции иммунной системы организма, повышает активность вилочковой железы, которая вырабатывает T-лимфоциты. применяют при заболеваниях печени (цирроз и жировая дистрофия), он способствует дезинтоксикационным процессам в печени (прежде всего обезвреживанию аммиака)..
Аспарагиновая кислота в организме присутствует в составе белков и в свободном виде. Играет важную роль в обмене азотистых веществ.
Участвует в образовании пиримидиновых оснований мочевины.
Биологическое действие аспарагиновой кислоты: иммуномодулирующее, повышающее физическую выносливость, нормализующее баланс возбуждения и торможения в ЦНС.
Гистидин усиливает секрецию соляной кислоты и пепсина в желудке. Стимулирует образование гемоглобина и кроветворение в целом, способствует улучшению половой функции, так как гистамин (производное гистидина)
Глицин (аминоуксусная кислота) является центральным нейромедиатором тормозного типа действия, оказывает седативное действие, улучшает метаболические процессы в тканях мозга, ослабляет влечение к алкоголю, оказывает положительное влияние при мышечных дистрофиях, уменьшает повышенную раздражительность, нормализует сон.
Глутаминовая кислота (глутамин) обладает уникальным свойством присоединять дополнительный атом азота, тем самым, являясь организатором синтеза различных белков (перенос азота), либо связывая избыток азота (в том числе аммиак), который может вызывать нарушение работы различных органов, но, прежде всего мозга и печени.
Пролин участвует в синтезе коллагена, восстанавливает структуру соединительной ткани (в том числе опорно-двигательного аппарата, паренхиматозных органов, сердца).
Тирозин является предшественником нейромедиаторов норадреналина и дофамина. Тиреоидные гормоны образуются при присоединении к тирозину атомов йода. Эта аминокислота участвует в регуляции настроения; недостаток тирозина приводит к дефициту норадреналина, что, в свою очередь приводит к депрессии. Тирозин подавляет аппетит, способствует уменьшению отложения жиров, способствует выработке мелатонина и улучшает функции надпочечников, щитовидной железы и гипофиза.
Незаменимые аминок. Не могут синт. в орг.( вал,лей,иле,мет,фен,три,лиз,тре)
Лизин входит в состав практически любых белков, понижает уровень триглицеридов в сыворотке крови, оказывает противовирусное действие, особенно в отношении вирусов, вызывающих герпес и острые респираторные инфекции. Хорошо сочетается с витамином С и биофлавоноидами.
Метионин обеспечивает дезинтоксикационные процессы, прежде всего по связыванию тяжелых металлов, эндогенных и экзогенных токсинов, а также при токсикозе беременности, оказывает выраженное антиоксидантное действие, так как является хорошим источником серы, инактивирующей свободные радикалы. Помогает переработке жиров, предотвращая их отложение в печени и стенках артерий. Синтез таурина и цистеина зависит от количества метионина в организме.
Треонин поддерживает липотропную функцию печени совместно с метионином и аспартамом, играет важную роль в образовании коллагена и эластина, иммунитет, участвует в производстве антител.
Фенилаланин принимает активное участие в синтезе белков, повышает умственную активность, память, способствует улучшению секреторной функции поджелудочной железы и печени.
Триптофан необходим для производства витамина B3 (ниацина) и серотонина-важнейшего нейромедиатора, передающего нервные импульсы. Серотонин нормализует сон, стабилизирует настроение, снижает аппетит.Триптофан снижает содержание жиров, образующих холестерин в крови, также обладает гипотензивным свойством, расширяя кровеносные сосуды. Участвует в синтезе альбуминов и глобулинов, усиливает выделение гормона роста.
Валин необходим для восстановления поврежденных тканей и метаболических процессов в мышцах при тяжелых нагрузках и для поддержания нормального обмена азота в организме, оказывает стимулирующее действие.
Лейцин, действуя вместе с валином и изолейцином, защищают мышечные ткани и является источником энергии, также способствует восстановлению костей, кожи, мышц. Лейцин также несколько понижает уровень сахара в крови и стимулирует выделение гормона роста.
Изолейцин необходим для образования гемоглобина, стабилизирует уровень сахара в крови, восстанавливает мышечные ткани, ускоряет процесс выработки энергии.
Частично заменимые а.к.- синтезируются очнь медленно в кол-вах не покрывающих потребности орг-ма, особенно у детей(гис, арг)
Условно заменимые- синтезир-ся из незаменим. А.к.(цис, тир, из мет и фен соответственно)
Отсутствие в пище незамен. А.к. нарушает синтез практически всех белков. Белковое голодание приводит к необратимым нарушениям: циррозу печени, анемии, поражению почек, нарушению функции нервной системы.
Остаточный азот крови - это сумма всех азотсодержащих веществ в крови, после удаления из неё белков. Белки крови являются наибольшими азотсодержащими веществами. К веществам входящим в состав остаточного азота входят мочевина, аминокислоты, мочевая кислота, креатин, креатинин, аммиак, индикан, а также некоторые другие.
Нормальный уровень остаточного азота в крови: 14,3—28,6 ммоль/л
Повышение остаточного азота: острая почечная недостаточность, хроническая почечная недостаточность, кровотечение из верхних отделов пищеварительного тракта.ютяжелые бактериальные инфекции, сниженная функция надпочечников (болезнь Аддисона)
Снижение уровня остаточного азота:печеночная недостаточность,тяжелые болезни печени (вирусные, токсические и аутоиммунные гепатиты) с почечной недостаточностью
-
Переваривание белков в желудке
Происходит под действтем пепсина. Профермент пепсиноген вырабатвается главными клетками желудка и при поступлении пищи секретир-ся в полость жел. В желуд. соке происходит его частичный протеолиз( отщипляется 42 а.к от N-конца молек.профермента) под действием HCl или уже образовавшегося пепсина. В пищевых белках пепсин гидролизует связи, образованные аминогруппой ароматических аминокислот фен и тир , а также глу и асп с любой другой а.к. желуд.сок в норме имеет pH=1,5-2,0 который обусловлен присутствием соляной кислоты. Она секретируется обкладочными клетками желудка .
HCl Ф.: денатурирует белки пищи, создает оптимум pHдля пепсина, активирует пепсиноген путем частичного протеолиза, оказывает бактерицидное действие. В результате работы пепсина в желудке пищевые белки разрушаются на олигопептиды , которые поступают в тонкую кишку.

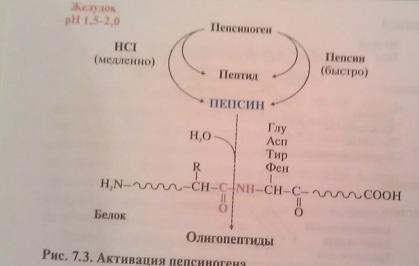
Ферменты желудка
Пепсиногеннеактивный фермент, Пепсин гидролизует внутренние пептидные связи в белке с образованием коротких пептидов:хорошо - между ароматическими аминокислотами (фенилаланин, триптофан, тирозин) и хуже -между лейцином и дикарбоновыми аминокислотами.
Гастриксин – эндопептидаза,. Образуется из пепсиногена, гидролизует внутренние пептидные связи в белке с образованием коротких пептидов.
Муцин – мукопротеид образующий слизь. Существует в 2 формах: нерастворимая фракция - покрывает поверхность слизистой оболочки и изолирует эпителий от пищеварительного процесса (механическая и химическая защита); растворимая фракция - образует коллоидную систему, в которой растворены компоненты желудочного сока. Обладает буферными свойствами, способна нейтрализовать кислотность или щелочность.
Фактор Касла– гастромукопротеид, содержит пептид, отщепляющийся оп пепсиногена (секрет главных клеток) и мукоид (секрет добавочных клеток). Или образуется париетальными клетками?.Фактор Касла связывает «внешний фактор» – витамин В12, предотвращает его разрушение и способствует всасыванию.
Лизоцим - белок, обеспечивающий бактерицидные свойства желудочного сока.



Ферменты кишечнка обладают специфичностью к определенным а.к: трипсин гидролизует пептидные связи, образрванные карбоксильным группами катионогенных аминокислот арг и лиз.; химотрипсин-пептидные св.ароматич.а.к.фен, тир, три; эластаза- связи гли и ала; карбоксипептидаза отщепляет С-концевые а.к; аминопептидаза отщ. N-концевые а.к.; дипептидаза-гидролизует дипептиды из 2х любых а.к.; трипептидаза-трипептиды.;
4. Гниение – превращения аминокислот, вызванные деятельностью микроорганизмов в толстом кишечнике. Усилению процессов гниения аминокислот могут способствовать:избыточное поступление белков с пищей; врождённые и приобретённые нарушения процесса всасывания аминокислот в кишечнике; снижение моторной функции кишечника.
В результате гниения аминокислот образуются различные вещества, многие из которых являются токсичными для организма
Продукты гниения аминокислот являются ксенобиотиками – веществами, чужеродными для организма человека и должны быть обезврежены (инактивированы).
Обезвреживание продуктов гниения аминокислот происходит в клетках печени после поступления веществ из кишечника с кровью воротной вены. Продукты обезвреживания хорошо растворяются в воде и поэтому легко выводятся из организма. Процесс обезвреживания включает, как правило, две фазы (стадии): фазу модификации и фазу конъюгации. В фазе модификации вещества вступают в реакции микросомального окисления, в результате которого образуются полярные группы —ОН или —СООН. Если такие группы уже имеются, то обезвреживание может происходить непосредственно путём конъюгации.Реакции конъюгации заключаются в том, что к указанным группам присоединяется определённое соединение (глюкуроновая кислота, серная кислота, глицин и некоторые другие). Активной формой глюкуроновой кислоты является уридиндифосфоглюкуроновая кислота (УДФГК), активной формой серной кислоты - 3'-фосфоаденозин-5'-фосфосульфат (ФАФС).
5.
6.Под трансаминированием подразумевают реакции межмолекулярного переноса аминогруппы (NH2—) от аминокислоты на α-кетокислоту без промежуточного образования аммиака. Биологическое значение : 1. ОБЕСПЕЧИВАЮТ СИНТЕЗ НОВЫХ АМИНОКИСЛОТ ИЗ ЧИСЛА ЗАМЕНИМЫХ. Из заменимых аминокислот также могут образоваться необходимые клетке кетокислоты. При избытке какой-либо из кислот соотношение быстро восстанавливается трансаминазой за счет другой пары. Недостающее количество какой-либо из кислот может быть взято клеткой из других метаболических путей (например, альфа-кетоглутарат может быть взят из ЦТК). Избыток какой-либо из кислот может быть ликвидирован другими ферментами (например, избыточное количество глутамата окисляется глутаматдегидрогеназой).
2. ОБЕСПЕЧИВАЮТ ПРОТЕКАНИЕ РЕАКЦИЙ КОСВЕННОГО ДЕЗАМИНИРОВАНИЯ.
3. ОБЕСПЕЧИВАЮТ СИНТЕЗ МОЧЕВИНЫ
Главные особенности реакции трансаминирования:
1. Это циклический процесс, все стадии которого катализируются одним и тем же ферментом - трансаминазой данной пары кислот. В этот цикл вступает одна аминокислота и кетокислота (в приведенном примере - это глутамат и ПВК). Образуются другая альфа-кетокислота и аминокислота (в приведенном примере - альфа-кетоглутарат и аланин).
2. Все стадии этого процесса обратимы. Поэтому весь цикл в целом может протекать как в прямом, так и в обратном направлении. Направление этого цикла зависит от соотношения концентраций участников реакции - всех четырех кислот. Резко повысив концентрацию какой-либо одной из кислот, можно направить реакцию по определенному направлению.
3. Каждая трансаминаза обычно специфична для одной пары субстратов и соответствующей ей пары продуктов и все стадии реакции катализируются только одним ферментом. По участникам процесса для данного фермента дают ему название:
Фермент, который катализирует приведенную реакцию, можно назвать: Аланинаминотрансфераза (АлТ) (глутаминово-пировиноградная трансаминаза (ГПТ)).4. Трансаминазы обычно обладают высокой субстратной специфичностью и высокой активностью. Наиболее активными в клетках являются те трансаминазы, для которых хотя бы один из субстратов является дикарбоновой альфа-кетокислотой - это АлТ - аланинаминотрансфераза (ГПТ) и АсТ - аспартатаминотрансфераза (ГЩТ).Определение активности этих ферментов в сыворотке крови имеет важное значение в дифференциальной диагностике таких заболеваний, как вирусный гепатит и инфаркт миокарда.
АсТ и АлТ являются внутриклеточными ферментами. Поэтому в норме их активность в крови очень мала. При вирусном гепатите или при инфаркте миокарда наблюдается разрушение клеток печени или миокарда соответственно. Поэтому в крови будет наблюдаться повышение активности и АлТ, и АсТ, но неодинаковое для каждого из ферментов.
В клетках сердечной мышцы (миокарда) содержится гораздо больше АсТ, чем АлТ, а в клетках печени - наоборот: АлТ намного больше, чем АсТ. Поэтому при инфаркте миокарда активность АСТ в крови будет значительно выше, чем АЛТ, а при вирусном гепатите активность АЛТ будет выше, чем АСТ.Поэтому определение активности этих ферментов в крови помогает врачам в постановке правильного диагноза.
10.источники
аммиака в клетке . Катаболизм аминокислот
в тканях происходит постоянно со
скоростью ∼100
г/сут.
При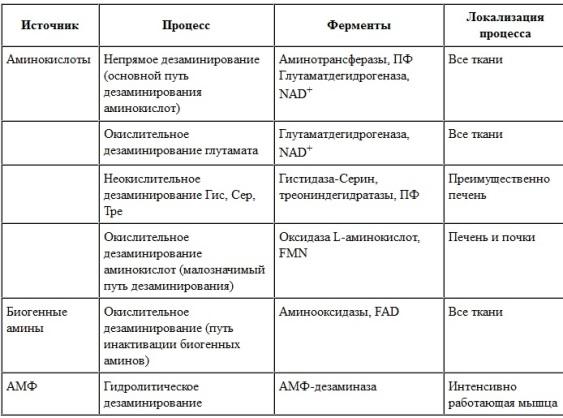 этом
в
результате
дезаминирования
аминокислот
освобождается
большое
количество
аммиака.
начительно меньшие
количества его образуются при
дезаминировании биогенных аминов и
нуклеотидов. Основные источники аммиака
в клетках представлены в табл. 9-3.
этом
в
результате
дезаминирования
аминокислот
освобождается
большое
количество
аммиака.
начительно меньшие
количества его образуются при
дезаминировании биогенных аминов и
нуклеотидов. Основные источники аммиака
в клетках представлены в табл. 9-3.
Часть аммиака образуется в кишечнике в результате действия бактерий на пищевые белки (гниение белков в кишечнике) и поступает в кровь воротной вены. Концентрация аммиака в крови воротной вены существенно больше, чем в общем кровотоке. В печени задерживается большое количество аммиака, что поддерживает низкое содержание его в крови. Концентрация аммиака в крови в норме редко превышает 0,4-0,7 мг/л (или 25-40 мкмоль/л). В крови и цитозоле клеток при физиологических значениях рН аммиак переходит в ион аммония - NH4+, количество неионизированного NH3 невелико (~1%)
.

![]()
Аммиак, образующийся в тканях, сначала превращается в нетоксичное соединение и в таком виде переносится кровью к печени или почкам. Такими транспортными формами являются аминокислоты глутамин, аспарагин и аланин.
. Образование глутамина и аспарагина из глутамата и аспартата соответственно происходит во многих тканях, включая головной мозг:
Глутамин - нейтральное нетоксичное соединение, способное легко проходить через клеточные мембраны. В виде этой аминокислоты аммиак транспортируется в крови. В крови здоровых людей содержание глутамина существенно превышает содержание других аминокислот. Глутамин, помимо участия в синтезе белка, служит источником азота в биосинтезе гистидина, глюкозамина, пуриновых и пиримидиновых нуклеотидов. С кровью глутамин поступает в печень и почки. Здесь он под действием фермента глутаминазы превращается в глутамат и аммиак. При участии аспарагиназы также происходит образование аммиака из аспарагина.
. Аланин является транспортной формой аммиака, которая образуется преимущественно в мышцах. При интенсивной физической нагрузке источниками аммиака служат реакции дезаминирования аминокислот и аденозинмонофосфата (АМФ). Сначала аммиак превращается в аминогруппу глутамата в реакции восстановительного аминирования , катализируемой глутаматдегидрогеназой(см. параграф 18.6.2):
Образовавшийся глутамат переносит затем свою α-аминогруппу на пируват, всегда имеющийся в достаточном количестве, поскольку это продукт протекающего в мышцах гликолиза. Реакция катализируется аланинаминотрансферазой.
Глутамат + Пируват α-Кетоглутарат + Аланин
Аланин (нейтральная аминокислота, не несущая суммарного заряда при значениях рН, близких к 7) выходит из клеток и доставляется кровью к печени. Здесь он под действием аланинаминотрансферазы передаёт свою аминогруппу α-кетоглутарату, в результате чего образуется глутамат.
α-Кетоглутарат + Аланин Глутамат + Пируват
Далее в реакции, катализируемой глутаматдегидрогеназой, глутамат дезаминируется с образованием α-кетоглутарата и аммиака, который в печени превращается в мочевину.
11.
