
- •Дипломная работа
- •1 Обзор литературы
- •1.1 Классификация и назначения ферросплавов
- •1.2 Основные способы получения ферросплавов. Общие требования к их качеству
- •1.3 Алюминотермическое восстановление оксидов металлов. Характеристики алюминотермического процесса.
- •1.4 Некоторые аспекты проведения металлотермии
- •1.5 Самораспространяющийся высокотемпературный синтез как способ получения чистых металлов
- •1.6 Вольфрам, свойства вольфрама и его соединений, области применения
- •2 Экспериментальная часть
1.3 Алюминотермическое восстановление оксидов металлов. Характеристики алюминотермического процесса.
Одним из важнейших технико-экономических показателей промышленных алюминотермических процессов является извлечение восстанавливаемого металла из концентратов. Физико-химические факторы, от которых зависит степень извлечения металлов из оксидов: скорость плавления шихты, температурные условия плавки, полнота протекания диффузионных процессов.
Вероятная полнота протекания процесса и принципиальная возможность его осуществления определяются, в первую очередь, термодинамическими характеристиками взаимодействия оксидов металлов с алюминием [11].
Общий вид уравнения взаимодействия оксидов с алюминием (1):
2/m MenOm + 4/3 Al = 2n/m Me + 2/3 Al2O3 (1)
Самопроизвольное протекание этой реакции возможно при условии –высокая термодинамическая прочность оксидов алюминия по сравнению с оксидами восстанавливаемых металлов [12]. Прочность оксидов различных металлов можно охарактеризовать величиной изобарного потенциала ∆G0, имеющего места при взаимодействии этих металлов с кислородом.
При проведении алюминотермического процесса рассчитывают изобарно-изотермический потенциал. Данный расчет сводится к анализу термодинамических равновесий в системе металл - неорганическое вещество. Как известно, любой химический процесс сопровождается изменением энергии системы. Оно равно максимальной работе, которая производится этой системой или совершается над системой в течение процесса [13].
Необходимые расчеты проводят используя стандартные величины по обобщенному уравнению как первого, так и второго закона термодинамики (уравнение Гиббса-Гельмгольца) (2):
∆G = ∆H - Τ∆S, (2)
где ∆G – энергия Гиббса;
∆Η – полная энергия системы;
Т∆S – связанная энергия (при Р = const).
Все подсчеты по таблицам стандартных величин проведены учитывая свойства аддитивности ∆G, ∆Н и ∆S [12].
Также имеются расчетные данные температурной зависимости энергии Гиббса для каждой реакции, в ходе которых образуются различные вещества. К примеру, для некоторых оксидов конденсированной и газовой фаз построены диаграммы ∆G 0 – Т [14], позволяющие довольно быстро оценить, какой металл способен восстанавливать другой металл из соответствующего оксидного соединения [15,16,17].
На рисунке 1 можно наблюдать совместное восстановление многокомпонентных систем. При этом наибольший энергетический вклад в систему вносят триоксид железа (1), триоксид вольфрама (2), триоксид марганца (3). Эти оксиды будут восстанавливаться первыми при рассмотрении температурного интервала. Оксиды MnO и SiO2 восстанавливаются наиболее трудно.
В ходе производства ферросплавов при восстановлении для сдвига равновесия реакций вправо необходимо присутствие трудновосстанавливаемых оксидов растворителя – железа по следующим перечисленным причинам [19]:
- в системе создается более приятные энергетические условия (уменьшается общее значение ΔG0 ), так как оксиды железа восстанавливаются наиболее легче большинства других оксидов;
- железо растворяет восстановленные элементы, при этом понижает их активность, что приводит к смещению равновесия в сторону восстановления в соответствии с констатацией равновесия реакций;
- железо препятствует протеканию вторичных реакций (окислению), а также испарению элементов;
- железо понижает температуру плавления металлической фазы, а также позволяет вести плавку при более низкой температуре.
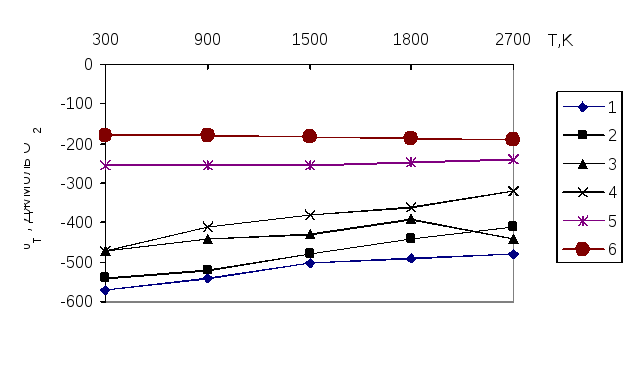
1 – 2/3 Fe2O3 + 4/3 Al = 4/3 Fe + 2/3 Al2O3;
2 – 2/3 WO3 + 4/3 Al = 2/3 W + 2/3 Al2O3;
3 – 2/3 Mn2O3 + 4/3 Al = 4/3 Mn + 2/3 Al2O3;
4 – 2 FeO + 4/3 Al = 2 Fe + 2/3 Al2O3;
5 – 2 MnO + 4/3 Al = 2 Fe+ 2/3 Al2O3;
6 – SiO2 + 4/3 Al2O3 = Si + 2/3 Al2O3.
Рисунок 1 – Температурная зависимость изменения изобарного потенциала реакций, протекающих в ходе алюминотермического восстановления оксидов [18]
Проводя термодинамический анализ реакций одновременного алюминотермического восстановления двух или нескольких оксидов необходимо учитывать величину концентраций веществ в металлической фазе. Для того, чтобы оценить влияние концентрации на восстанавливаемость оксида используют реакцию диссоциации оксидов [18]:
2/m MenOm= 2 n/m Me + O2, (3)
константа равновесия данной реакции равна:
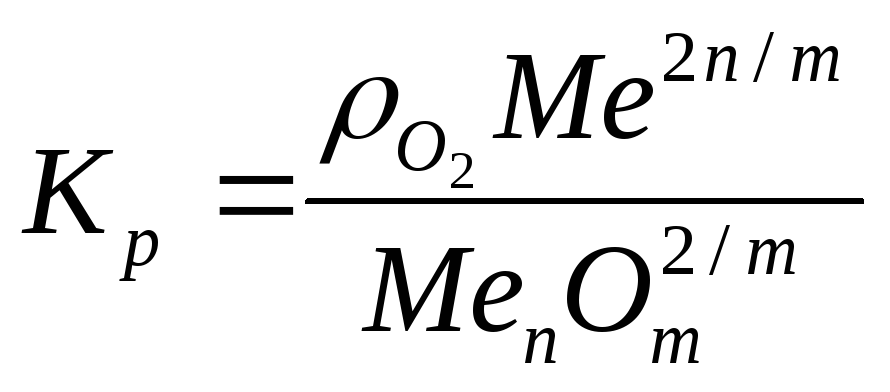 .
(4)
.
(4)
где Kp - константа равновесия;
![]() -
давление кислорода;
-
давление кислорода;
Me - металл.
Если
решить уравнение относительно давления
кислорода
![]() ,
то
уравнение (4) будет иметь вид:
,
то
уравнение (4) будет иметь вид:
![]() (5)
(5)
Термодинамически
более уместным является восстановление
оксидов с максимальным
![]() ,
когда
восстанавливают несколько оксидов
алюминием.
,
когда
восстанавливают несколько оксидов
алюминием.
В
соответствии с уравнением (5): по мере
протекания восстановительных реакций
концентрация МеnOm
уменьшается, а концентрация металла
растет, что приводит к уменьшению
![]() .
.
Обе реакции
восстановления будут иметь равную
термодинамическую вероятность в связи
с тем, что уменьшение величины
![]() ,
в ходе восстановительных процессов
может привести к тому, что прочность
оксида, имеющего в чистом виде большее
сродство к кислороду.
,
в ходе восстановительных процессов
может привести к тому, что прочность
оксида, имеющего в чистом виде большее
сродство к кислороду.
Из этого следует, что восстанавливаемость оксидов зависит как и от их прочности, определяемой величиной изобарного потенциала по уравнению(2), так и от их концентраций в расплаве. В ходе реакции тепла, выделяемого при алюминотермическом восстановлении триоксида вольфрама, достаточно для протекания до конца [20].
В реакции (1) константа равновесия при 2000 К составляет 2104, что соответствует равновесному составу с содержанием 1% волластонита в шлаке и 0,4% WO. Процесс протекает с высоким извлечением полезного ведущего элемента, так как реакция сопровождается значительным изменением энергии Гиббса [20].
Удельный тепловой эффект Q, характеризующий алюминотермический процесс, можно определить [16], как отношение теплового эффекта реакции Qр к сумме молекулярных масс всех реагирующих веществ ∑М, кДж/кг:
Q = Qp / ∑М (6)
Для определения удельного теплового эффекта, исходя из результатов многочисленных опытов алюминотермического восстановления оксидов, предложена [17] эмпирическая формула (4):
ℓgQ = (∆Η0298 К /360) + 2,33 (7)
где Q – тепловой эффект данного алюминотермического процесса, кДж/кг;
∆Η298 К – тепловой эффект образования оксида, кДж/г·моль.
Суммарный удельный тепловой эффект при условии, что шихта состоит из двух восстанавливаемых соединений, определяют по уравнению (8):
Q = [x (Q1 – Q2)/100] + Q2 (8)
где х – составляет содержание первого соединения в шихте, %;
Q1 и Q2 – удельные тепловые эффекты при восстановлении первого и второго оксида соответственно [10].
Температура является вторым важнейшим параметром, характеризующим тепловые условия протекающего алюминотермического процесса. Процесс определения температуры экспериментальным и расчетным путями очень трудоемкий. Трудности возникают из-за отсутствия надежных данных по теплофизическим константам веществ при высоких температурах. При использовании суммарных величин энтальпий продуктов реакции можно рассчитать температуру реакции [21].
По теории Шиндловского А.А. для расчета максимальной температуры металлотермической реакции [22] можно использовать следующее уравнение(9):
t = Q – ∑ (Lпл + Lкип) / ∑Ср, (9)
где ∑Ср – сумма теплоемкостей всех продуктов данной реакции, Дж/моль∙К;
∑(Lпл + Lкип) – сумма скрытых теплот плавления и испарения всех продуктов данной реакции, Дж/моль.
Ключников Н.Г. [20] предлагает уравнение (10), в ходе которого можно определить температуру реакционной массы алюминотермического процесса восстановления оксидов:
t
=
![]() ,
(10)
,
(10)
где ∆Н1 – теплота образования восстановления оксида, Дж/г-экв;
∆Н2 – теплота образования оксида металла-восстановителя, Дж/г-экв;
Э1 и Э2 – эквивалентные массы восстанавливаемого оксида и металла-восстановителя соответственно;
К – коэффициент, который для алюминотермических реакций принимается равным 3,15.
Используя тепловой баланс величины плавки, по формуле (11) проводят расчет максимальной температуры алюминотермического процесса восстановления оксидов [20,21]:
Tmax = (Q - Q1 + Cp МеТпл Ме + Ср МеОТпл МеО) / (Ср Ме + Ср МеО) (11)
где Q – удельный тепловой эффект данной реакции;
Q1 – соответствует сумме изменений энтальпий продуктов реакции до температуры плавления;
Ме, МеО – продукты реакции;
Тпл – температура плавления;
Ср – теплоемкость продуктов реакции.
Выведена эмпирическая зависимость для определения температуры реакции, используя расчеты по этому уравнению для алюминотермического восстановления ряда оксидов (12):
Тmax = 730 +22,4 δΗ′, (12)
где δΗ′ - количество тепла данной реакции, кДж/г-атом.
Тепла, выделяющегося в ходе протекания основной реакции восстановления оксида, обычно недостаточно для нормального протекания процесса, полного разделения металла и шлака (получение титана, хрома). Поэтому при проведении внепечной выплавки часто используются добавки в шихту оксидов и других многих соединений (термитные добавки), которые при взаимодействии с алюминием дают значительно большую удельную теплоту процесса, чем основной восстанавливаемый оксид [23].
Повышение расхода восстановителя, увеличение количества шлака - все это является существенными недостатками термитных добавок.
По сравнению с применением термитных добавок наиболее эффективным является предварительный нагрев шихтовых материалов.
Температуру процесса необходимо выбрать так, чтобы она обязательно превышала температуру плавления шлака на 300-400 0С. Значение температуры внепечного процесса необходимо принимать максимально возможное, потому что повышение температуры этого процесса может привести к снижению восстанавливаемости оксидов и повышенному испарению элементов во время плавки, а также это повышение связано с дополнительными затратами [10].
На скорость алюминотермического процесса влияют большое количество факторов. Прежде всего, скорость процесса зависит от теплохимических параметров данной реакционной массы, тепловых условий протекания и механизма алюминотермической реакции.
В конденсированных фазах для оценки скорости процессов используют ниже перечисленные выражения [24]:
а) линейная скорость горения определяется по высоте столба прореагировавшего расплава h:
vh
=
![]() (см/сек);
(13)
(см/сек);
(13)
б) объемная скорость горения определяется:
vs
= Vn S
=
![]() (см3/сек),
(14)
(см3/сек),
(14)
где S – поверхность протекания реакции;
в) массу прореагировавших веществ можно определить из соотношения:
vm
= vs
d
=
![]() =
=
![]() (г/сек), (15)
(г/сек), (15)
где d – плотность всех шихтовых материалов.
В зависимости от физико-химических свойств шихтовых материалов и продуктов плавки скорость проплавления шихты должна находиться в пределах от 100 до 400 кг/м2∙мин. Это условие необходимо для нормального протекания промышленной внепечной плавки алюминотермических ферросплавов и лигатур.
Возникновение металлической фазы в виде дисперсных капель - специфическая особенность алюминотермического процесса. Благодаря этому свойству слиток алюминотермического сплава формируется в результате осаждения частиц восстанавливаемого металла через толщину расплава. От размера, плотности и вязкости металлической фазы жидкой металлической капли зависит скорость ее движения через расплавленный шлак. Поверхностные свойства металла определяют продолжительность разделения продуктов реакции.
Жидкая металлическая капля опускается под действием силы тяжести в расплавленном шлаке. Эта капля движется в начале пути ускорено до тех пор пока в связи с увеличением сопротивления вязкой среды, пропорциональной скорости падения, рост скорости капли не прекратится, дальнейшее ее движение становится равномерным с постоянной скоростью vр [15]. Радиус образовавшейся капли влияет на движение жидкой капли в расплаве.
Так как шихта состоит из порошкообразных компонентов, то в результате протекания алюминотермической реакции будут образованы мелкие капли металла. Эти капли, опускаясь через расплавленный шлак, застывают на подине горна в виде металлического слитка.
По реакциям (16) и (17) может быть получен ферровольфрам алюминотермическим способом:
3WO3 + 4Al = 3W + 2Al2O3 (16)
Fe2O3 + 2Al = 2Fe + Al2O3, (17)
выявлено [15]: из каждой единицы объема алюминия, израсходованного на восстановление железа, может быть образовано 0,76 единиц объема железа. Объем получаемого металла и объем израсходованного алюминия близки между собой, что характерно, в основном, для всех алюминотермических реакций.
Авторы [28] предлагают формулу (18) для расчета скорости осаждения металла, которая применяется для большинства алюминотермических процессов, при исследовании падения капель феррохрома в шлаке [25-27]:
r
max
=
![]() . (18)
. (18)
Необходимое условие применимости данного уравнения – ламинарность движения капли, т.к. уравнение Стокса (19):
r2 ∙ g (γ2 – γ1)
v0 = 2/9 —————— , (19)
η
оно справедливо только в том случае, когда сопротивление среды движению шарика пропорционально скорости падения капли. Критическая скорость - это скорость, выше которой сопротивление среды перестает быть пропорциональным скорости падения шарика и, следовательно, ламинарное движение сменяется турбулентным. И эта скорость выражается следующим уравнением:
rmax
=
 .
(20)
.
(20)
Из расчетов по этой формуле получены значение rmax = 1,97 см, которое применимо для выплавки ферровольфрама.
Уравнение (20) можно использовать для расчета скорости осаждения металла через расплавленный шлак в алюминотермических реакций, т.к. значение rmax = 1,97 намного превышает размер образующихся во время реакции восстановления капель.
Анализируя уравнение (20) можно сделать следующие выводы о том, что скорость движения жидкой металлической капли через расплавленный шлак зависит от ее плотности, размера, вязкости металлической и шлаковой фаз. Как известно, важное значение в формировании металлического слитка имеет плотность алюминотермических расплавов.
Технико-экономические показатели производства алюминотермических расплавов определяются формированием слитка в ходе алюминотермического процесса и вязкостью расплава [26].
Вязкость и плотность металла определяют скорость опускания металлической капли. Для того, чтобы снизить вязкость при проведении алюминотермических процессов в шихту вводят различные флюсующие добавки. Наиболее распространенными из них являются известь и плавиковый шпат. Характерной особенностью оксида кальция является то, что он может образовывать со многими оксидами металлов химические соединения с пониженной температурой плавления. Добавка извести обычно приводит к снижению вязкости [27].
Избыток СаО в шихте ведет к понижению активности триоксида вольфрама согласно реакциям (оптимальное количество извести равно 15 % от массы алюминия):
CaO + WO3= CaOWO3 (21)
2CaO + WO3 = 2CaOWO3 . (22)
В зависимости от количества выделяющегося тепла Qэкз алюминотермические процессы можно разделить на три группы:
самопроизвольно протекающие (Qэкз ≥ Qр + Qп);
с компенсацией тепловых потерь Qп (Qэкз - Qр <Qп);
3) с введением значительных количеств тепла из вне Qp (Qэкз <Qp).
Одним из важнейших факторов, определяющих показатели внепечной плавки, является степень измельчения шихтовых материалов. Поэтому в зависимости от крупности оксидов, условий проведения процесса должен выбираться размер алюминиевого порошка [8].
Для достижения максимального развития восстановительных реакций размер восстановителя должен выбираться так, чтобы при смешивания всех шихтовых материалов в каждой из элементарной части шихты, компоненты обязательно находились в стехиометрическом соотношении (с учетом коэффициентов).
Следовательно, необходимо соответствие отношения объемов зерен оксида и восстановителя и отношения их грамм-эквивалентных объемов (таблица 1) для того, чтобы достигнуть стехиометрического соотношения реагентов в каждый момент проплавления шихты [9].
Таблица 1 – Соотношение грамм-эквивалентных объемов восстанавливаемых оксидов алюминия [18]
|
Восстанав-ливаемый оксид |
Объем грамм-эквивалента оксида (Vок ) |
Vок/VАl |
DАl/dок |
Восста-навли-ваемый оксид |
Объем грамм-эквивалента оксида (Vок) |
Vок/ VАl |
DАl/dок
|
|
Ba2 O3 Ga2 O3 Fe2 O3 Mn2 O3 Cr2 O3 Ge2 O3 Si2 O3 Zr2 O3 |
6,3 5,3 5,1 5,9 4,8 5,6 6,5 5,6 |
1,91 1,47 1,55 1,78 1,47 1,70 1,97 1,70 |
0,81 0,88 0,86 0,83 0,88 0,83 0,80 0,83 |
Ti O2 V2 O5 Nb2 O5 Ta2 O5 WO3 Mo O3 NiO CuO |
5,2 5,4 5,7 5,1 5,4 5,4 5,0 6,2 |
1,57 1,63 1,73 1,53 1,63 1,63 152 1,68 |
0,86 0,85 0,83 0,86 0,85 0,85 0,87 0,84 |
По представленным в таблице 1 данным можно сделать вывод: для большинства оксидов грамм-эквивалентный объем превышает объем грамм-эквивалента алюминия в 1,5 = 1,9 раза. Приняв форму зерен компонентов за сферическую, диаметр частиц алюминия должен находиться в пределах (0,8-0,9)dок (диаметр зерна восстанавливаемого оксида). Учитывая, что степень восстановления оксидов в промышленных внепечных алюминотермических процессах составляет около 70 - 90%, то приведенное отношение становится более близким к единице. В итоге, принимая величину частиц алюминиевого порошка близкой к размеру частиц оксида, при заданном размере частиц оксида соотношение шихтовых материалов будет близко к стехиометрическому.
Повышение показателей процесса и главным образом выхода металла, применяя шихтовые материалы одинаковой крупности, было установлено рядом исследований [2,10].
Изучая влияние измельчения алюминия на скорость плавления шихты его крупность была измерена величиной поверхности 1 г порошка, рассчитанной по условному диаметру зерна металла [29].
Для того, чтобы получить максимальный выход металла крупность восстановителя должна быть близкой к крупности восстанавливаемого оксида, причем выход металла тем больше, чем выше измельчение компонентов шихты. При этом нужно учитывать, что переизмельчение шихты алюминотермической плавки приведет к высокому выносу шихтовых материалов и выбросам расплава во время проведения плавки. При тонком измельчении оксидов и получении мелких фракций порошка алюминия приводит к дополнительным потерям материалов. Вследствие этого, восстанавливаемые оксиды не должны быть измельчены менее чем до 0,1 - 0,3 мм [29].
Обеспечение необходимых условий для нормальной скорости проплавления шихты возможно в том случае, когда будут подобраны равные размеры восстановителя и оксидов. Если скорость процесса медленная, то размер частиц восстановителя следует уменьшить по сравнению с крупностью оксида.
Когда ведется подбор степени измельчения шихтовых материалов необходимо учитывать, что скорость осаждения восстановленного металла определяется величиной зерна восстановителя, и причиной больших потерь в виде корольков, остающихся в шлаке, будет являться применение мелких фракций алюминиевого порошка [29].
