
Физика все ответы ЗА ВТОРОЙ СЕМЕСТР / Fizika_2_1-2_3
.pdf
2.Элементы статической термодинамики.
2.1Основные понятия молекулярно-кинетической теории идеальныхгазов.
1.Экспериментальные основания атомизма.
-
2.Закон Авогадро. Число Авогадро.
Na, число Авогадроколичество атомов, содержащихся в 12г. изотопа углерода 12C.
Na= 6,02*10^23 1/моль
Мольтакое количество вещества, которое содержит Na атомов или молекул.
Закон Авогадро- в равных объёмах различных газов, взятых при одинаковых температуре и давлении, содержится одно и то же число молекул.
3.Элементарные газовые законы.
-
4.Закон парциальных давлений.
Если в сосуде содержится смесь химически не реагирующих газов, то давление этой смеси = сумме парциальных давлений, т.е. давление которое каждый газ в отдельности оказывает на стенки сосуда.
5.Уравнение состояния идеального газа. Pg=p=⅔n<Fk0> F-большое k0маленькое справа внизу. n=N/V
Идеальный газгаз молекул, которые очень редко и очень слабо взаимодействуют друг с другом.
6.Уравнение p=nkT. Постоянная Больцмана.
Постоянная Больцманафизическая постоянная, определяющая связь между температурой и энергией.
Экспериментальное значение = 1,3806488(13)*10^-23 Дж/К.
p=nkT p-давление n-концентрация частиц k- постоянная Больцмана.
7.Вероятность и молекулярно-кинетическая теория.
8.Модель идеального газа.
Идеальный газгаз молекул, которые очень редко и очень слабо взаимодействуют друг с другом.
9.Элементарный вывод основного уравнения молекулярно-кинетической теории идеального газа.
-
10.Уравнение <E >= 3/2 kT. Статистическое толкование температуры.
Температураскалярная физическая величина, характеризующая приходящуюся на одну степень свободы среднюю кинетическую энергию частиц макроскопической системы, находящейся в состоянии термодинамического равновесия.
11.Степень свободы молекулы и закон равнораспределения энергии по степеням свободы Число степеней свободы молекулы, называется количество независимых координат необходимых для однозначного описания положения молекулы в пространстве.
1 атом- 3 степени свободы
N независимых атомов3n степеней свободы 2 связанных атома- 5 степеней свободы (3+2)
3 связанных атома (треугольник)- 6 степеней свободы (3+2+1) N атомов связанных стержнями – 6 степеней свободы
2 атома связанных пружиной – 6 степеней свободы, но отличаются качественно.
12.Понятие статистического распределения. Среднее значение физических величин.
-
13.Распределение молекул по скоростям (распределение Максвелла). Формула, график. Наиболее вероятная, средняя и средняя квадратичная скорости молекулы.
Функция распределение Максвелла: f(Ѵ)=4π((m /2π)^(3/2))*Ѵ²*L^(n Ѵ²/2kT)
Графиксмотреть фото! (2-я справа от фото раб. стола.) Наиболее вероятная скорость.
Ѵн.в.=1/корень(m /2kT) = корень (2kT/m )
Среднеквадратичная скорость.
< Ѵ²>=3kT/m
14.Средняя длина свободного пробега и среднее количество столкновений молекул газа. Длина свободного пробега молекулырасстояние которое проходит молекула между 2-я последовательными столкновениями.
<L>=<Ѵ>/<Z>=1/корень из 2*deff^2
Эффективный диаметр молекулынаименьшее расстояние на которое сблизятся центры 2- х молекул при лобовом столкновении на тепловых скоростях.
Среднее количество столкновений молекул газа (z) Z= π*корень из 2*<Ѵ>deff^2
2.2Феноменологическая термодинамика.
1.Термодинамические параметры. Термодинамические процессы.
К термодинамическим параметрам относятся: температура, плотность, давление и объем. Плотностьскалярная физическая величина, определяемая как отношение массы тела к занимаемому этим телом объёму
Давлениефизическая величина, равная силе F, действующей на единицу площади поверхности S перпендикулярно этой поверхности
Объемколичественная характеристика пространства, занимаемого телом или веществом.
Термодинамические процессы:
- Адиабатическийпроцесс без теплообменом с внешней средой. du+dA=0 du=½RdT dA=pdV (график P/V, линия \)
-Изохорныйпроцесс без изменения объема. (график P/V, линия вертикальная)
V=const A=0, мех. Работа газомне совершается.
-Изобарныйпроцесс без изменения давления (график P/V, линия горизонтальная)
P=const A=p(V -V )
-Изотермическийпроцесс без изменения температуры. t =const A=(m/μ)RT*Ln(V /V )
-Политропическийпроцесс без изменения теплоемкости. pV^ǽ=const 1≤ǽ≤(i+2)/I p V ^ǽ=p V ^ǽ

2.Внутренняя энергия и работа термодинамической системы.
Внутренняя энергиясумма энергий молекулярных взаимодействий и тепловых движений молекулы.
Внутреннюю энергию нельзя измерить напрямую. Можно определить только изменение внутренней энергии:
- - подведенная к телу теплота, измеренная в джоулях.
- подведенная к телу теплота, измеренная в джоулях.
-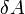 - работа, совершаемая телом против внешних сил, измеренная в джоулях
- работа, совершаемая телом против внешних сил, измеренная в джоулях
Работа в термодинамическом процессе |
, выражается так: |
. |
3.Работа в элементарных газовых процессах.
-
4.Первое начало термодинамики.
Изменение внутренней энергии системы при переходе её изодного состояния в другое равно сумме работы внешних сил и количества теплоты, переданного системе
5.Теплоемкость. Теплоемкость идеального газа. Cp и Cv.
Теплоемкость - физическая величина, определяющая отношение бесконечно малого количества теплоты δQ, полученного телом, к соответствующему приращению его температуры δT
Теплоемкость идеального газа - отношение количества теплоты, сообщенного газу, к
изменению температуры δТ, которое при этом произошло.  .
.
 , где R- универсальная газовая постоянная (8,31 Дж/(моль·К))
, где R- универсальная газовая постоянная (8,31 Дж/(моль·К))
6.Адиабатический процесс. Уравнение Пуассона.
Адиабатический процесспроцесс без теплообмена с внешней средой. du+dA=0. Это процесс, где работа совершается за счет внутренней энергии. du=(i/2)RdT
dA=pdV

7.Циклические процессы. Тепловые машины и их КПД.
Тепловая машинаустройство позволяющее преобразовывать тепло в механическую работу.
Циклический тепловой двигательустройство использующее замкнутый термодинамический процесс.
КПДхарактеристика эффективности системы (устройства, машины) в отношении преобразования или передачи энергии.
это все умножить на 100%.
Где A- полезная работа, Q- затраченная работа.
КПД теплового двигателя-
Q1количество теплоты, полученное от нагревателя, Q2количество теплоты, отданное холодильнику.
8.Второе начало термодинамики (формулировки Клаузиуса и Кельвина-Планка)
-Кельвин-Планк – НЕ существует циклического теплового двигателя, единственный результатом действия которого, является извлечение механической работы за счет полученного двигателем тепла. Некоторое количество тепла необходимо передать холодильнику.
-Клаузиус – Невозможен спонтанный (самопроизвольный) переход тепла от менее нагретого тела к более нагретому.
9.Идеальные тепловые машины. Теорема Карно.
Прямой цикл Карно. 1→2 изотермический процесс Q =A 2→3 адиабатический процесс A =-Δμ 3→4 изотермический процесс Q =A 4→1 Адиабатическое сжатие
Теорема Карноmax КПД среди всех машин использующих данный нагреватель и данный холодильник имеют идеальные тепловые машины (у всех одинаковый КПД)
10.Цикл Карно, вычисление его КПД. Цикл Карно смотреть 9. Вычисление его КПД. ή= (T - T )/T
11.Термодинамическая энтропия. Закон возрастания энтропии. Энтропия вселенной стремится к максимуму.
В любой замкнутой термодинамической системе энтропия не убывает.
12.Статистическое толкование энтропии. Смотреть 11.

2.3Фазовыепереходы.
1.Реальные газы. Газ Ван-дер-Ваальса.
Реальный газ, это такой газ, которые не описывается уравнением состояния идеального газа Клапейрона — Менделеева.
Газ Ван-дер-Ваальса.
Изотерма идеального газа: pVm=RT
2.Изотермы Ван-дер-Ваальса. Правило площадей Максвелла. Смотреть фото с изотермами.
3.Конденсация и испарение. Плавление и кристаллизация. Сублимация.
Сублимацияпереход из твердого состояния в газовое, не затрагивая жидкое состояние. Конденсацияпереход из газообразного состояния в жидкое или твердое.
Испарениепереход вещества из жидкого состояния в газообразное. Плавлениепереход вещества из твердого состояния в жидкое.
Кристаллизацияпереход вещества из жидкого состояния в твердое с образованием кристаллов.
4.Общее представление о фазовых переходах.
Фазовый переходизменение фазы вещества происходящее при небольшом изменение термодинамических параметров.
Фазовый переход 1-го родапереход требующий затрат тепла.
Фазовый переход 2-го родане требует затрат тепла в точке фазового перехода.
5.Фазовые диаграммы. Тройная точка. Фазовые диаграммы смотреть 3.
Тройная точкаточка на фазовой диаграмме, где сходятся три линии фазовых переходов. Обычно тройная точка определяется значением температуры и давления, при котором вещество может равновесно находиться в трёх (отсюда и название) агрегатных состояниях
— твёрдом, жидком и газообразном. В этой точке сходятся линии плавления, кипения и сублимации.
6.Уравнение КлапейронаКлаузиуса.
теплота фазового перехода (например, теплота испарения, теплота плавления) при квазистатическом процессе определяется выражением  .
.
L - удельная теплота фазового перехода  - изменение удельного объёма тела при фазовом переходе.
- изменение удельного объёма тела при фазовом переходе.
7.Фазовые переходы 2-го рода. Примеры.
Фазовый переход 2-го родане требует затрат тепла в точке фазового перехода. Примеры: переход системы через критическую точку,переход металлов и сплавов в состояние сверхпроводимости, переход жидкого гелия в сверхтекучее состояние.
