
- •Организация скелетных мышц позвоночных
- •Механизм сокращения мышечных волокон
- •В отсутствие АТФ (АТР), т. е. в исходном состоянии, головки молекул миозина прочно
- •Электромеханическое сопряжение
- •Саркоплазматический ретикулум
- •Переносу потенциала действия на СР индивидуальной миофибриллы способствуют поперечные трубочки Т-системы, представляющие трубчатые
- •Регуляция ионами кальция
- •Таким образом, при сокращении мышечного волокна скелетных мышц позвоночных происходит следующая последовательность событий.
- •Энергетический обмен в мышечной ткани
- •Потребности работающей мышцы в АТФ удовлетворяются за счет следующих ферментативных реакций:
- •2 Анаэробный гликолиз. В мышечной ткани наиболее важным долгосрочным энергетическим резервом является гликоген.
- •4. Образование инозинмонофосфата [ИМФ (IMP)]. Другим источником быстрого восстановления уровня АТФ является конверсия
- •В клетках, не содержащих митохондрий (например, в эритроцитах), или в тканях при недостаточном
- •Обратная связь, подобная циклу Кори, существует в цикле аланина, в котором также участвует
- •Метаболизм белков и аминокислот
- •Синтез и расщепление мышечных белков контролируются гормонами. Тестостерон и
- •Белки мышц
- •Миоглобин
- •Миозин
- •Актин
- •Тропомиозин
- •Тропонин
- ••В мышцах присутствует фетальная форма миозина, обладающая измененной структурой, сниженной АТФ-азной активностью
- •Биосинтез и распад креатина
- •Синтез креатина
- ••Вторая стадия – метилирование- протекает в печени.
- •• В мышцах имеется
- ••Креатинин образуется в результате неферментативного дефосфорилирования креатинфосфата.
- •Содержание в плазме крови
- •Диагностическое значение
- •Физиологическая креатинурия наблюдается
- •Повышение выделения креатина наблюдается при




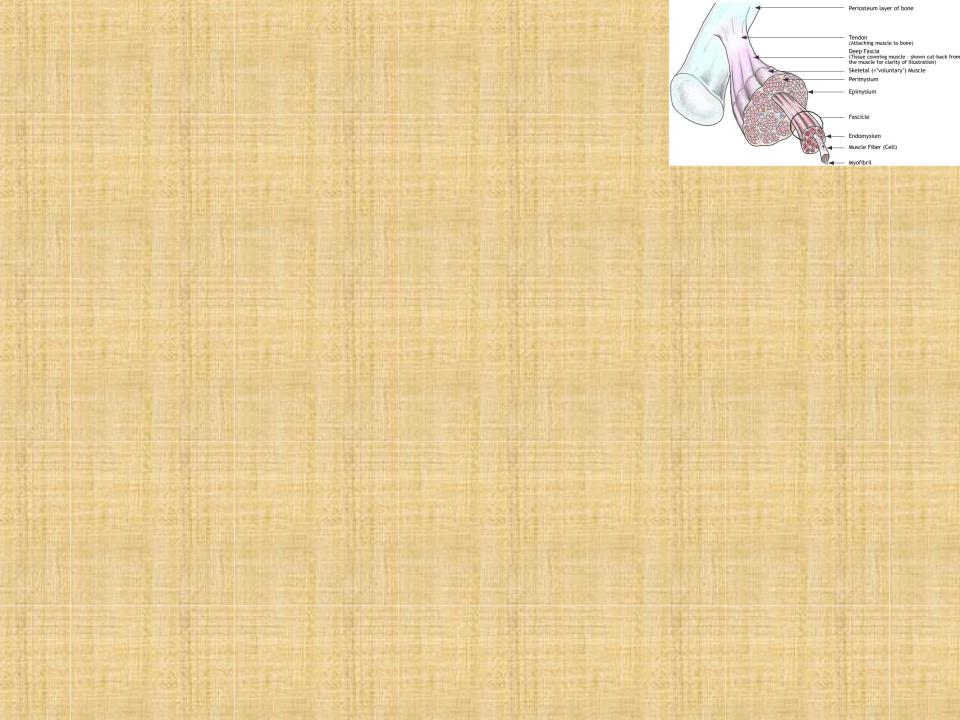
Организация скелетных мышц позвоночных
Сократительные элементы, саркомеры, состоят из двух типов параллельных нитей, толстых филаментов миозина и тонких филаментов F-актина. Крайние, более темные области Α-дисков содержат как тонкие, так и толстые нити, тогда как центральная часть, Н-зона, содержит только нити миозина. Z-линии (или Z-пластинки) соответствуют тем участкам, где тонкие нити крепятся к так называемым Z-дискам. Саркомером называется продольная единица, ограниченная двумя Z-линиями.


В количественном отношении наиболее важным белком миофибрилл является миозин (~65% мышечного белка). Молекула миозина построена из шести субъединиц, двух идентичных тяжелых цепей (2 х 223 кДа) и четырех легких цепей (~20 кДа), связанных нековалентно. Каждая тяжелая цепь миозина имеет форму длинного стержня длиной 150 нм с глобулярной головкой на N-конце и напоминает клюшку для гольфа (на схеме внизу справа). α-Спиральные участки двух тяжелых цепей свернуты в двойную суперспираль, а четыре небольших субъединицы связаны с глобулярными головками. В мышечном волокне миозин образует
толстые миозиновые филаменты, которые представляют собой пучки из сотен молекул миозина, расположенных параллельно. Головка молекулы миозина обладает Са2+-зависимой АТФ-азной активностью
(КФ 3.6.1.32), которая регулируется малыми субъединицами.

Главным белком тонких нитей является актин (42 кДа, ~20-25% мышечного белка). Фибриллярный F-актин является важным структурным элементом цитоскелета; он находится в равновесии с глобулярным G-
актином.
Кроме этих двух белков система включает тропомиозин и комплекс тропонина. Нитевидный тропомиозин (64 кДа) связан с F-актином, охватывая примерно семь актиновых субъединиц. Тропонин (78 кДа) - комплекс, состоящий из трех различных субъединиц (Т, С, I), способен связываться как с актином, так и с тропомиозином. Остальные белки, присутствующие в гораздо меньшем количестве, включают α- и β-актинин, десмин, коннектин (титин) и виментин.


Механизм сокращения мышечных волокон
Сокращение мышечных волокон обусловлено продольным скольжением толстых миозиновых и тонких актиновых филаментов относительно друг друга. Сокращение мышечных волокон является результатом следующего цикла реакций:

В отсутствие АТФ (АТР), т. е. в исходном состоянии, головки молекул миозина прочно связаны с актиновыми нитями. При связывании АТФ головки отделяются от актиновых нитей.
АТФ-аза головок миозина гидролизует АТФ на АДФ и неорганический фосфат, но продолжает удерживать оба продукта реакции близко друг от друга. Гидролиз АТФ вызывает аллостерические изменения в миозиновой головке.
Теперь головка миозина образует новый мостик с соседней молекулой актина.
Актин ускоряет выброс продуктов АТФ-азной реакции из активного центра миозина. Это приводит к преобразованию аллостерического напряжения и изменению конформации головки миозина, которое действует подобно «удару весла» (модель весельной лодки). Во время этого «гребка» миозиновые головки отклоняются на определенный угол от оси и перемещают миозиновый филамент вдоль актинового филамента по направлению к Z-диску. Цикл повторяется до тех пор, пока имеется АТФ.


Электромеханическое сопряжение
Сокращением мышечного волокна управляют
двигательные нейроны, которые выделяют нейромедиатор ацетилхолин в нервно-мышечные соединении (синапсы). Ацетилхолин диффундирует через синаптическую щель и взаимодействуют с ацетилхолиновыми (холинэргическими) рецепторами плазматической мембраны мышечных клеток. Это вызывает открывание трансмембранных ионных каналов и деполяризацию клеточной мембраны (образование потенциала действия). Потенциал действия быстро распространяется по всем направлениям от нервно- мышечного соединения, возбуждая все мышечные клетки. В течение нескольких миллисекунд реализуется рассмотренный выше цикл сокращения мышечного волокна.

