
Государственное бюджетное образовательное учреждение
высшего профессионального образования
«Тихоокеанский государственный медицинский университет» Министерства здравоохранения России
Кафедра химии
Утверждено
на заседании кафедры
Протокол № ___ от ___________ 2013 года
Заведующая кафедрой_______________
_____________Иванова Н.С.
Методические рекомендации
по проведению самостоятельной работы студентов
модуль № 2 «Элементы химической термодинамики.
Элементы химической кинетики».
учебной дисциплины Химия
для специальности 060101 «Лечебное дело»
курс Ӏ семестр Ӏ
Составитель Иванова Н.С.
к.х.н., доцент, зав. кафедрой
Рецензент __________________
Владивосток, 2013
1.Тема занятия: Второе начало термодинамики и его применимость к биосистемам. Химическое равновесие
2.Мотивация изучения темы: термодинамическая оценка свойств веществ органической и неорганической природы, определяющая особенности их поведения и взаимосвязь в химических реакциях и процессах жизнедеятельности, позволяет решать теоретические и практические проблемы в
-
физиологии: оценка транспортной функции белков, дыхание, действие буферных систем в организме;
-
биохимии: каталитическое действие ферментов, процессы при их ингибировании и активации, действие коферментов НАД+ и НАДФ;
-
гистологии: изучение окислительно – восстановительного равновесия в ЭТЦ митохондрий;
-
клинических исследованиях: нарушение и коррекция равновесий, выполняющих основные функции в организме, - протолитического, гетерогенного, лигандообменного, окислительно - восстановительного;
-
практической деятельности врача: лечение ацидозов и алкалозов; болезней, связанных с нарушением гетерогенного равновесия (МКБ, подагра), металло – лигандного гомеостаза (хелатотерапия).
3.Цели самостоятельной работы студентов:
-
научиться прогнозировать направление химических и биохимических процессов;
-
обосновывать влияние различных факторов на сдвиг химического равновесия.
3.1.Общая цель: изучение темы направлено на формирование компетенции ПК – 3 по ФГОС специальности 060101 Лечебное дело.
3.2.Конкретные цели и задачи.
После изучения темы студент должен:
«знать» - ограничение Ӏ начала термодинамики, формулировки и математические выражения ӀӀ – ого начала; функции состояния «энтропия» и «энергия Гиббса» и их использование для прогнозирования направления процессов в изолированной и закрытой системах. Термодинамические условия равновесия в изолированной и закрытой системах. Константа химического равновесия. Уравнения изотермы и изобары химической реакции;
«уметь» - решать типовые и ситуационные задачи, опираясь на теоретические положения. Ориентироваться в справочных данных. Делать выводы по результатам расчёта;
«владеть» - навыками выявления экзэргонических и эндэргонических процессов и делать заключение о возможности протекания их в организме, опираясь на принцип энергетического сопряжения.
4.Контрольные вопросы.
-
Второе начало термодинамики (привести 2 – 3 определения ӀӀ – ого начала, показать статистическую природу ӀӀ – ого начала).
-
Энтропия (S) и энергия Гиббса (G) – критерии самопроизвольного протекания процесса. Их физический смысл и способы расчёта (дать классическое определение S, показать её статистическую природу, привести способы расчёта и значение S в самопроизвольном процессе, протекающем в изолированной системе. Физический смысл G показать, используя объединённый (Ӏ и ӀӀ) закон термодинамики (уравнение Гиббса). Привести способы расчёта энергии Гиббса и значения для самопроизвольных процессов).
-
Соотношение энтальпийного и энтропийного факторов и его связь с направлением реакции (дать анализ уравнения Гиббса).
-
Закон действующих масс для химического равновесия. Константа равновесия (Кравн), способы её выражения (показать, что Кравн. характеризует направление в обратимой реакции).
-
Связь ΔG и Кравн. Термодинамическое обоснование принципа Ле Шателье:
-
уравнение изотермы и его анализ;
-
уравнение изобары и его анализ.
6.Экзэргонические и эндэргонические реакции обмена. Принцип энергетического сопряжения.
5.Задания для самостоятельной работы студентов.
|
Вопросы для самостоятельного изучения |
Виды и содержание самостоятельной работы |
|
1.Второе начало термодинамики |
Для закрепления и систематизации знаний: - работа с конспектом лекции № 5, - работа с обязательной и дополнительной литературой, интернет – ресурсами. |
|
2.Энтропия (S) и энергия Гиббса (G) - критерии самопроизвольного протекания процесса. Их физический смысл и способы расчёта |
Для закрепления и систематизации знаний: - работа с конспектом лекции № 5; - работа с обязательной и дополнительной литературой, интернет – ресурсами; Тест № 1 Направление любой обратимой реакции корректнее всего определять по знаку: а) ΔΗ б) ΔS в) ΔG Тест № 2 Знак ΔS0 для реакции CaCO3(Т) ↔ CaO(Т) +СО2(г), протекающей в прямом направлении в изолированной системе,: а) отрицателен б) положителен в) определить невозможно Тест № 3 Самопроизвольное протекание метаболической реакции (СН2ОН)2СНОН+ а) возможно, т.к. ΔG<0 б) невозможно, т.к. ΔG<0 в) данных для определения направления реакции нет Для формирования умений: Задача № 1 Вычислите стандартное изменение энергии Гиббса окисления эталона в присутствии каталазы: Н2О2(ж)+С2Н5ОН(ж) ↔СН3СОН(г)+2Н2О(ж). Укажите направление процесса. Ответ: ΔG0= - 307 кДж/моль → Задача на 1– ое следствие из закона Гесса. Задача № 2 Вычислите стандартную энтропию реакции: 2NH2CH2COOH(T)↔NH2CH2-CONH-CH2-COOH(в)+Н2О(ж) Сделайте вывод о направлении реакции. Ответ:ΔS0=94Дж/моль· К → Задача на 1– ое следствие из закона Гесса. |
|
3.Соотношение энтальпийного и энтропийного факторов и его связь с направлением реакции |
Для закрепления и систематизации знаний: - работа с конспектом лекции № 5; - работа с обязательной и дополнительной литературой, интернет – ресурсами; Тест № 1 При стандартной температуре и давлении для реакции РСl5(г)↔ РСl3(г)+Сl2(г) ΔΗ>0, ΔS>0. Увеличения выхода РСl3 можно добиться: а) уменьшением температуры, увеличением давления; б) температура и давление не влияют на выход РСl3 в) увеличением температуры, понижением давления Тест № 2 Вероятность самопроизвольного протекания реакций 2Н2S(г)+SO2(г)→3S(T) + 2Н2O(г) ΔS>0 ΔΗ>0 при увеличении температуры: а) возрастает б) уменьшается в) температура не оказывает влияния Для формирования умений: Задача №1 Вычислите ΔG0 реакции гидратации β – лактоглобулина при 250С, для которой ΔΗ0= - 6,75кДж/моль, ΔS0= - 9,74Дж/моль·К Оцените вклад энтальпийного и энтропийного факторов. Ответ: ΔG0= -3,85кДж/моль Задача решается по уравнению Гиббса.
Задача № 2 Вычислите температуру, при которой равновероятны оба направления процесса: СО2(г)+С(т)↔2СО(г) ΔΗ0=173кДж/моль ΔS0=176Дж/моль·К Ответ:Т=983К Задача решается по уравнению Гиббса при условии, что ΔG0=0 |
|
4.Закон действующих масс для химического равновесия. Константа равновесия (Кравн.), способы её выражения. |
Для закрепления и систематизации знаний: - работа с конспектом лекции № 5; - работа с обязательной и дополнительной литературой, интернет – ресурсами. |
|
5.Связь ΔG и Кравн. Термодинамическое обоснование принципа Ле Шателье:
|
Для закрепления и систематизации знаний: - работа с конспектом лекции № 5; - работа с обязательной и дополнительной литературой, интернет – ресурсами. Для формирования умений: Задача № 1 Константа равновесия реакции тепловой денатурации химотрипсиногена при 500С равна 32,7. Вычислите значение ΔΗ0 процесса, если известно, что ΔS0равно 1,32 кДж/моль·К Ответ: ΔΗ0=417кДж/моль Для решения используется уравнение изотермы для стандартных условий и уравнение Гиббса Задача № 2 Константа равновесия реакции N2O4(г)↔2 NO2(г) при 250С равна 4,64 ·10-3 В каком направлении будет протекать реакция при следующих концентрациях веществ: а)С(NO2)=0,0107моль/л; С(N2O4)=0,0246моль/л б)С(NO2)=0,0095моль/л; С(N2O4)=0,046моль/л Ответ: а) Пс ~ Кс ↔ б)Пс<Кс → Задача решается сравнением численных величин Пс Кс в уравнении изотермы
Задача № 3 Для реакции 2NO2↔N2O4 константа равновесия при 298К равна 216. Рассчитайте константу равновесия при 460С. Стандартная энтальпия реакции равна – 57,4 кДж/моль. Ответ: К2=43,65 Задача решается по уравнению изобары реакции Задача № 4 Для реакции Н2О(г)+СО(г)↔СО2(г)+Н2(г) константы равновесия равны: при 8000С К1=2,87, при 10000С К2=1,39. Вычислите ΔΗ0 этой реакции: а) по уравнению изобары; б) по следствию из закона Гесса. Сделайте вывод. Ответ: а) ΔΗ0= -41,32кДж/моль б) ΔΗ0= -40,5кДж/моль |
|
6.Экзэргонические и эндэргонические реакции обмена. Принцип энергетического сопряжения. |
Для закрепления и систематизации знаний: - работа с конспектом лекции № 5; - работа с обязательной и дополнительной литературой, интернет – ресурсами; Тест № 1 Даны две метаболические реакции: С6Н12О6+НРО42- →С6Н11О6 – РО32-+Н2О ΔG>0 АТФ + Н2О→АДФ+НРО42- ΔG<0 Протекание первой реакции возможно за счёт: а) положительного значения ΔG б) высокой реакционной способности реагирующих веществ в) энергетического сопряжения со второй реакцией
|

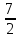 О2→3СО2+4Н2О
ΔG<0:
О2→3СО2+4Н2О
ΔG<0: