
complex_lection
.pdf
КОМПЛЕКСНЫЕ СОЕДИНЕНИЯ
Ионы металлов или нейтральные атомы способны к взаимодействию с простыми или сложными анионами (Сl−, Br−, I−, CN−, OH−, S2O3− и др.), а также с нейтральными молекулами (NH3, CO и др.) с образованием более слож-
ных ионов [Fe(CN)6]3−, [Ag(NH3)2]+, [HgI4]2− и др. или молекул [Fe(CO)5], [Ni(CO)4] и др. Такие сложные частицы получили название комплексных или координационных ионов, комплексных или координационных соединений.
Основополагающие представления о комплексных соединениях ввел в
науку швейцарский химик Альфред Вернер (1892 г.). В развитии химии комплексных соединений большую роль сыграли труды Л.А.Чугаева и его учеников.
В настоящее время нет общепризнанного определенного понятия «комплексное соединение». Это обусловлено разнообразием комплексных соединений и их характерных свойств. Наиболее приемлемо такое определение:
Сложное соединение, в узлах кристаллической решетки которой находится комплекс (сложная частица), способная к самостоятельному существованию в растворе или расплаве.
На примере комплексного иона [Fe(CN)6]3− рассмотрим его состав: [Fe(CN)6]3−
комплексообразователь |
лиганд |
координационное число |
Комплексообразователь – частица (атом, ион или молекула), обладающая электронно-акцепторными свойствами, которая координирует вокруг себя другие ионы или молекулы. Чаще всего комплексообразователем является электроположительный ион металла или неметалла, например [Cu(NH3)4]2+,
[ICl4] − .
Если комплексообразователь не имеет заряда, то его называют центральным атомом. Так, в тетракарбониле никеля [Ni(CO)4] беззарядный центральный атом никеля координирует четыре молекулы монооксида углерода.
Комплексообразователями могут быть почти все элементы периодической системы, даже инертные газы. Так, например, получен октафтороксенат (VI) цезия Сs2[XeF8], устойчивый при нагревании до 400°С.
Наиболее типичными комплексообразователями являются катионы d- металлов и некоторых металлов главных подгрупп (Al3+, Be2+). Ионы d- элементов имеют вакантные атомные орбитали валентного уровня (ns, np, (n−1)d), поэтому они проявляют ярко выраженные электронно-акцепторные свойства. Реже способность к комплексообразованию проявляется у р- и еще реже у s-элементов.
Лиганды – это частицы (ионы или молекулы), обладающие электроннодонорными свойствами и координируются вокруг комплексообразователя. Лигандами могут служить анионы Г−, ОН−, NO2−, CO32−, C2O42−, SCN−, CN−, Br−, Cl−, F− и др., нейтральные молекулы O2, NH3,H2O, NO, CO, N2H4, этилендиамин NH2-CH2-CH2-NH2 и др. и очень редко катионы (например, NO+).
Координационное число – это число химических связей между комплексообразователем и лигандами. Значение координационного числа комплексообразователя зависит от его природы, степени окисления, природы лигандов и условий (температура, природа растворителя, концентрация реагентов и др.), при которых протекает реакция комплексообразования. Известны комплексные соединения с координационными числами 2, 3, 4, 5, 6, 7, 8, 9, 12. Наиболее часто встречаются комплексообразователи с координационным числом 6, 4 и 2. Эти числа соответствуют наиболее симметричным геометрическим конфигурациям комплексных соединений: октаэдрической (6), квадратной или тетраэдрической (4), линейной (2).
Комплексообразователь и лиганды образуют внутреннюю сферу комплексного соединения, которая называется комплексом.
Ионы, нейтрализующие суммарный заряд ионов внутренней сферы и располагающиеся более отдаленно от комплексообразователя, образуют внешнюю сферу. В химических реакциях, в процессах растворения, в структуре кристалла комплекс выступает как самостоятельная единица. Структурные единицы внешней сферы, связанные в соединении менее прочно, в процессах растворения или в реакциях обмена отщепляются, образуя самостоятельные ионы:
[Co(NH3)6]Cl3 [Co(NH3)6]3+ + 3Cl−, K3[Fe(CN)6] 3K+ + [Fe(CN)6]3−.
Заряд комплексного иона равен алгебраической сумме зарядов комплексообразователя и лигандов и численно равен суммарному заряду внешней сферы с противоположным знаком. Например:
+1 +3 -1
K3[Fe(CN)6] (+1).3 + [(+3) + (-1) .6] = 0
Известно много комплексных соединений без внешней сферы, например, [Pt(NH3)2Cl4], [Fe(CO)5].
Если один лиганд соединен с комплексообразователем одной связью, то координационное число совпадает с числом лигандов, и такие лиганды называются монодентатными. Например, координационные числа комплексообразователей в [Fe(CN)6]3− и [Сu(NH3)4]2+ равны 6 и 4, а лиганды CN− и NH3 – монодентатны. Лиганд, образующий с комплексообразователем две связи, называется бидентатным. Например, C2O42− - оксалат-ион образует с медью комплексное соединение K2[Cu(C2O4)2]. Такие лиганды, как SO42− и CO32−, в зависимости от условий могут быть моно- и бидентатными. Oрганические молекулы, содержащие NR2− или СО2−− группы, могут также играть роль лигандов, поскольку они имеют неподеленную пару электронов. Особенный интерес представляют соединения, обладающие несколькими координирующими группами и способные обеспечивать связывание в определенном объеме пространства. Их называют полидентатными лигандами. Такие соединения образуют исключительно стабильные, так называемые, хелатные комплексы. Например, этилендиамин (еп) Н2N-СН2-СН2-NН2 с медью образует хелатный комплекс:

2+
H2C - H2N 
 NH2 - CH2
NH2 - CH2
Cu
H2C - H2N 
 NH2 - CH2
NH2 - CH2
Большинство реакций комплексообразования протекает в водных растворах. Вода сама является лигандом. В водных растворах все катионы существуют в виде аквакомплексов. Поэтому процесс образования комплексов, в сущности, является процессом замещения молекул воды в координационной оболочке комплексообразователя на другие молекулы или ионы. Например, процесс образования тетраамминмеди (II) можно представить следующим
образом:
[Cu(H2O)4]2+ + 4NH3 [Cu(NH3)4]2+ + 4H2O.
Обычно формулы молекул растворителя в химическом уравнении не записывают. Поэтому полную реакцию образования аммиачного комплекса чаще
всего пишут как присоединение четырех молекул аммиака к двухзарядному иону Cu2+:
Cu2+ + 4NH3 [Cu(NH3)4]2+.
Классификация комплексных соединений. Существует несколько ти-
пов классификаций комплексных соединений. Здесь приведены три из них. 1. По принадлежности к определенному классу соединений:
Комплексные кислоты – H2[SiF6], H[AuCl4]; Комплексные основания – [Ag (NH3)2]OH;
Комплексные соли – K2[HgI4], [Cr(H2O)6]Cl3. 2. По природе лигандов:
аквакомплексные соединения (гидраты) − [Co(H2O)6]SO4, [Cu(H2O)4]Cl 2; аммиачные комплексные соединения (аммиакаты) − Ag[(NH3)2]Cl; гидроксо-комплексные соединения – Na[Al(OH)4], K3[Cr(OH)6];
ацидо-комплексные соединения − K2[SiF6], Na[AuCl4], K3[Fe(CN)6];
карбонильные комплексные соединения (карбонилы) – [Fe(CO)5], [Ni(CO)4]; cмешанные комплексные соединения – [PtCl3(H2O)2(NH3)2](NO3)2.
3. По знаку заряда комплекса:
катионные комплексные соединения – [Co(NH3)6]Cl3, [Zn(NH3)4]Cl2; анионные комплексные соединения – Li[AlH4], K2[Be(CO3)2]; нейтральные комплексные соединения – [Pt(NH3)2Cl2], [Co(NH3)3Cl3]; катионно-анионные комплексные соединения – [Ni(NH3)6][Fe(CN)6].
Номенклатура комплексных соединений. Названия комплексных со-
единений строятся по общим правилам систематической номенклатуры – справа налево. Первым в именительном падеже называется анион, а затем в родительном падеже катион. При названии комплексного иона сначала указывают лиганды, а затем комплексообразователь.
Нейтральные лиганды указывают названиями соответствующих молекул, кроме воды и аммиака, которые соответственно называют «аква» и «аммин». К анионным лигандам прибавляют окончание «о» (хлоро, сульфато). Число
лигандов, если их больше одного, указывают греческими числительными: ди, три-, тетра-, пента-, гекса-, гепта-, окта-, нона-, дека- и.т.д.
Если комплексообразователь – катион, то используют русское название элемента и указывают его степень окисления (в скобках римской цифрой). Если комплексообразователь – анион, то используют латинское название элемента, к которому прибавляют окончание «ат», и указывают римской цифрой в скобках степень окисления комплексообразователя. У нейтральных комплексов (без внешней сферы) комплексообразователь называют в именительном падеже, а его заряд не указывают. Примеры названий комплексных соединений:
K3[Fe(CN)6] – гексацианоферрат (III) калия; K4[Fe(CN)6] − гексацианоферрат (II) калия; K2[PtCl6] – гексахлороплатинат (IV) калия; K2[Be(CO3)2] – дикарбонатоберрилат калия [Pt(NH3)6]Cl4 – хлорид гексаамминплатины (IV); [Pt(NH3)2Cl4] – тетрахлородиамминплатина (IV).
Устойчивость комплексных соединений. В растворах комплексные со-
ли, кислоты и основания ведут себя как простые соли, кислоты и основания. Они диссоциируют как сильные электролиты на комплексный ион и на ионы внешней сферы:
[Cu(NH3)4](OH)2 [Cu(NH3)4]2+ + 2OH−.
Для их растворов характерны все свойства, присущие растворам электролитов: электропроводимость, повышение температуры кипения, понижение температуры замерзания, понижение давления насыщенного пара растворителя над раствором, наличие осмотического давления и другие. Образующиеся при растворении комплексных солей, кислот и оснований комплексные ионы подвергаются ступенчатой диссоциации как слабые электролиты.
Так, ион [Fe(CN)6]4− далее диссоциирует по ступеням:
[Fe(CN)6]4− [Fe(CN)5]3− + CN−,
[Fe(CN)5]3− [Fe(CN)4]2− + CN− и.т.д.
Прочность комплексного иона характеризуется константой диссоциации, называемой константой нестойкости комплексного иона. Так ион [Fe(CN)6]4− диссоциирует по ступеням, каждая из которых описывается определенным значением константы диссоциации Кн1, Кн2, Кн3 и.т.д. Общая константа не-
стойкости равна произведению |
ступенчатых |
констант нестойкости: |
||
Kн = Кн1, Кн2, Кн3 ….Kнn. |
|
[Fe2+][CN−]6 |
||
|
|
|||
[Fe(CN)6]4− Fe2+ + 6CN−, |
Kн = |
|
|
= 1.10−24 . |
|
|
|||
|
|
[[Fe(CN)6]4−] |
||
Константа нестойкости – это мера прочности комплексного иона. Если ее значения малы, комплексы являются прочными, если велики, то нестойкими. Иногда вместо констант нестойкости пользуются обратными их величинами
– константами устойчивости, относящимися к процессу образования комплексного иона: Кн = 1/Куст .

Комплексные ионы могут быть разрушены в соответствии с принципом Ле-Шателье. Если в раствор комплексного соединения ввести ионы, которые образуют с продуктами его диссоциации соединения с очень малыми произведениями растворимости (ПР), комплекс разрушится:
[Cu(NH3)4]2+ + S2− CuS↓ + 4NH3. |
|
Кн = 2,14.10−13 |
ПР = 6,3.10−36 |
Комплексные ионы могут также разрушаться веществами, образующими с ионом комплексообразователем другие, более прочные соединения:
[Fe(SCN)6]3− + 6F− [FeF6]3− + 6SCN−. |
|
Кн = 2,9.10−5 |
Кн = 8,3.10−17 |
За реакциями комплексных соединений легко наблюдать по изменению цвета растворов, так как большинство из них ярко окрашены.
Изомерия комплексных соединений. Это явление наблюдается, когда состав комплексов остается одинаковым, в то время как их структура различна, поэтому они отличаются по свойствам. Способность к изомерии в значительной мере расширяет свойства этих соединений и возможности их использования. Существует несколько видов изомерии.
Сольватная (в частности гидратная) изомерия обнаруживается в отдель-
ных изомерах, когда распределение молекул воды между внутренней и внешней сферами оказывается неодинаковым. Например, для хлоридов гек-
сааквахрома (III) известны три изомера: |
|
|
[Cr(H2O)6]Cl3; |
[Cr(H2O)5Cl]Cl2.H2O; |
[Cr(H2O)4Cl2]Cl.2H2O. |
фиолетовый |
светло-эеленый |
темно-зеленый |
Ионизационная изомерия связана с различной легкостью диссоциации ионов из внутренней во внешнюю сферу комплекса. Например:
[Pt(NH3)4Cl2]Br2 и [Pt(NH3)4Br2]Cl2.
Первая соль дает желтый осадок с раствором AgNO3. Вторая реагирует с раствором нитрата серебра с образованием белого творожистого осадка AgCl.
Пространственная (геометрическая) изомерия обусловлена тем, что одинаковые лиганды располагаются вокруг комплексообразователя либо рядом (цис-положение), либо напротив (транс-положение).
Сl |
NH3 |
NH3 |
Cl |
|
Pt |
Pt |
|
Cl |
NH3 |
Cl |
NH3 |
цис-изомер (оранжевые кристаллы) |
транс-изомер |
(желтые кристаллы) |
|
Существуют и другие виды изомерии.
Химическая связь в комплексных соединениях
Между комплексообразователем и лигандами осуществляется ковалентная связь. Например, в комплексном ионе [Fe(CN)6]3− железо, сохраняя свою стехиометрическую валентность (III), за счет вакантных 3d-орбиталей проявляет способность к донорно-акцепторному взаимодействию c группами CN−. Лиганды, как правило, не связаны друг с другом, так как между ними действуют силы отталкивания. Природа связи между внутренней и внешней сфе-
рой ионная, т.е. аналогична природе связи между катионами и анионами в простых солях. Поэтому комплексные соединения в водных растворах являются сильными электролитами.Существует несколько моделей представления химической связи в комплексных соединениях.
Электростатическая теория (Коссель и Магнус, 1916−1922гг.). Со-
гласно этой теории взаимодействие между комплексообразователем и ионными (или полярными) лигандами подчиняется закону Кулона. Поэтому:
•устойчивый комплекс получается, когда силы притяжения к ядру комплекса уравновешивают силы отталкивания между лигандами;
•прочность комплекса увеличивается с ростом заряда и уменьшением ра-
диусов комплексообразователя и лигандов. Например: для галогенидных комплексов алюминия [AlГ4]− устойчивость убывает в направлении от фторокомплекса к йодокомплексу, так как в этом ряду закономерно увеличивается размер лигандов;
•устойчивость комплексов с одними и теми же лигандами в более высокой
степени окисления комплексоообразователя всегда выше, например для
[Cu+(NH3)2]+ Кн = 10−11, а для [Cu2+(NH3)2]2+ Кн = 10−13;
•координационное число в комплексе с ионными лигандами меньше, чем в комплексе с дипольными молекулами, так как силы отталкивания между
ионами больше, чем между нейтральными лигандами. С ионными лигандами Co2+ дает комплексы с КЧ = 4, тогда как с дипольными молекулами
координационное число возрастает до шести: [Co(C2O4)2]2− и [Co(CNS)4]2−,
но [Co(H2O)6]2+ и [Co(NH3)6]2+.
Недостатки электростатической теории заключаются в невозможности
объяснить целый ряд факторов. Например: существование карбонилов [Fe(CO)5], т.е. комплексов с неполярными лигандами и комплексообразователем в нулевой степени окисления, магнитные и оптические свойства соединений.
Метод валентных связей (ВС). Метод разработан Полингом в 30-х годах
XXстолетия. В его основе лежат следующие положения.
1.Связь между комплексообразователем и лигандами донорноакцепторная. Лиганды являются донорами электронных пар, а комплексообразователь – акцептором электронных пар. (т.е. предоставляет свободные орбитали). Мерой прочности связи служит степень перекрывания орбиталей.
2.Орбитали центрального атома, участвующие в образовании связей, подвергаются гибридизации. Тип гибридизации определяется числом, природой и электронной структурой лигандов. Гибридизация электронных орбиталей комплексообразователя определяет геометрию комплекса.
3.Наряду с σ-связями между комплексообразователем и лигандами могут образовываться дополнительные π-связи (дативные связи). Это происходит, если орбиталь центрального атома, занятая электронами, перекрывается
свакантной орбиталью лиганда. Этим обусловлена дополнительная прочность комплекса.
4. Магнитные свойства объясняются исходя из заселенности орбиталей электронами. При наличии неспаренных электронов комплекс парамагнитен. Спаренные электроны обусловливают диамагнитные свойства комплекса.
Донорно-акцепторное взаимодействие комплексообразователя и лигандов при образовании комплексов может происходить следующим образом.
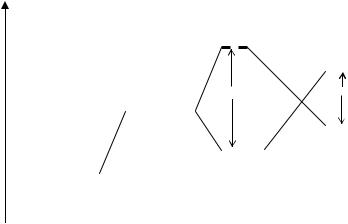
У комплексообразователя в процессе гибридизации изменяется энергия отдельных АО, вакантные АО приобретают большую энергию, а энергия заселенных электронами d-АО понижается и в гибридизации эти АО не участвуют. Число вакантных гибридных орбиталей соответствует координационному числу комплексообразователя. Каждому виду гибридизации отвечает своя структура комплекса. Например, ион [BeF4]2− имеет тетраэдрическую форму из-за sp3 гибридизации свободных 2s и 2р-орбиталей иона Be2+, которые, в свою очередь, являются акцепторами четырех электронных пар, пре-
доставляемых фторид-ионами. |
|
|
|
|
|
|
|
|
|||||||||
E |
2s 2p |
|
|
F |
F |
|
2− |
||||||||||
Be2+ + 4:F− → |
|
|
|
||||||||||||||
|
|
|
Be2+ |
|
|
|
|
|
|
|
Be |
|
|
||||
|
|
|
|
|
|
|
|||||||||||
Be0 |
|
|
|
|
|
|
|
F |
F |
|
|
||||||
|
|
|
|
|
|
|
|||||||||||
2s22p0 2p0 |
|
|
|
|
|
|
sp3 |
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
2s2 |
F− F− F− F− |
|
|
|
|
|
|
|
|
||||||||
Распределение электронов на d-орбиталях комплексообразователя может оставаться таким же, как у изолированного иона или неспаренные электроны комплексообразователя могут объединяться в пары, освобождая АО для электронных пар лигандов. Например, при взаимодействии иона хрома с молекулами воды и кобальта с фторид-ионами образуются октаэдрические комплексные ионы [Cr(H2O)6]3+ и [СoF6]3− , где хром и кобальт сохранили электронную структуру катиона, в отличие от [Сo(NH3)6]3+, где аммиак является лигандом сильного поля.
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
[Cr(H2O)6]3+ |
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
Cr0 |
E |
|
|
|
|
|
|
|
|
|
Cr3+ |
|
3d |
|
|
4s |
4p |
|
|
|
|
|
|
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
4s13d5 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
d2sp3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
3d |
[СoF6]3− |
|
|
|
|
4p |
|
|
|
4d |
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
4s |
|
|
|
|
|
|
|
|||||||||
|
E |
|
|
|
|
|
|
|
|
|
|
Сo3+ |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
Co0 |
4d |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
sp3d2 |
|
|
|
|
|
|
|||
|
4p |
|
|
|
|
|
|
|
|
|
|
Сo3+ |
|
|
|
|
|
[Сo(NH3)6]3+ |
|
|
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||
|
4s |
|
|
|
|
|
|
|
|
|
|
|
3d |
|
|
|
4s |
|
|
4p |
|
|
4d |
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
d2sp |
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
Таким образом гибридизация может осуществляться как за счет внутренних (n−1)d-орбиталей ([Cr(H2O)6]3+, [Сo(NH3)6]3+), так и за счет внешних
nd-орбиталей ([СoF6]3−). Во втором случае степень перекрывания электронных облаков меньше из-за большей удаленности 4d-орбиталей и связь лигандов с комплексообразователем слабее, чем при внутренней гибридизации с (n−1)d-орбиталями. Соответственно, устойчивость [СoF6]3− меньше, а реакционная способность выше, чем у [Сo(NH3)6]3+.
Электронные структуры комплексов отражают их магнитные свойства. Так Cr(H2O)6]3+ и [СoF6]3− обладают диамагнитными свойствами, в то время как [Сo(NH3)6]3+ − парамагнитен.
Недостатки метода валентных связей:
•пригоден для описания только ограниченного круга веществ; комплексные соединения с многоцентровыми связями этот метод не рассматривает;
•не объясняет оптические свойства комплексных соединений, так как не учитывает возбужденные состояния
Теория кристаллического поля (ТКП). Эта теория была применена для объяснения свойств кристаллических веществ и является дальнейшим развитием теории Косселя и Магнуса.
Основные положения теории кристаллического поля:
•химическая связь М-L во внутренней сфере комплекса является либо ионной, либо ион-дипольной;
•лиганды располагаются вокруг комплексообразователя в вершинах правильных многогранников (полиэдров) в виде точечных, неподвижно закрепленных зарядов; реальный объем лигандов, их структура и электронная конфигурация во внимание не принимаются;
•лиганды, как точечные отрицательные заряды, создают вокруг комплексообразователя электростатическое поле, в котором d-подуровни комплексообразователя расщепляются по энергии и становятся неравноценными; р-подуровни расщеплению не подвергаются;
•энергия новых подуровней, их число и взаимное расположение зависят от
симметрии полиэдра, от симметрии расположения лигандов (октаэдрическое, тетраэдрическое и др.)
Пять d-орбиталей по-разному располагаются в пространстве относительно атомного ядра. Электронная плотность орбиталей dz2 и dx2-y2 сконцентрирована вдоль координатных осей, тогда как орбитали dxy, dxz, dyz расположены по биссектрисам между осями. В свободном атоме или ионе все пять d- орбиталей одного и того же уровня имеют одинаковую энергию, т.е., они вырождены. Если ион попадает в несимметричное поле (тетраэдр, октаэдр или другое), то электроны пяти d-орбиталей испытывают различное отталкивание со стороны отрицательно заряженных лигандов. И энергия всех пяти внешних d-орбиталей увеличивается, но для орбиталей разной ориентации это увеличение неодинаково. Когда координационное число равно шести и комплексообразователь находится в октаэдрическом окружении, энергия dx2-y2 и
dz2 орбиталей увеличивается в большей степени, чем остальных трех. В тетраэдрическом окружении все наоборот, т.е. энергия трех орбиталей dxy, dxz, dyz увеличивается в большей степени, чем остальных двух, т.е., наблюдается другое энергетическое расщепление.
Энергетическая разность d-орбиталей ( ) называется энергией расщепления. Величина зависит от конфигурации комплекса, природы лиганда и природы комплексообразователя. Из рисунка видно, что разным пространственным конфигурациям комплекса соответствует разная энергия расщепле-
ния.
Е
dz2 dx2-y2
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
dxy dxz dyz |
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
d |
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
окт |
|
|
|
4/9 окт |
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
d |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
dz2 dx2-y2 |
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
dxy |
dxz dyz |
|
|
|
|
|
|
|
|
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Свободный |
Ион в симмет- |
Ион в окта- |
Ион в тетра- |
||||||||||||||||||||||||||||||||
ион |
ричном сфери- |
эдрическом |
эдрическом |
||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
ческом поле |
поле |
поле |
||||||||||||||||||||||
При одном и том же центральном ионе и одинаковой конфигурации комплексов значение тем больше, чем сильнее поле, создаваемое лигандами.
По способности вызвать расщепление d-подуровня лиганды можно расположить в следующий ряд, называемый спектрохимическим, так как был найден в результате экспериментального исследования спектров комплексов и
квантово-механических расчетов:
СO, CN− > NO2−> NH3 > NCS− > H2O > OH− > F− > Cl− > Br− > I−.
Распределение электронов комплексообразователя по расщепленным энергетическим уровням в слабом поле подчиняется общим правилам, а именно: первоочередного заполнения наиболее низких уровней, правилу Хунда, принципу Паули.
В сильных полях при достаточном числе электронов происходит полное заполнение орбиталей с низкой энергией сначала по одному, а затем по два электрона на каждой орбитали (спаривание). Лишь после этого начинают заполняться электронные орбитали с высокой энергией.
Заселение электронами орбиталей зависит от соотношения между величинами энергий расщепления ( ) и спаривания (Есп). При < Есп (слабое поле) электроны будут занимать разные орбитали и спины их параллельны. В этом случае комплекс называется высокоспиновым. При > Есп (сильное поле) электроны спариваются на d-орбиталях с низкой энергией, в результате образуются низкоспиновые комплексы.
Распределение d-электронов по орбиталям иона Сo3+ в октаэдрических комплексах [CoF6]3− и [Co(NH3)6]3+ показано ниже.
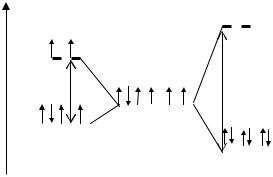
Таким образом, в поле ионов F− значение невелико. Поэтому число неспаренных электронов на орбиталях расщепленных уровней Co3+ такое же, как и в свободном ионе. Но в сильном поле, создаваемом молекулами NH3, энергия расщепления большая, и энергетически более выгодно, когда d- электроны иона Co3+ располагаются только на нижних d-орбиталях.
Е
= 2,1эВ |
|
|
|
|
|
|
|
|
|
|
|
|
= 2,8 эВ |
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Высоко- |
Ион Co3+(d6) |
Низко- |
спиновый |
в симметрич- |
спиновый |
комплекс |
ном сферичес- |
комплекс |
[CoF6]3− |
ком поле |
[Co(NH3)6]3+ |
В соответствии с распределением электронов комплекс [CoF6]3− диамагнитен, а комплекс [Co(NH3)6]3+ − парамагнитен.
Окраска комплексов объясняется тем фактом, что происходит переход электронов с более низкого на более высокий энергетический уровень, который осуществляется за счет поглощения квантов видимого света. Из приведенного выше рисунка видно, что комплексы [CoF6]3− и [Co(NH3)6]3+ окрашены, так как есть возможность в таких переходах, в то время как в комплексах, где комплексообразователь имеет полностью заполненный d-подуровень (Zn, Cd) возможности в таких переходах отсутствуюи и комплексы, соответственно, не окрашены. Например, Na2[Zn(OH)4].
Недостатки теории кристалличекого поля:
•может быть использована только к комплексообразователям (d- элементам), имеющим свободные электроны;
•не учитывает структурные особенности лигандов и склонности некоторых из них образовывать π-связи;
•не учитывает частично ковалентный характер связи комплексообразователь – лиганд.
