
Теоретическая часть
Современная теория строения атома развивалась на основе многочисленных экспериментальных исследований излучения и поглощения лучистой энергии атомами, а так же взаимодействия между атомами и элементарными частицами.
В 1911 г. на основании изучения закономерностей рассеяния частиц при облучении тонких металлических пластинок Резерфордом было показано, что почти вся масса атома сосредоточена в ядре, имеющем размеры порядка 10 –12 см, вокруг которого движутся электроны. Объем атома определяется объемом области, занимаемой электронами, размеры которой по порядку величины равны 10-9 см.
Дальнейшие исследования, проведенные сотрудниками Резерфорда, показали, что ядро имеет положительный заряд + еz, где z – номер атома рассеивающего вещества в периодической системе элементов Менделеева, е – электрический заряд, равный по абсолютной величине заряду электрона. Так как атом в обычном состоянии электрически нейтрален, то число электронов, компенсирующих положительный заряд, также равняется порядковому номеру элемента.
На основании этих исследований была предложена модель атома, получившая название модели Резерфорда или планетарной модели.
Второе название обусловлено тем, что поведение электронов в кулоновском поле ядра согласно законам классической механики сходно с поведением планет в поле притяжения Солнца. В обоих случаях сила притяжения обратно пропорциональна квадрату расстояния между притягивающимися телами. Замкнутой траекторией движения в общем случае будет эллипс.
Отличие атомной задачи состоит в том, что электрон, как и всякая заряженная частица, двигающаяся с ускорением, согласно классическим законам электродинамики, должен излучать электромагнитные волны. В случае периодического движения заряда частота, излучаемой им волны, равна частоте периодического движения электрона. Излучение должно привести к непрерывному уменьшению энергии электрона, поэтому эллиптическая траектория в действительности не может сохраниться, а должна превратиться в спираль, заканчивающуюся падением электрона на ядро. Такое движение по спирали должно было бы происходить с непрерывно изменяющейся частотой обращения в течение времени порядка10-8 с и приводить к излучению, имеющему сплошной (непрерывный) спектр.
Итак, по классическим законам, атом Резерфорда должен быть неустойчив и в течение краткого времени своего существования излучать непрерывный спектр. Все это находится в резком противоречии с наблюдаемыми линейчатыми спектрами атомов и с тем фактом, что атом представляет собой устойчивое образование, существующее сколь угодно долгое время.
Таким образом, законы классической физики в применении к модели Резерфорда, основанной на бесспорных экспериментальных фактах, приводят к следствиям, которые находятся в противоречии с экспериментом.
Для разрешения этих противоречий необходимо было отказаться от классической теории атома. Временным компромиссным решением задачи являлась теория, начало которой было положено в 1912 г
Н. Бором.
Исходя из теории световых квантов, предложенной Планком, и опытных данных о свойствах атома, Бор положил в основу своей теории два постулата.
-
Атомы могут длительно пребывать только в определенных состояниях, которые называются стационарными состояниями. Значение энергии в стационарных состояниях представляет дискретный ряд. Находясь в стационарных состояниях, атомы не излучают и не поглощают электромагнитные волны.
-
Переход из одного стационарного состояния в другое может осуществляться путем скачкообразного, а не непрерывного изменения энергии атома. При таком переходе атом излучает или поглощает энергию определенными порциями – квантами, энергия которых :
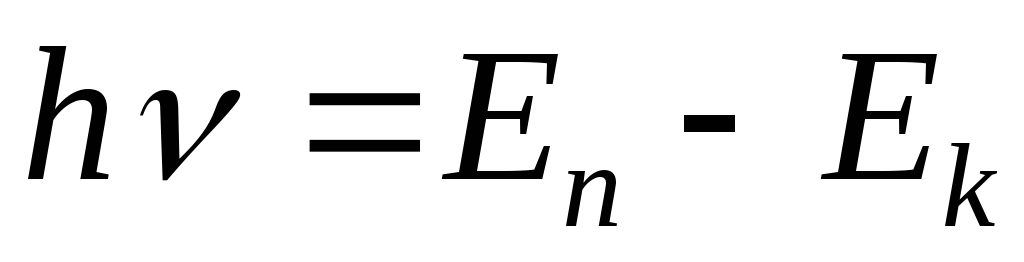 ,
(7.1)
,
(7.1)
где h – постоянная
Планка,
![]() - частота излученной или поглощенной
электромагнитной волны, Еn,Ek
– значения энергии в соответствующих
стационарных состояниях.
- частота излученной или поглощенной
электромагнитной волны, Еn,Ek
– значения энергии в соответствующих
стационарных состояниях.
Возможность перехода атомов только
между вполне определенными стационарными
состояниями приводит к наличию дискретного
(линейчатого) спектра частот излучения
и поглощения энергии атомами:
![]() .
.
Предполагая в развитии модели атома,
что стационарные состояния осуществляются
в форме движения электронов по круговой
орбите, Бор сформулировал условие отбора
стационарных состояний в виде
математического дополнительного
требования, налагаемого на кинетические
характеристики движения. Согласно этому
условию стационарны такие состояния,
для которых момент количества движения
электрона оказывается кратным величине
![]() :
:
![]() ,
(7.2)
,
(7.2)
где n = 1,2,3… - квантовое
число, m0 – масса
электрона,
![]() - скорость его движения по орбите, r
– радиус орбиты. Приняв это условие для
одноэлектронного атома с зарядом ядра
еz, и, пользуясь далее
законами классической механики, можно
выразить радиусы орбит и скорости
движения электрона через квантовое
число n и постоянные
h, е, m0,
z. Действительно, добавив
к формуле (7.2) уравнение, выражающее
равенство центростремительной силы
силе кулоновского притяжения электрона
к ядру
- скорость его движения по орбите, r
– радиус орбиты. Приняв это условие для
одноэлектронного атома с зарядом ядра
еz, и, пользуясь далее
законами классической механики, можно
выразить радиусы орбит и скорости
движения электрона через квантовое
число n и постоянные
h, е, m0,
z. Действительно, добавив
к формуле (7.2) уравнение, выражающее
равенство центростремительной силы
силе кулоновского притяжения электрона
к ядру
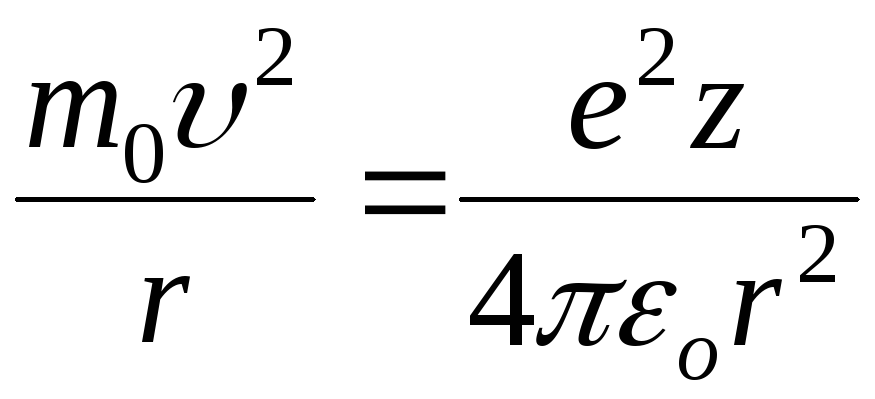 ,
,
получим:
![]() ;
;
 .
.
Потенциальная энергия кулоновского взаимодействия электрона и ядра с зарядом еz выражается формулой:
![]() ,
,
где отрицательный знак характеризует
тот факт, что взаимодействие носит
характер притяжения. Полная энергия
на n – той орбите
будет равна: 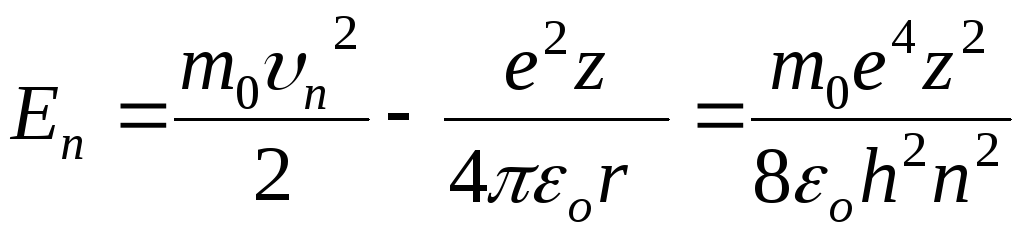 .
.
Переход атома из состояния с большей энергией в состояние с меньшей энергией, т.е. переход электрона с орбиты более удаленной на менее удаленную, сопровождается согласно второму постулату Бора излучением кванта энергии с частотой:
 .
(7.3)
.
(7.3)
Эта формула идентична известной ранее эмпирической формуле для водорода (z = 1):
![]() или
или
![]() .
(7.4)
.
(7.4)
Здесь R – постоянная Ридберга, с – скорость света.
Нетрудно видеть, что эта формула совпадает с формулой (7.3), если положить
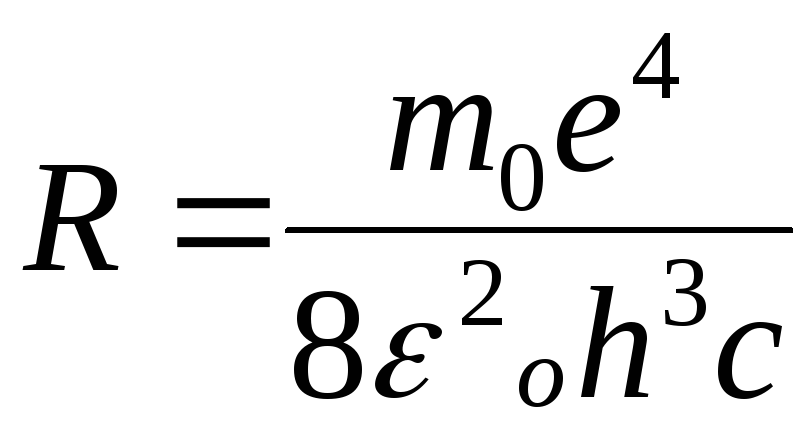 (7.5)
(7.5)
Вычисленное по формуле (7.5) значение R действительно полностью совпало с опытным значением, что и явилось главным доводом в пользу теории Бора. Числа n и к приобретают теперь вполне определенный физический смысл: n – номер энергетического уровня, с которого переходит электрон, к – номер уровня, на который переходит электрон. При переходе с уровней n = к +1, к + 2, к + 3, … на к – тый уровень, для атома водорода формула (7.3) дает серию спектральных линий, получивших экспериментальное подтверждение. Эти серии были обнаружены для к = 1- Лайманом, к = 2 – Бальмером, к = 3 – Пашеном,
к = 4 – Бреккетом, к = 5 – Пфундом, к = 6 – Хемпфри и носят соответственно их имена (см. рис. 7.1)
Серия Лаймана лежит в ультрафиолетовой области спектра, Бальмера – в видимой, остальные серии лежат в инфракрасной области спектра.
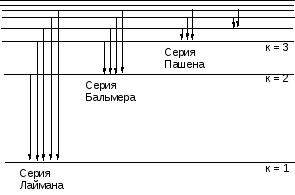
Рис. 7.1
В настоящей работе изучается серия Бальмера. Величины n для первых четырех линий, лежащих в видимой области, принимают значения 3,4,5,6. Название линий принято обозначать соответственно символами Нα, Нβ, Нγ, Нδ.
