
- •Содержание
- •Глава 1. Медь – простое вещество
- •§1. Электронное строение. Степени окисления.
- •§2. Нахождение в природе. Месторождения.
- •§3. Физические свойства меди.
- •§4. Сплавы меди.
- •Глава 2. Химические свойства меди и ее соединений
- •Глава 3. Получение меди. Применение меди. Биологическая роль.
- •§1. Получение меди.
- •§2. Применение меди.
- •§3. Биологическая роль меди.
- •Использованная литература
Глава 1. Медь – простое вещество
§1. Электронное строение. Степени окисления.
Медь — элемент первой группы побочной подгруппы четвёртого периода периодической системы химических элементов Д. И. Менделеева, с атомным номером 29. Обозначается символом Cu (лат. Cuprum).
Электронное строение атома: 1s22s22p63s23p63d104s1. Подобно атомам щелочных металлов, атомы меди имеют в наружном слое один электрон, но в отличие от атомов щелочных металлов, предпоследний электронный слой содержит восемнадцать электронов. Медь – предпоследний член первой декады d-элементов. Поэтому у меди наблюдается так называемый «провал электрона» - конфигурация наружного электронного слоя 3d104s1 устойчивее, чем 3d94s2.
|
Элемент |
Радиус атома, нм |
Энергия ионизации Э0→Э +, эВ |
Радиус иона Э+, нм |
Стандартный электродный потенциал процесса Э++e-→Э0, эВ |
|
K |
0.236 |
4.18 |
0.149 |
-2.925 |
|
Cu |
0.128 |
7.73 |
0.098 |
+0.52 |
Сравнивая медь с металлом главной подгруппы того же периода - калием, можно видеть, что радиус атома и иона меди почти в два раза меньше соответственно атома и иона калия. Это обуславливает значительно бóльшую плотность, высокие температуры плавления, так как меньшие по размеру атомы располагаются в кристаллической решетке более плотно, вследствие чего силы притяжения между ними велики.
Малый радиус объясняет так же более высокие значения энергии ионизации меди, чем калия. Это приводит к большим различиям в химических свойствах этих металлов одного периода и одной группы. Медь – малоактивный металл, в ряду напряжений стоит после водорода, в отличие от калия – одного из самых активных металлов. В то же время, восмнедцатиэлектронный наружный слой, устойчивый у других элементов, здесь еще не вполне стабилизируется, и способен к частичной потере электронов. Так, медь, наряду с однозарядными катионами образует и двухзарядные, которые для нее наиболее характерны. Так же известны соединения со степенью окисления +3 в составе анионов или в комплексных соединений.
§2. Нахождение в природе. Месторождения.
Металлы подгруппы меди обладают небольшой химической активностью, поэтому они находятся частично в виде химических соединений, а частично в свободном виде, особенно золото.
Медь
в далекие геологические эпохи, очевидно,
находилась только в виде сернистых
соединений – халькопирита
 (или
(или )
и халькозина
)
и халькозина .
Объясняется это тем, что медь обладает
довольно большим химическим сродством
к сере, в настоящее время сульфиды –
наиболее распространенные минералы
меди. При высоких температурах, например,
в районах вулканической деятельности,
под действием избытка кислорода
происходило превращение сульфидов меди
в окислы, например:
.
Объясняется это тем, что медь обладает
довольно большим химическим сродством
к сере, в настоящее время сульфиды –
наиболее распространенные минералы
меди. При высоких температурах, например,
в районах вулканической деятельности,
под действием избытка кислорода
происходило превращение сульфидов меди
в окислы, например:

При температуре ниже 10000C происходило образование окиси меди, которая в небольших количествах встречается в природе:
 .
.
Самородная (металлическая) медь, очевидно, возникла в природе при сильном нагревании частично окисленных сернистых руд. Можно представить, что после землетрясений, грандиозных извержений окисленные минералы меди были погребены под толстым слоем горных пород и нагревались за счет земного тепла. При этом происходило взаимодействие окислов с сульфидами:
 .
.
Подобные процессы протекают при выплавке меди на металлургических заводах. Такие природные “металлургические заводы” выплавляют громадные количества меди: самый крупный из найденных самородков весил 420 т. По-видимому, в меньших масштабах взаимодействие окислов некоторых металлов с сульфидами идет и в настоящее время, например, в районе некоторых Курильских островов.
Некоторые другие минералы меди получились из окисных руд. Например, под действием влаги и двуокиси углерода происходила гидратация окиси меди и образование основных карбонатов:
 .
.
В лаборатории мы эти процессы не наблюдаем, так как они идут медленно. В “лаборатории” природы сроки в несколько тысяч лет совершенно незначительны. В дальнейшем под влиянием давления вышележащих горных пород и некоторого нагревания происходило уплотнение основного карбоната меди, и он превратился в изумительный по красоте минерал – малахит. Особенно красив полированный малахит. Он бывает окрашен от светло-зеленого до темно-зеленого цвета. Переходы оттенков причудливы и создают фантастический рисунок на поверхности камня.
Переход нерастворимых сульфидных соединений меди в раствор мог осуществляться за счет взаимодействия растворов сульфата железа (III):
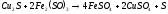 .
.
Растворы сульфата железа, как указано выше, получаются в природе при действии воды, насыщенной кислородом, на пирит. Эти процессы медленно идут в природе и в настоящее время. [1, с.8-10]
Медь входит более чем в 198 минералов, из которых для промышленности важны лишь 17. Для производства меди наибольшее значение имеют халькопирит (он же – медный колчедан) CuFeS2, халькозин (медный блеск) Cu2S, ковеллин CuS, борнит (пестрая медная руда) Cu5FeS4. Иногда встречается и самородная медь. Распространение меди в земной коре –4,7*103% по массе (1015 - 1016 тонн). [3]
Соединения меди распределены в земной коре неравномерно, что объясняется различием в геологических условиях, сложившихся в различных местах земного шара. Богатейшие месторождения меди имеются в Конго (Катангский пояс). Материалы, собранные археологами о древнейших месторождениях датируются тысячелетиями до новой эры. Древнейшие выработки меди на территории нашей страны найдены в Закавказье, на побережье Балхаша, в многочисленных пунктах Сибири.
Планомерные поиски месторождений меди начинаются при Иване III, Иване Грозном и особенно при Петре I. При Иване Грозном в Олонецкий уезд был послан новгородский гость (купец) Семен Гаврилов “для сыску медные руды”, где она и была найдена. В 1652 г. Казанский воевода сообщил царю: “Медные руды… сыскано много и заводы к медному делу заводим”. [2, с.26] Из документов следует, что с 1562 по 1664 г. было послано из “Казани к Москве чистыя меди 4641 пуд. 6 гривенков”. В 1702 г. стала выходить первая русская газета “Ведомости”, которую, очевидно, редактировал Петр I. 2 января 1703 г. в ней писали: “Из Казани пишут. На реке Соку нашли много нефти и медной руды, из той руды меди выплавили изрядно, отчего чают не малую прибыль Московскому государству”. [2, с.27]
В начале этого столетия главнейшими месторождениями, которые разрабатывались, были: в районе Северного Урала – Богословский завод, в районе Нижнего Тагила – Выйский завод, а на Кавказе – Калакентский и Кедабекский заводы.
В наше время известны месторождения меди на восточном склоне Урала, Средней Азии, Закавказье и т.д.
Большое количество меди и других ископаемых находится на дне океанов, которое покрыто так называемыми конкрециями – скоплениями в виде камней округлой неправильной формы. Они содержат в среднем 0,5% меди. По подсчетам ученых запасы этой ценной и своеобразной руды составляют 5 млрд. тонн. [1, с.16-18]
