Shpora_himia2
.docx|
Стехиометрия — раздел химии, в котором рассма-ся массовые или объемные соот-ния между реагирующими в-вами. 1. З сохранения массы веществ (М. В. Ломоносов, гг., А. Лавуазье, г.). при хим реакциях атомы не исчезают и не могут возникать из ничего; общее число атомов остается постоянным до и после реакции. Закон постоянства состава вещества (Ж. Л. Пруст, Каждое чистое в-во независимо от способа его получения всегда имеет постоянный качественный и кол-нный состав. В равных V различных газов при одинаковых T и P содержится одно и тоже число молекул. Важным следствием из закона Авогадро является утверждение, что при одинаковых условиях равные количества различных газов занимают равные V. Суть закона эквивалентов вещества взаимодействуют друг с другом в эквивалентных соотношенияхмассы веществ m, реаг-щих друг с другом или получ-щихся в результате р-ции, пропорциональны мол массам их экв-ов Мэ: m1/m2 = Мэ1/Мэ2 = ...
|
Вопрос №2. Уравнение состояния идеального газа. Закон Авагадро. Используя зависимость давления идеального газа от его температуры и концентрации молекул p
= nkT
|
Вопрос№3. Молярный объем и относительная плотность газа.Для идеального газа молярный объем при нормальных условиях равен: Vнорм=22,4 л/моль. Молярный объем вещества — есть отношение объема, занимаемого веществом, к его количеству.Относительная плотность вещества Б – отношение плотности вещества Б к плотности вещества А, взятого за эталон.
Эти соотношения с достаточно высокой точностью справедливы и для реальных газов при обычных давлениях. |
||||||
|
Вопрос№4.
Газовые смеси: парциальное давление,
парциальный объем. Закон Дальтона.
Закон Амага.Парциа́льное
давление
(лат. partialis
— частичный, от лат. pars
— часть) — давление
отдельно взятого компонента газовой
смеси. Общее давление газовой смеси
является суммой парциальных давлений
её компонентов.
Закон Дальтона.Парциальное
давление идеального
газа в смеси равно давлению, которое
будет оказываться, если он занимает
тот же объём при той же температуре.
|
Вопрос№5. Техническая формула и молярная масса газовой смеси. Молярная масса (М). Отношение массы вещества (m) к его количеству (n): М = m/n [кг/моль] Масса вещества в количестве 1 моль. На практике часто пользуются кратной единицей— г/моль. Моля́рная ма́сса вещества — масса одного моля вещества. Для отдельных химических элементов молярной массой является масса одного моля отдельных атомов этого элемента. В этом случае молярная масса элемента, выраженная в г/моль, численно совпадает с массой атома элемента, выраженной в а.е.м. (атомная единица массы). Однако надо чётко представлять разницу между молярной массой и молекулярной массой, понимая, что они равны лишь численно и отличаются по размерности.Молярные массы сложных молекул можно определить, суммируя молярные массы входящих в них элементов.Например, молярная масса воды (H2O) есть MH2O = 2 MH +MO = 2·1+16 = 18 (г/моль).
|
Вопрос№6. Эквивалент. Фактор эквивалентности. Эквивалентная масса. Эквивалентный объем. Эквивалент Э(Х). Кол-во эл-та или вещ-ва, кот-ое соединяется с 1 моль атомов H или замещает то же кол-во H в хим р-иях. моль. Например, в реакции 2H2 + 02=H20 1 моль атомов Н эквивалентен 1/2 моль атомов О, следовательно, Э(О) = 1/2 моль. Эквивалентная масса М(экв.) Масса ве-ва в кол-ве 1эквивалента. кг/моль или г/моль М (Н) = 1 г/моль; Эквивалентную массу можно определить по хим-й формуле хим. соединения m жа(оксида)=М оксида/(число A O*2); m экв(осн-ия)=М ос-ия/кислотность осн-ия; m экв(ки-ты)=М кислоты/основность кислоты; m экв(соли) = М соли /(число атомов ме*валентность ме). Основность ки-ты – кол-о Н+ в кислоте, способных замещаться на ме; Кислотность основания - количество OH– в основании, способных замещаться на кислотные остатки. Эквивалентный V.отношение V данного газа VВ к кол-ву в-ва Э. х. в-ва В: Эквивалентным V называется V занимаемый при данных условиях 1 эквивалентном вещества закон эквивалентов: хим элементы соединяются друг с другом в строго определенных кол-вах, соотв-ющих их эквивалентам.Отношение эквивалентной молярной массы к его собственной молярной массе называется фактором эквивалентности Фактор эквивалентности – это безразмерная величина, которая <= 1 |
||||||
|
Вопрос№7. Закон эквивалентов. массы (или объемы) реагирующих и образующихся веществ пропорциональны молярным массам (молярным объемам) их эквивалентов. массы реагирующих и образующихся веществ относятся между собой как молярные массы эквивалентов (объемов) этих веществ. Для реакции: А + В = АВ, mA / mB = МЭA/ МЭB, где mA и mB - массы веществ А и В; Эквивалентным объемом называется объем, занимаемый при данных условиях 1 эквивалентном вещества. Если одно из реагирующих веществ находится в твердом состоянии, а другое - газообразном, то закон эквивалентов можно представить формулой: m / V = МЭ / VЭ, где m - масса твердого вещества; МЭ - его молярная масса эквивалента; V - объем газообразного вещества; VЭ - его молярный объем эквивалента (объем одного эквивалента). VЭ, Н = 11,2 л/моль; VЭ, О = 5,6 л/моль.
Вопрос№10. Виды солей и их взаимные превращения. По составу соли делятся на средние (нормальные), кис-лые (гидросоли) и осн-ые (гидроксосоли). Например, средние соли— NaCI, CaCO3, Fe2(SO4)3, кис-е соли— NaHCO3, Ca(H2PO4)2, осн-ые соли— MgOHNO3 комплексные Средние соли— сложные ве-ва, мол-лы кот-ых со-стоят из атомов ме и кис-ых остатков. например: ZnSO4 1.Получение ср солей: 1) ме с неме: 2Na + Cl2 = 2NaCl 2) мет с ки-ой: Zn + 2HCl = ZnCl2 + H2 3) ме с рас-ом соли менее активного ме Fe + CuSO4 = FeSO4 + Cu 4) осн-го оксида с ки-м оксидом: MgO + CO2 = MgCO3 5) осн-го оксида с кис-ой CuO + H2SO4= CuSO4 + H2O 6) осн-ия с кис-м оксидом Ba(OH)2 + CO2 = BaCO3 + H2O 7) осно-ия с кис-й: Ca(OH)2 + 2HCl = CaCl2 + 2H2O 8) соли с кис-ой: MgCO3 + 2HCl = MgCl2 + H2O + CO2 BaCl2 + H2SO4 = BaSO4 + 2HCl Кислые соли— это сложные ве-ва, мол-ы кот-ых состоят из атомов ме и кис-ых остатков, сод-щих атомы Н. NaHCO3, Fe(HSO4)3, Ca(H2PO4)2, K2HPO 4. 3.Получение осн-ых солей: 1. Гидролиз солей, обр-ных слабым осн-ием и сильной ки-ой ZnCl2 + H2O = [Zn(OH)]Cl + HCl 4.Получение комплексных солей: 1. Реакции солей с лигандами: AgCl + 2NH3 = [Ag(NH3)2]Cl FeCl3 + 6KCN = K3[Fe(CN)6] + 3KCl
|
Вопрос№8. Номенклатура оксидов, оснований, кислот, солей. Например, Cu2О — оксид меди(I), CuO — оксид меди(II), FeO — оксид железа(II), Fe2О3 — оксид железа(III), Cl2O7 — оксид хлора(VII). Если элемент образует несколько оснований, то в названиях указывается степень его окисления римской цифрой в скобках: Fe (ОН)2 - гидроксид железа (II), Fe(ОН)3 - гидроксид железа (III). Различают кислородные и бескислородные кислоты. Как показывает само название, первые содержат кислород (например, Н2SО4, НNО3, Н3РО4), вторые его не содержат (например, НСl, НВr, НI, Н2S). Названия кислородных кислот производятся от названия неметалла с прибавлением окончаний –ная, -вая, если степень окисления его соответствует номеру группы. По мере понижения степени окисления суффиксы меняются в следующем порядке: -оватая, -истая, -оватистая:
Вопрос№11.Взаимодекйствие амфотерных оксидов и амфолитов с кислотами и щелочами(растворами и расплавами). Амфотерные оксиды реагируют с сильными кислотами, образуя соли этих кислот. Такие реакции являются проявлением основных свойств амфотерных оксидов, например: ZnO + H2SO4 → ZnSO4 + H2O Они также реагируют с сильными щелочами, проявляя этим свои кислотные свойства, например: ZnO + 2NaOH → Na2ZnO2 + H2O Амфотерные оксиды могут реагировать с щелочами двояко: в растворе и в расплаве. При реакции с щёлочью в расплаве образуется обычная средняя соль(как показано на примере выше). При реакции с щёлочью в растворе образуется комплексная соль. Al2O3 + 2NaOH + 3H2O → 2Na[Al(OH)4] (В данном случае образуется тетрагидроксоаллюминат натрия) Для каждого амфотерного металла есть свое координационное число. Для Be и Zn — это 4; Для Al — это 4 или 6; Для Cr — это 6 или (очень редко) 4; Амфотерные оксиды обычно не растворяются в воде и не реагируют с ней.
|
Вопрос№9. Получение солей кислотно-основным способом. 1. Взаимодействие основного оксида с кислотой CaO + 2HCl = CaCl2 + 2H2O FeO + H2SO4 = FeSO4 + H2O 2. Взаимодействие основания с кислотой (реакция нейтрализации). Ba(OH)2 + 2HCl = BaCl2 + 2H2O 2NaOH + H2SO4 = Na2SO4 + H2O При неполной нейтрализации кислоты основанием образуется кислая соль: H2SO4 + NaOH = NaHSO4 + H2O 3. Взаимодействие соли с кислотой. В этом случаи образуется новая кислота и новая соль 2NaCl + H2So4 = Na2SO4 + 2HCl↑ Действием избытка кислоты на средние соли многоосновных кислот получают кислые соли: Na2SO4 + H2SO4 = 2NaHSO4 CaCO3 + CO2 + H2O = Ca(HCO3)2 4. Взаимодействие основного оксида с кислотным оксидом. CaО + SiО2 = CaSiO3 5. Взаимодействие основания с кислотным оксидом 6NaOH + P2O5 = 2Na3PO4 + 3H2O 6. Взаимодействие соли с кислотным оксидом. Вступающий в реакцию кислотный оксид должен быть менее летуч, чем образующийся после реакции. CaCO3 + SiO2 =t CaSiO3 + CO2 ↑ Вопрос№12. Способы выражения состава сложного вещества, сплава, раствора: массовая доля, молярная доля. Массовая доля элемента в сложном веществе По известной химической формуле сложного вещества определяют массовые доли элементов, входящих в это вещество. Массовая доля элемента (wЭ) в общей массе сложного вещества - это отношение массы, приходящейся на этот элемент (то есть массы части), к массе всего вещества (то есть к массе целого): wЭ = mЭ/mвещ Массовая доля элемента - это доля от единицы или от 100%. В сложном веществе wЭ всегда меньше единицы (или меньше 100%). Например, для воды H2O wH = 0,11 (11%) и wO = 0,89 (89%). Сумма массовых долей элементов, входящих в сложное вещество, равна 1 (100%). Мольная доля — отношение количества молей данного компонента к общему количеству молей всех компонентов. Мольную долю выражают в долях единицы.
где:
|
||||||
|
Вопрос№13. Способы выражения состава раствора: молярная концентрация. Нормальная(эквивалентная) конце нтрация. Их взаимосвязь; моляльная взаимосвязь.
Молярная
концентрация — количество
растворённого вещества (число молей)
в единице объёма раствора. моль/м³,
моль/л или ммоль/л. Также распространено
выражение в «молярности». Возможно
другое обозначение молярной концентрации
CM
, которое принято обозначать М. Так,
раствор с концентрацией 0,5 моль/л
называют 0,5-молярным.
где: ν — количество растворённого вещества, моль; V — общий объём раствора, л. Нормальная концентрация (мольная концентрация эквивалента) количество
эквивалентов
данного вещества в 1 литре раствора.
,где: ν — количество растворённого вещества, моль; V — общий объём раствора, л; z — число эквивалентности. Моляльность —
количество растворённого вещества
(число молей) в 1000 г растворителя молях/
кг «моляльности». Так, раствор с
концентрацией 0,5
моль/кг
называют 0,5-моляльным.
, где: ν — количество растворённого вещества, моль; m2 — масса растворителя, кг. |
Вопрос№14. Квантовые числа. Квантовые числа. Целые или полуцелые (±1/2) числа, описывающие разрешенные дискретные состояния атомов и молекул (атомные и молекулярные орбитали). Квантовые числа характеризуют энергетическое состояние каждого электрона в атоме или в молекуле главное квантовое число (n), орбитальное квантовое число (l), магнитное квантовое число (mI), спиновое квантовое число (ms). Главное квантовое число (n) характеризует энергетический уровень и определяет размер электронного облака Наименьшую энергию имеют электроны первого уровня (n = 1 Орбитальное квантовое число, побочное квантовое число (l) характеризует энергию энергетического подуровня и определяет форму электронного облака; принимает целочисленные зна-чения от 0 до (n— 1).
Магнитное
квантовое число (ml).
Квантовое
число, характеризующее
энергию электрона в атоме (энергию
атомных орбиталей)
и определяющее ориентацию электронного
облака в пространстве относительно
внешней силы. ml
=
2l + 1.
Спиновое квантовое число (ms). Квантовое число, характе-ризующее собственный момент количества движения электрона в атоме, молекуле, кристалле. |
Вопрос№18.Периодичность величин атомных радиусов, энергии ионизации и окислительно-восстановительных свойств элементов. АТОМНЫЕ РАДИУСЫ, эффективные хар-ки атомов, позволяющие приближенно оценивать межат-ое (межъяд-ное) расстояние в мол-ах и кристаллах. Согласно представлениям квантовой механики, А не имеют четких границ, однако вероятность найти е, связанный с данным ядром, на определенном расстоянии от этого ядра быстро убывает с увеличением расстояния. А радиусы - величины очень малые, порядка 0,1 нм, Е ионизации — разновидность Е связи или, как её иногда называют, первый ионизационный потенциал (I1), представляет собой наименьшую Е, необходимую для удаления е от свободного А в его низшем Е-ом (основном) состоянии на бесконечность. На Е ионизации А наиболее существенное влияние оказывают следующие факторы: эффективный заряд ядра, являющийся функцией числа е в А, экранирующих ядро и расположенных на более глубоко лежащих внутренних орбиталях; радиальное расстояние от ядра до максимума зарядовой плотности наружного, наиболее слабо связанного с А и покидающего его при ионизации, электрона; мера проникающей способности этого е; межэлектронное отталкивание среди наружных (валентных) е. |
||||||
|
Вопрос№15. Принцип Паули. правило Хунда. При́нцип Па́ули (принцип запрета) — один из фундаментальных принципов квантовой механики, согласно которому два и более тождественных фермиона не могут одновременно находиться в одном квантовом состоянии.Следствием принципа является наличие электронных оболочек в структуре атома, из чего, в свою очередь, следует разнообразие химических элементов и их соединений. Количество электронов в отдельном атоме равно количеству протонов. Правило Хунда (Гунда) определяет порядок заполнения орбиталей определённого подслоя и формулируется следующим образом: суммарное значение спинового квантового числа электронов данного подслоя должно быть максимальным.Это означает, что в каждой из орбиталей подслоя заполняется сначала один электрон, а только после исчерпания незаполненных орбиталей на эту орбиталь добавляется второй электрон. При этом на одной орбитали находятся два электрона с полуцелыми спинами противоположного знака, которые спариваются (образуют двухэлектронное облако) и, в результате, суммарный спин орбитали становится равным нулю.
|
Правила Клечковского. 1. Последовательное заполнение атомных орбиталей при увеличении заряда ядра происходит от орбиталей с меньшим значением суммы главного и орбитального квантовых чисел (n + I) к орбиталям с большим значением этой суммы. Например, для 3d-орбиталей (n = 3, I = 2) сумма (n + I) = 5, а для 4 s-орбиталей (n = 4, I = 0) сумма (n + I) = 4. Значит, 4 s-подуровень должен заполняться раньше, чем подуровень 3d. 2. При одинаковых значениях (n + I) вначале происходит заполнение орбитали с наименьшим значением главного кван-тового числа. Например, для скандия -Sc- 3d- и 4 р-орбитали имеют одинаковое значение (n + I): 3 + 2 (d) и 4 + 1 (р). Следо-вательно, вначале будет заполняться 3 d-орбиталь, затем— 4р-орбиталь. Периоди́ческая систе́ма хими́ческих элеме́нтов (табли́ца Менделе́ева) — классификация химических элементов, устанавливающая зависимость различных свойств элементов от заряда атомного ядра. Система является графическим выражением периодического закона, установленного русским химиком Д. И. Менделеевым в 1869 году. |
Вопрос№20.Основные характеристики ковалентной связи. Важными количественными характеристиками ковалентной связи являются энергия связи, ее длина и дипольный момент. Энергия связи – энергия, выделяющаяся при ее образовании, или необходимая для разъединения двух связанных атомов. Энергия связи характеризует ее прочность. Длина связи – расстояние между центрами связанных атомов. Чем меньше длина, тем прочнее химическая связь. Дипольный момент связи (μ) – векторная величина, характеризующая полярность связи (измеряется в дебаях D или кулон-метрах: 1D = 3,4·10-30 Кл·м). Длина вектора равна произведению длины связи l на эффективный заряд q, который приобретают атомы при смещении электронной плотности: | μ | = l · q. Вектор дипольного момента направлен от положительного заряда к отрицательному. При векторном сложении дипольных моментов всех связей получают дипольный момент молекулы. На характеристики связей влияет их кратность: энергия
связи увеличивается в ряду: длина
связи растет в обратном порядке:
|
||||||
|
Вопрос№21.Электроотрицательность элементов и полярность связи. Электpоoтрицательность χ (греч. хи) — способность А удерживать внешние (валентные) е. Она определяется степенью притяжения этих е к положительно заряженному ядру. Элeктроотрицательность элементов подчиняется периодическому закону: она растет слева направо в периодах и снизу вверх в главных подгруппах Периодической системы элементов Д.И. Менделеева. Полярность хим-х связей — характеристика хим-ой связи, показывающая изменение распределения е-нной плотности в пространстве вокруг ядер в сравнении с распределением е-ной плотности в образующих данную связь нейтральных А. В качестве кол-ной меры полярности связи используются так называемые эффективные заряды на А. Эффективный заряд определяется как разность между зарядом е-ов, находящимся в некоторой области пространства вблизи ядра, и зарядом ядра. Однако эта мера имеет лишь условный и приблизительный смысл, поскольку невозможно однозначно выделить в мо-е область, относящуюся исключительно к отдельному АНаличие эффективного заряда может быть указано символами зарядов у А-ов (например, Н+δ — Cl−δ, где δ — некоторая доля элементарного заряда). Практически все хим-е связи,— в той или иной степени полярны. Ковалентные связи обычно слабо полярны. Ионные связи — сильно полярны.
|
Вопрос№22.Полярность молекул(примеры). Молекулы некоторых веществ вне зависимости от внешнего электрического поля представляют собой диполи, т. е. системы, имеющие два равных по величине, но противоположных по знаку электрических заряда. Такие молекулы называют полярными. Если в двухатомных молекулах сложных веществ связь между различными атомами полярна, то и сами молекулы обладают постоянным дипольным моментом.Дипольный момент таких молекул совпадает по направлению и величине с дипольным моментом связи. Примером может служить молекула НСl, в которой электронное облако смещено к хлору, следовательно, центр отрицательных зарядов лежит ближе к атому хлора, а центр положительных — к атому водорода. В молекулах простых веществ типа Н2, Cl2, N2 связь неполярна, дипольный момент их равен нулю. Такие молекулы называют неполярными. Неполярными являются и многие симметрично построенные молекулы сложных веществ. Молекулы, которые образованы атомами разных элементов, могут быть полярными и неполярными. Это зависит от геометрической формы. Если форма симметрична, то молекула неполярна (BeH2, BF3, CH4, CO2, SO3), если асимметрична (из-за наличия неподелённых пар или неспаренных электронов), то молекула полярна (NH3, H2O, SO2, NO2).
|
Вопрос№23Химическая связь в двухатомных молекулах: метод валентных связей(примеры). Представления о механизме образования молекулы Н были распространены на более сложные молекулы. Разработанная на этой основе теория хим связи получила название метода валентных связей (метод ВС). В основе метода ВС лежат следующие положения: 1) Ковалентная связь образуется двумя е с противоположно направленными спинами, причем эта электронная пара принадлежит двум А 2) Ковалентная связь тем прочнее, чем в большей степени перекрываются е-ые облака.
Эта схема показывает, что при соединении двух атомов водорода в молекулу каждый из атомов приобретает устойчивую двухэлектронную оболочку. подобную электронной оболочке атома гелия. Аналогичными схемами можно представить образование молекулы азота:
При соединении двух атомов азота в молекулу общими становятся три пары электронов (тройная связь); благодаря этому наружная оболочка каждого атома дополняется до устойчивой восьмиэлектронной конфигурации атома неона.
|
||||||
|
Вопрос№24Химическая связь в двухатомных молекулах: метод молекулярных орбиталей (примеры). Гибридизация атомных орбиталей и геометрия многоатомных молекул(примеры) Метод молекулярных орбиталей (ММО). Квантово-меха-нический метод описания химической связи, согласно которому молекула рассматривается как “многоядерный” атом с электро-нами, находящимися на молекулярных орбиталях (МО). МО характеризует состояние электрона в молекуле или дру-гой многоатомной системе. Молекулярная орбиталь находится в результате сложе-ния или вычитания волновых функций атомных орбиталей Если при образовании МО энергия системы уменьшается, такая МО называется связывающей (с ). При увеличении энергии системы образуется разрыхляющая МО (Ъ ). Промежуточные энергетические состояния между связывающими и разрыхляющими МО МО заполняются электронами по мере возрастания энергии орбитали и в соответствии с правилом Хунда. В ММО вместо понятия кратность связи есть понятие порядок связи.
|
Вопрос№25. Межмолекулярное взаимодействие. Межмо- ярное взаи-твие, взаим-твие между электрически нейтрал-и мол-и или А; определяет существование жидкостей и молекулярных кристаллов, отличие реальных газов от идеальных и проявляется в разнообразных физич-их явлениях. М. в. зависит от расстояния r между моле-ми и, как правило, описывается потен-ой Е взаим-твия U(r) (потенциалом М. в.), так как именно средняя потенциальная Е взаимодействия определяет состояние и многие свойства в-ва. F пр между двумя полярными мо-ми макс в том случае, когда их дипольные моменты располагаются вдоль одной линии (рис. 1). Эта F возникает благодаря тому, что расстояния между разноимёнными зарядами немного меньше, чем между одноимёнными. Индукционные (или поляризационные) F действуют между полярной и неполярной мол-ами. Полярная мол-а создаёт элек-кое поле, которое поляризует мо-лу с элект-ми зарядами, равномерно распределёнными по V. + заряды смещаются по направлению элек-ого поля, а о- — против. В результате у неполярной мо-лы индуцируется дипольный момент. F отта-ия действуют между мол-ми на очень малых расст-ях, когда приходят в соприкосновение заполненные эле-ые оболочки A, входящих в состав мо-л. Три разновидности сил Ван-дер-Вальса(1. F ориентационного, индукционного, дисперсионного происхождения)
|
Вопрос№26.Водородная связь. Водородная связь. Хим-ая связь, которая возникает между + поляризованным A H и другим “-“ поляризованным A за счет F электростатического притяжения. Е водородной связи прибл-ьно в 10 раз < энергии изолированной одинарной ковалентной связи и составляет несколько десятков кДж/моль. Благодаря образованию водородной связи вода, аммиак и фтороводород имеют Т кип и плав >, чем у других водородных соединений элементов тех же групп. При отсутствии вод связи наблюдается закономерное повышение Т кип и плав соединений в зависимости от их моле-ой массы (рис. 24). Существует два вида вод связи: межмолекулярная и внутримолекулярная. Межмо-ная вод связь. Разновидность вод связи, возникающей между разными мол-ами.(пример вода) В результате образования водородных связей происходит ассоциация молекул, что приводит к изменению физических и химических свойств вещества: увеличивается его плотность, вязкость, температура кипения, температура плавления. Внутримолекулярная водородная связь. Водородная связь, объединяющая части одной молекулы Наблюдается у многих органических соединений сложного состава, в частности, у белков. Внутримолекулярная водородная связь оказывает заметное влияние на химические и физические свойства веществ. HCLO |
||||||
|
Вопрос№27. Металлическая связь. Металлическая связь — химсвязь, обусловленная наличием относительно свободных е. Характерна как для чистых мет-ов, так и их сплавов Во всех узлах крист-кой решётки расположены + ионы ме. Между ними беспорядочно движутся валентные е, отцепившиеся от А при образовании ионов. Эти е играют роль цемента, удерживая вместе положительные ионы Вместе с тем и е удерживаются ионами в пределах кри-кой решётки и не могут её покинуть. F связи не локализованы и не направлены. В кубической объемно центрированной решётке (ОЦК) атомы расположены в вершинах куба и один атом в центре объёма куба. Кубическую объемно центрированную решётку имеют металлы: Pb, K, Na, Li, β-Ti, β-Zr, Ta, W, V, α-Fe, Cr, Nb, Ba и др. В кубической гранецентрированной решётке (ГЦК) атомы расположены в вершинах куба и в центре каждой грани. Решётку такого типа имеют металлы: α-Ca, Ce, α-Sr, Pb, Ni, Ag, Au, Pd, Pt, Rh, γ-Fe, Cu, α-Co и др. В гексагональной решётке атомы расположены в вершинах и центре шестигранных оснований призмы, а три атома — в средней плоскости призмы. Такую упаковку атомов имеют металлы: Mg, α-Ti, Cd, Re, Os, Ru, Zn, β-Co, Be, β-Ca и др. Свободно движущиеся электроны обусловливают высокую электро- и теплопроводность. Вещества, обладающие металлической связью, часто сочетают прочность с пластичностью, так как при смещении атомов друг относительно друга не происходит разрыв связей.
|
Вопрос№37 Уравнение изобары Уравнение изобары:
Факторы влияющие на хи-ское рав-сие: 1) тем-тура При увеличении тем-туры хим-ое равновесие смещается в сторону эндотермической (поглощение) реакции, а при понижении в сторону экзотермической (выделение) реакции. CaCO3=CaO+CO2 -Q t↑ →, t↓ ← N2+3H2↔2NH3 +Q t↑ ←, t↓ → 2) да-ние При увеличении да-я химическое равновесие смещается в сторону меньшего V веществ, Этот принцип действует только на газы, т.е. если в реакции участвуют ТВ-дые в-тва, то они в расчет не берутся. CaCO3=CaO+CO2 P↑ ←, P↓ → 1моль=1моль+1моль 3) кон-ация исходных в-ств и продуктов реакции При увеличении кон-ации одного из исходных веществ хим-кое равновесие смещается в сторону продуктов реакции, а при увеличении концентрации продуктов реакции-в сторону исходных веществ. S2+2O2=2SO2 [S],[O]↑ →, [SO2]↑ ← Катализаторы не влияют на смещение хи-кого равновесия! |
Вопрос №36 Химическое равновесие Химическое равновесие — состояние хим-ой системы, в котором обратимо протекает одна или несколько хи-их р-ий, причём ско-ти в каждой паре прямая-обратная ре-ия равны между собой. Для системы, находящейся в хим-ком рав-ии, конце-ции реагентов, тем-ура и другие параметры системы не изменяются со временем.[1] А2 + В2 ⇄ 2AB В состоянии рав-сия скорости прямой и обратной реакции становятся равными. Положение
хим-ского равновесия зависит от
следующих параметров
реакции: тем-уры, д-ния и ко-рации.
Конста́нта равнове́сия — величина, определяющая для данной хим-кой р-ции соотношение между термоди-кими активностями ) исходных ве-тв и продуктов в состоянии хим-ого равн-есия (в соответствии с законом действующих масс)
это уравнение изотермы химической реакции.
|
||||||
|
|
|
|
||||||
|
|
|
|
||||||
|
62 Принцип Ле Шателье — Брауна Принцип Ле Шателье — Брауна (1884 г.) — если на систему, находящуюся в устойчивом равновесии, воздействовать извне, изменяя какое-либо из условий равновесия (температура, давление,концентрация), то в системе усиливаются процессы, направленные на компенсацию внешнего воздействия.
|
|
Вопрос№39. Концентрированные и насыщенные растворы. Насыщенный раствор — раствор, в кот-ом растворённое в-во при данных условиях достигло макс-й концентрации и больше не раст-ся. Осадок данного вещества находится в равновесном состоянии с ве-вом в рас-ре. Следовательно, никакое самое сильное перемешивание не помогает растворить в насыщенном рас-ре дополнительные порции в-ва. Однако, если повысить Т, то раствор вновь может стать ненасыщенным и ра-ить еще определенную порцию кристаллов. Концентрированный раствор — рас-р с высоким содержанием раст-ого в-ва в противоположность разб-ому р-ру, содержащему малое кол-во растворённого в-ва. Очевидно, что концен-ные р-ры могут образовывать только хорошо раст-мые в-ва. Деление раст-ров на концент-нные и разбав-ые не связано с делением на насыщенные и ненасыщеные. Так насыщенный 0,0000134М р-р хлорида серебра является очень разбавленным, а 4М раствор бромида калия, будучи очень концентрированным, не является насыщенным. Концен-ные р-ры подразделяют на кислотные, щелочные, цианистые и хромосодержащие. Каждый из этих видов отработанных ра-ов имеет отдельную канализационную сеть и направляется в специальные емкости — сборники-накопители для их обезвреживания. |
||||||
|
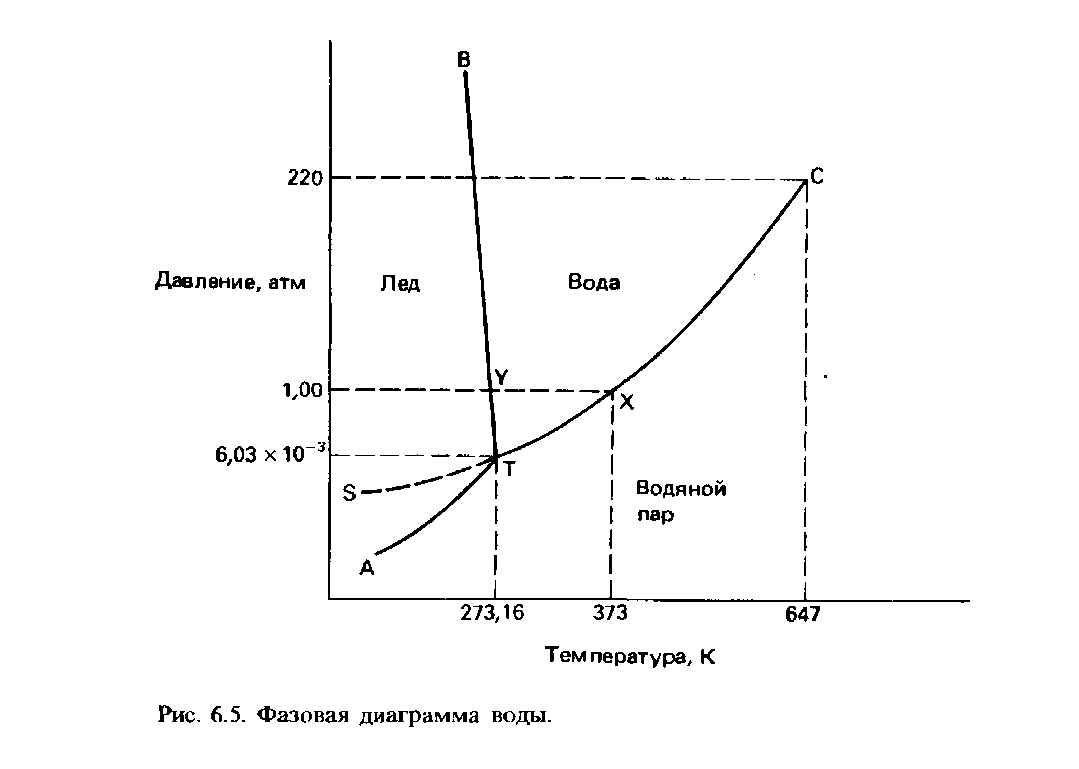
Вопрос№40. Фазовая диаграмма воды. Эта диаграмма показана на рис. 6.5. Области фазовой диаграммы, ограниченные кривыми, соответствуют тем условиям (температурам и давлениям), при которых устойчива только одна фаза вещества. Например, при любых значениях температуры и давления, которые соответствуют точкам диаграммы, ограниченным кривыми ВТ и ТС, вода существует в жидком состоянии.
|
Вопрос№41. Закон Рауля. Зако́ны Ра́уля —Ф. М. Раулем в 1887 г. количественных закономерностей, описывающих некоторые коллигативные (зависящие от концентрации, но не от природы растворённого вещества) свойства р-ров. Рауля законы Колич-ые зависимости, связывающие конце-ию р-ра или с дав-м насыщенного пара растворителя над р-ром, или с изменением Т кип (замерзания) р-ра. Один из законов Ф. Рауля (См. Рауль) гласит: относительное понижение парц-ного давления пара растворителя равно мольной доле раство-ого в-ва, т. е.
где
закона Рауля, по которому повышение (tкип) или понижение Т замерзания (tк) раствора прямо пропо-льно моляльной конце-ции раств-ного в-ва, имеют место соотношения: Δtкип = Еэ․m, Δtк = Eкm, (2) где Δtкип — величина повышения tкип и Δtк — величина понижения tк, m — моляльная концентрация р-ра, а Еэ и Ек — т. н. эбулиоскопическая (см. Эбулиоскопия) и криоскопическая (см. Криоскопия) постоянные растворителя Соотношения (2) используют для определения молекулярной массы рас-ного в-ва по экспериментально определяемым величинам Δtкип и Δtк.
|
Вопрос№42 Эбулиоскопия и криоскопия. Эбулиоскопия— метод исследования р-ов, основанный на измерении повышения их т кип по сравнению с чистым раствор-лем. Используется для определения моле-рной массы раст-го вещества, активности раствор-ля, степени диссоциации (или изотонического коэффициента). давление
пара над раствором нелетучего
в-ва определяется р пара р-ля и, в
соответствии с законом
Рауля, может быть выражено уравнением:
С учетом уравнения Клапейрона — Клаузиуса можно показать[1], что изменение т-ы ки-ия р-ра (ΔTboil) может быть рассчитано по формуле:
где ΔHboil — энтальпия испарения; M1 — молярная масса раст-еля; n2 — моляльная кон-ция раств-ого в-ва. Дробь в квадратных скобках в этом выражении зависит только от свойств растворителя — это так называемая эбулиоскопическая константа раст-ля ε. Она равна повышению т-ы кипения одномоляльного р-ра. Криоскопия— метод исследования р-ров, в основе которого лежит измерение понижения т-ры зам-ия р-ра по сравнению с т-рой заме-ия чистого раство-еля. Ф. Раулем в 1882 году Криоскопия может быть использована для определения активности растворителя, в соответствии с соотношением[2]:
|
||||||
|
Вопрос№43.Осмос. О́смос (от греч. ὄσμος — толчок, давление) — процесс одно-онней диффузии через полупроницаемую мембрану молекул раств-теля в сторону бо́льшей конце-ции раств-ого в-ва (меньшей кон-ции раств-еля) Явление осмоса наблюдается в тех средах, где подвижность раств-ля больше подвижности раство-нных в-тв. Осмос через полупроницаемую мембрану. Полуп-ыми называют мембраны, кот имеют достаточно высокую прони-ость не для всех, а лишь для неко-ых в-тв, в частности, для раств-еля. Например, к яичной скорлупе с внутренней стороны прилегает полупроницаемая мембрана: она пропускает мол-ы воды и задерживает мо-ы сахара. Осмос, направленный внутрь огра-ого V жидкости, называется эндосмосом, наружу — экзосмосом. Перенос раств-еля через мембрану обусловлен осмотическим давл-ием. Оно равно избыточному внешнему дав-ю, кот следует приложить со стороны р-ра, чтобы прекратить процесс, то есть создать условия осмотического равновесия. Осмос биоло-ких процессах. Мембрана, окружающая нормальную клетку крови, проницаема лишь для молекул воды, кислорода, некоторых из растворенных в крови питательных веществ и продуктов клеточной жизнедеятельности; для больших белковых молекул, находящихся в растворенном состоянии внутри клетки, она непроницаема. Поэтому белки, столь важные для биологических процессов, остаются внутри клетки. Вопрос№45. Сильные и слабые электролиты среди основных классов неорганических веществ. Электроли́ты — в-тва, расплавы или ра-ры, которые проводят элект ток вследствие диссоциации на ионы, однако сами вещества не проводят эл-ий ток. Примерами эле-тов могут служить р-ры кислот, солей и оснований. Элек-ы — проводники второго рода, в-ва, которые в р-ре (или расплаве) состоят полностью или частично из ионов, и обладающие вследствие этого ионной проводимостью. Исходя из степени диссоциации все электролиты делятся на две группы Сильные электролиты — эл-ты, степень диссоциации которых в ра-рах равна единице (то есть диссоциируют полностью) и не зависит от конц-ии р-ра. Сюда относятся большинство солей, щелочей, а также некоторые кислоты (сильные кислоты, такие как: HCl, HBr, HI, HNO3). Слабые электролиты — степень диссоциации меньше единицы (то есть диссоциируют не полностью) и уменьшается с ростом концентрации. К ним относят воду, ряд кислот (слабые кислоты), основания p-, d-, и f- элементов. Между этими двумя группами четкой границы нет, одно и то же вещество может в одном растворителе проявлять свойства сильного электролита, а в другом — слабого. В источниках тока Электролиты являются важной частью химических источников тока: гальванических элементов и аккумуляторов.[2] |
Вопрос№44. Электролитическая диссоциация. Изотонический коэффициент, степень и константа диссоциации. Электролитическая диссоциация, распад в-ва на ионы при рас-нии. Э. д. происходит вследствие взаим-твия раст-ного в-тва с раств-елем; по данным спектроскопических методов, это вза-вие носит в значительной мере хим-ий хар-ер Классическая теория Э. д. была создана С. Аррениусом и В. Оствальдом Константа диссоциации Кд определяется актив-ями катионов аК+, анионов аА- и недиссоциированных мол-л аКА следующим образом:
Значение Кд зависит от природы раств-ного в-ва и раств-еля, а также от т-ры и может быть определено несколькими экспер-ыми методами. Изотонический коэффициент) — безразмерный параметр, характ-ий поведение ве-ва в ра-ре. Он численно равен отношению значения некоторого коллигативного свойства раствора данного вещества и значения того же коллигативного свойства неэлектролита той же концентрации при неизменных прочих параметрах системы:
Вопрос№46. Многоступенчатая диссоциация слабого электролита. Константа сложного равновесия. Ступенчатая диссоциация Многоосновные ки-оты и многокислотные осн-ия в водных ра-рах диссо-руют сту-енчато, т.е. вначале от молекулы отщепляется один из ионов, затем другой и т.д. Каждая такая ступень характеризуется своей константой – ступенчатой константой диссоциации Например, серная кислота H2SO4 – сильная двухосновная кислота, диссоциирует в две ступени. I ступень: H2SO4 ↔ H+ + HSO4¯ II ступень: HSO4¯ ↔ H+ + SO42– Степень диссоциации (α) серной кислоты по каждой ступени близка к 1, поэтому для серной кислоты можно записать суммарное уравнение диссоциации: H2SO4 ↔ 2H+ + SO42– Для слабых многоосновных кислот суммарное уравнение диссоциации писать некорректно, т.к. наибольшую концентрацию ионов водорода обеспечивает диссоциация по I ступени. I ступень: H2S ↔ H+ + HS¯ Кд I = 8,9 ∙ 10-8 II ступень: HS¯ ↔ H+ + S2– Кд II = 1,3 ∙ 10-15 Кд I > Кд II Значения двух констант диссо-ии показывают, что процесс диссоциации по второй ступени практически не протекает. Все вышесказанное относится и к растворам многокислотных сильных и слабых гидроксидов (оснований). Например, гидроксид бария Ba(OH)2 – сильный гидроксид: |
Степень диссоциации — величина, характ-щая состояние равн-ия в ре-ции диссоциации в гомогенных (однородных) системах. Степень диссоциации α равна отношению числа диссоциированных молекул n к сумме n + N, где N — число недиссоциированных молекул. Часто α выражают в процентах. Степень диссоциации зависит как от природы растворённого электролита, так и от концентрации раствора. Константа диссоциации — вид константы рав-сия, которая показывает склонность большого объекта диссоциировать (разделяться) обратимым образом на маленькие объекты,. Константа диссоциации обычно обозначается Kd и обратна константе ассоциации. В случае с солями, константу диссоциации иногда называют константой ионизации.
где комплекс AxBy разбивается на x единиц A и y единиц B, константа диссоциации определяется так:
где [A], [B] и [AxBy] — концентрации A, B и комплекса AxBy соответственно.
Вопрос№47. Произведение раство-сти, ионное произведение в-ва. Про-ние рас-ости (ПР, Ksp) — прои-ние конц-ции ионов малор-мого эл-лита в его насыщенном р-ре при постоянной т-ре и дав-ии. Произ-ние раст-сти — величина постоянная. При постоянной т-ре в насыщенных водных р-рах малораст-ых эл-тов устанавливается равновесие между твердым веществом и ионами, образующими это в-тво. Например, в случае для CaCO3 это равновесие можно записать в виде: Константа этого ра-сия рассчи-ется по ур-ю:
В общем виде, про-ение раств-сти для в-ва с формулой AmBn, которое диссоциирует на m ионов An+ и n ионов Bm-, рассчи-тся по ур-нию:
где [An+] и [Bm-] — равновесные мол-ые конце-ции ионов, образующихся при элек-ской диссоциации. Из прои-ений раств-ости можно рассчитать концентрации катионов и анионов в р-ре малорас-го элек-лита. Произведение растворимости, произведение конц-ций ионов в насыщенном р-ре мало-имого сильного эле-ита. Показатели степени для ко-ций, входящих в П. р., равны коэфф-ту при соот-ющем ионе в уравнении диссоциации элек-ита. Для неидеальных р-ров конц-ции должны быть заменены на активности и полученное произведение наз-ся произ-ием активностей. При данной т-туре и в данном раств-еле П. р. для каждого элек-лита есть характерная постоянная величина. |
||||||
|
Вопрос№48. Ионное произведение воды. Водородный показатель. Ио́нное произведе́ние воды́ — произведение концентраций ионов водорода Н+ и ионов гидроксида OH− в воде или в водных растворах, константа автопротолиза воды. Вывод значения ионного произведения воды Вода, хотя и является слабым электролитом, в небольшой степени диссоциирует: H2O + H2O ↔ H3O+ + OH− Или H2O ↔ H+ + OH−
Обозначим произведение K·[H2O] = Kв = 1,8×10−16 моль/л·55,56 моль/л = 10−14моль²/л² = [H+]·[OH−] (при 25 °C). Константа
Kв,
равная произведению концентраций
протонов и гидроксид-ионов, называется
ионным
произведением воды.
Она является постоянной не только для
чистой воды, но также и для разбавленных
водных растворов веществ. C повышением
температуры диссоциация воды
увеличивается, следовательно, растёт
и Kв,
при понижении температуры —
наоборот.Водородный
показатель,
pH, отрицательный десятичный логарифм
концентрации (точнее, активности)
ионов водорода (в г-ион/л)
в данном растворе:
|
Вопрос№49 Ионные реакции в растворах электролитов и запись их уравнение(примеры). Ионные уравнения реакций. Поскольку электролиты в растворах образуют ионы, то для отражения сущности реакций часто используют так называемые ионные уравнения реакций. Написанием ионных уравнений подчеркивается тот факт, что, согласно теории диссоциации, в растворах происходят реакции не между молекулами, а между ионами. С точки зрения теории диссоциации при реакциях между ионами в растворах электролитов возможны два исхода: 1. Образующиеся вещества — сильные электролиты, хорошо растворимые в воде и полностью диссоциирующие на ионы. 2. Одно (или несколько) из образующихся веществ — газ, осадок или слабый электролит (хорошо растворимый в воде). Рассмотрим две реакции:
В ионной форме эти уравнения запишутся следующим образом:
|
Вопрос№50 Расчет константы равновесия ионной реакции. Правило Бертолле. для реакции в смеси идеальных газов константа равновесия может быть выражена через равновесные парциальные давления компонентов pi по формуле:
где νi — стехиометрический коэффициент. Kp не зависит от общего давления, от исходных количеств веществ или от того, какие участники реакции были взяты в качестве исходных, но зависит от температуры . В соответствии с правилом Бертолле: реакции обмена протекают только тогда, когда образуется малорастворимое соединение, легколетучее вещество, или малодиссоциирующее соединение. В таких случаях реакции будут практически не обратимы. Изображение реакций ионного обмена Реакцию обмена в растворе принято изображать тремя уравнениями: молекулярным, полным ионным и сокращённым ионным. В ионном уравнении слабые электролиты, газы и малорастворимые вещества изображают молекулярными формулами. Na2CO3 + H2SO4 → Na2SO4 + CO2↑ +H2O 2Na + CO3 + 2H + SO4 → 2Na + SO4 + CO2↑ + H2O CO3 + 2H → CO2↑ + H2O |
||||||
|
Вопрос 29 Первое начало термодинамики. Энтальпия. Тепловой эффект первое начало термодинамики: теплота, сообщаемая системе, расходуется на изменение ее внутренней Е и на совершение ею А против внешних сил. Изохорный процесс
V =
const. ΔV =
0 и А =
–A '
= 0, т.е. никакой механической работа
не совершается. Первое начало
термодинамики будет иметь вид: При изо-ом процессе вся Е, сообщаемая газу путем тепл-ена, расходуется целиком на увеличение его внут-ей Е. Изотермический процесс
Τ =
const. ΔT =
0 и
ΔU =
0. ПНТ
будет имеет вид: При изот-ком процессе вся Е, сообщаемая газу путем тепл-ена, идет на совершение газом А. Изобарный процесс p = const. Α = p⋅ΔV и нагревается, т.е. изменяется его внут-яя Е.
ПНТ
будет имеет вид: При изоб-ом процессе кол-во теплоты, сообщенное термоди-ческой системе, расходуется на изме-ие ее внут-й Е и на совершение А системой против вне-их сил. Адиабатный процесс А- пр-сс — это процесс, прои-ий без теплообмена системы с окружающей средой, т.е. Q = 0.
Такие
процессы происходят при хорошей
теплоизоляции системы либо при быстрых
процессах ПНТ будет имеет вид: Энтальпи́я, Проще говоря, энтальпия - это та эн-гия, которая доступна для преобразования в теплоту при определенных т-ре и да-ении.H = E = U + pV Тепловой эффект химической реакции или изменение энтальпии системы вследствие протекания хим-й реакции — отнесенное к изменению хим-ой переменной коли-во теплоты, полученное системой, в которой прошла хим-ая реакция и продукты р-ции |
Вопрос№ 30 Закон Гесса Закон Гесса В основе термохимических расчётов лежит закон Гесса: Тепловой эффект (∆Н) химической реакции (при постоянных Р и Т) зависит от природы и физического состояния исходных веществ и продуктов реакции и не зависит от пути её протекания. Следствия из закона Гесса:
Закон Гесса может быть записан в виде следующего математического выражения:
С помощью закона Гесса можно рассчитать энтальпии образования веществ и тепловые эффекты реакций, которые невозможно измерить экспериментально. Термохи́мия — раздел химической термодинамики, в задачу которой входит определение и изучение тепловых эффектов реакций, а также установление их взаимосвязей с различными физико-химическими параметрами. Ещё одной из задач термохимии является измерение теплоёмкостей веществ и установление их теплот фазовых переходов.
|
Вопрос№31 энтропия Второе начало термодинамики Термодинамическая энтропия S, часто просто именуемая энтропия, в химии и термодинамике является функцией состояния термодинамической системы.
2натермод-мики — физический принцип, накладывающий ограничение на направление процессов передачи тепла между телами. Второе начало термодинамики гласит, что невозможен самопроизвольный переход тепла от тела, менее нагретого, к телу, более нагретому. Второе начало термодинамики запрещает так называемые вечные двигатели второго рода, показывая что коэффициент полезного действия не может равняться единице, поскольку для кругового процесса температура холодильника не должна равняться 0. Свободная энергия Гиббса (или просто энергия Гиббса, или потенциал Гиббса, или термодинамический потенциал в узком смысле) — это величина, показывающая изменение энергии в ходе химической реакции и дающая таким образом ответ на принципиальную возможность протекания химической реакции; этотермодинамический потенциал следующего вида:
Энергию Гиббса можно понимать как полную химическую энергию системы (кристалла, жидкости и т. д.) где U — внутренняя энергия, P — давление, V — объем, T — абсолютная температура, S — энтропия. Энергия Гиббса и направление протекания реакции
В
химических процессах одновременно
действуют два противоположных
фактора — энтропийный (TΔS)
и энтальпийный (ΔH).
Суммарный эффект этих противоположных
факторов в процессах, протекающих при
постоянном давлении и температуре,
определяет изменение энергии
Гиббса (G): |
||||||
|
Впорос№35 Закон действующих масс в химической кинетике Закон действующих масс в кинетической форме (основное уравнение кинетики) гласит, что скорость элементарной химической реакции пропорциональна произведению концентраций реагентов в степенях, равных стехиометрическим коэффициентам в уравнении реакции[1]. Это положение сформулировано в 1867 году норвежскими учёными К. Гульдбергом и П. Вааге. Для элементарной химической реакции:
закон действующих масс может быть записан в виде кинетического уравнения вида:
а термодинамический вывод его дан Вант-Гоффом в 1885 году[3]. Пример: для стандартной реакции
константа химического равновесия определяется по формуле
|
Вопрос№34 Правило Вант-Гоффа АРРЕНИУСА УРАВНЕНИЕ - выражает зависимость константы скорости химической реакции k от температуры Т: k = А.ехр(-Е/RT); Е - энергия активации; R - газовая постоянная Правило Вант-Гоффа — эмпирическое правило, позволяющее в первом приближении оценить влияние температуры на скорость химической реакции в небольшом температурном интервале (обычно от 0 °C до 100 °C). Я. Х. Вант-Гофф на основании множества экспериментов сформулировал следующее правило: При повышении температуры на каждые 10 градусов константа скорости гомогенной элементарной реакции увеличивается в два — четыре раза.
Уравнение, которое описывает это правило следующее:
где
|
Вопрос№35 Энергия активации Е активации в элементарных реакциях, минимальная энергия реагентов (атомов, мо-ул и других частиц), достаточная для того, чтобы они вступили в хим. реакцию, т. е. для преодоления барьера на поверхности поте-ьной Е, отделяющего реагенты от продуктов реакции. Потенциальный
барьер - максимум потенциальной
энергии, через который должна пройти
система в ходе элементарного акта
хи-ого превращения. Высота потенциального
барьера для любого пути, проходящего
через переходное состояние, равна
потенциальной энергии в переходном
состоянии. в <i.Аррениуса
уравнение. где Q - .теплота реакции при Т= 0. Качественная одномерная геометрическая иллюстрация связи Е активации с высотой потенциального барьера и теплотой ре-ии представлена на рис., где q -координата реакции ; Е1 и Е2 -уровни Е соответственно основного состояния реагентов и продуктов р-ции.
|
||||||
|
Вопрос№54 Окислительно-восстановительные реакции (ОВР) Окислительно-восстановительные реакции (ОВР). Хим-ие ре-ции, осуще-ющиеся за счет полного или частичного перехода валентных tот одних ат-х или молекуляр-ных частиц к другим, в результате кот-ых изменяются степени ок-ия эл-тов Окисление - процесс отдачи t, с увеличением ст-и оки-я. При восс лении атомы или ионы присоединяют эл-ны. При этом происходит понижение сте-и оки-ния эл-та. Межм-лярные — ре-ции, в кот-ых оки-ющиеся и восст-вающиеся атомы находятся в мо-лах разных веществ, например: Н2S + Cl2 → S + 2HCl Внутримоле-рные — реа-и, в которых окисляющиеся и восстан-ющиеся атомы находятся в моле-ах одного и того же вещества, например: 2H2O → 2H2 + O2 Диспропорционирование (самоокисление-самовосстановление) — реакции, в которых один и тот же элемент выступает и как ок-тель, и как восс-витель, например: Cl2 + H2O → HClO + HCl Репропорционирование (конпропорционирование) — реакции, в которых из двух различных степеней окисления одного и того же элемента получается одна ст-нь оки-я, например: NH4NO3 → N2O + 2H2O
|
Вопрос№55 Метод электронного баланса Метод электронного баланса складывается из следующих этапов: а) записывают схему реакции (формулы реагентов и продуктов), а затем находят элементы, которые повышают и понижают свои степени окисления, и выписывают их отдельно: MnCO3 + KClO3 → MnO2 + KCl + CO2 ClV → Cl−I MnII → MnIV б) составляют уравнения полуреакций восстановления и окисления ClV + 6e− = Cl−I полуреакция окисления MnII − 2e− = MnIV в) подбирают дополнительные множители ClV + 6e− = Cl−I * 1 MnII − 2e− = MnIV * 3 г) проставляют (по найденным множителям) стехиометрические коэффициенты 3MnCO3 + KClO3 = 3MnO2 + KCl + CO2 д) уравнивают числа атомов тех элементов, которые не изменяют своей степени окисления при протекании Получают уравнение химической реакции: 3MnCO3 + KClO3 = 3MnO2 + KCl + 3CO2 е) проводят проверку |
Вопрос№56 Методом полуреакций
Н2S → S + 2H+ Эта схема уравнена по числу атомов. Для уравнивания по числу Н2S - 2е- = S + 2H+ Это первая полуреакция - процесс окисления восстановителя Н2S. Обесцвечивание раствора связано с переходом иона MnO4- (он имеет малиновую окраску) в ион Mn2+ , что можно выразить схемой MnO4- → Mn2+ В кислом растворе кислород, входящий в состав ионов МnО4, вместе с ионами водорода в конечном итоге образует воду. Поэтому процесс перехода записываем так: MnO4- + 8Н+→ Мn2+ + 4Н2О Чтобы стрелку заменить на знак равенства, надо уравнять и заряды. Поскольку исходные вещества имеют семь положительных зарядов (7+), а конечные - два положительных (2+),то для выполнения условия сохранения зарядов надо к левой части схемы прибавить пять электронов: MnO4- + 8Н+ + 5e-= Mn2+ + 4Н2О
|
||||||
|
Вопрос№ 57 Окислительно-восстановительный потенциал. Оки-льно-восстан-льный потенциал. Потенциал электрода в условиях, отличных от стандартных, определяется уравнением Нернста. Понятие оки-ьно-восста-льный потенциал чаще всего используется для характ-ики ве-в, которые требуют использования инертного электрода. Электро-ческий ряд напряжений металлов, ряд актив-ности металлов. Стандартные поте-лы оки-льно-восс-тель-ных систем, расположенные по убывающей величине положи-тельного потенциала и возрастающей величине отрицательного потенциала см. в прил. 5. Такому расположению стандартных потенциалов отвечает падение оки-льной и рост восстан-льной активности. По величинам окисл-льно-восстан-льных пот-алов можно судить о направлении оки-ьно-восстан-льных процессов. Чем ниже значение Е0, тем более сильным восста-лем является металл, и тем более слабым окислителем является соответствующий гидратированный ион. И наоборот, чем выше значение Р, тем более слабым восст-елем является ме-талл, и тем более сильным окислителем будет соответствующий гидратированный ион. Например, в соответствии со значениями Е0 (Zn2+/Zn)= -0,76 в цинк более сильный вос-тель, чем медь Е0 (Cu2+/Cu) =+0,34 в и следовательно, Zn будет вытеснять Cu из раствора ее соли Cu2+: Zn(кр) + Cu2+(P) ® Cu(кр) + Zn2+(p) Хлор (E0 = +1,36 в) более сильный окислитель, чем бром (Е0 = +1,07в) и, следовательно, будет вытеснять бром из раство-ров, содержащих ионы ^ r ® 1/2Br2 ^ + CI Взаимодействие с водой Активные металлы (щелочные металлы) взаимодействуют с водой при обычных условиях с образованием гидроксидов и выделением водорода: 2Nа + 2Н2О == 2NаОН + Н2 Са + 2Н2О = Са(ОН)2 + Н2 2Аl + 6Н2O = 2Аl(ОН)3 + ЗН2 Менее активные металлы взаимодействуют с водой при повышенной температуре с выделением оксида металла и водорода: Zn + Н2О = ZnО + Н2 Мg + Н2О = МgО + Н2 Менее активные металлы, стоящие в электрохимическом ряду напряжений металлов после водорода, не вытесняют его из воды. Это относится к меди, ртути, серебру, золоту и платиновым металлам. |
Вопрос№58. Уравнение Нернста Уравнение Нернста. Уравнение, определяющее зависимость электродного потенциала любой окислительно-восстановительной системы, находящейся в нестандартных условиях, от концентра-ций окисленной и восстановленной форм вещества и температуры:
где
Если в формулу Нернста подставить числовые значения констант R и F и перейти от натуральных логарифмов к десятичным, то при T = 298K получим
Взаимодействие с растворами солей Металлы, находящиеся в электрохимическом ряду напряжений металлов левее, восстанавливают металл, находящийся в этом ряду правее данного металла. Рb(NО3)2 + Zn = Zn(NО3)2+ Рb Fе + СuSО4 = FеS04 + Сu |
Вопрос№59 Химические источники тока Хим-ие источники тока. Устройства, в которых хими-ческая энергия окис-ьно-восстан-льных реакций непосредственно преобразуется в электрическую энергию. Действие хим-их источников тока основано на пространственном раз-делении окис-ных и восс-ельных ре-ий, происхо-дящих на электродах. Примером хим-их источников тока являются гальванические элементы. Гальванический элемент. Химический источник электричес-кого тока, работающий за счет прямого превращения хим-ой энергии в элект-ую. На электродах гальванического элемента протекают окислителъно-восст-еакции, причем процесс окисления пространственно разделен от процесса восстановления. Схема гальванического элемента представлена на рис. 50, где цинко-вый и медный электроды находятся в растворе своих сульфатов.
ная черта обозначает электролитический контакт между элект-родами, который препятствуя смешению электролитов, одно-временно обеспечивает возможность протекания электрического тока во внутренней цепи гальванического элемента.
Взаимодействие с кислотами Металлы, стоящие в электрохимическом ряду напряжений металлов левее Н, вытесняют его из разба-ных кислот 2Nа + 2НС1 = 2NaСl + Н2 Мg + 2НС1 = МgСl2 + Н2 Fе + 2НС1 = FеСl2 + Н2 Fе + Н2SО4(разб.)= FеSО4 + Н2 С более акт-ми ме-ми разбавленная серная кислота реагирует по-разному: 3Zn + 4Н2SО4(разб.) = 3ZnSО4 + S + 4Н2О 4Zn + 5Н2SО4(сильно разб.) = 4ZnSО4+ Н2S + 4Н2О Ме-ы, стоящие в элект-ческом ряду напряжений ме-в до серебра включительно, окисляются концен-ой серной и азотной (разбавленной и концентрированной) кис-ми с образованием разных соединений в зависимости от концентрации кислоты: 2Fе + 6Н2SО4(конц.)= Fе2(SО4)3 + 3SО2 + 6Н2О Сu + 2Н2SО4(конц.)= СuSО4 + SО2 + 2Н2О Конце-нная азотная кислота пассивирует многие ме-лы на холоде: железо, хром, а алюминий пассивирует холодная конц-нная и сильно разбавленная азотная кислота. Конц-анная азотная кислота пассивирует многие металлы на холоде: железо, хром, а алюминий пассивирует холодная концентрированная и сильно разбавленная азотная кислота. При вза-твии ме-ов с конце-ной азотной кислотой выделяется оксид азота (IV) NО2: Сu + 4НNО3(конц.)= Сu(NО3)2 + 2NО2 + 2Н2О При вза-йствии разб-ой азотной кислоты: — с активными металлами выделяется оксид азота (I) N2O: 4Мg + 10НNО3(разб.)= 4Мg(NО3)2 + Н2О + 5Н2О — с малоактивными металлами образуется оксид азота (II) NO: 3Cu + 8HNО3(разбавленный) = 3Cu(NО3)2 + 2NО + 4Н2О С сильно разбавленной азо-ой кис-ой активные ме-ы взаи-твуют с образованием иона аммония, дающего с азотной ки-ой нитрат аммония: 4Zn + 10HNО3(сильно разб.) = 4Zn(NО3)2 + NН4NО3 + ЗН2О Обычно одновременно образуются несколько продуктов. Золото и платина растворяются только в царской водке (один V концентрированной (63%-ной) азотной кислоты и три объема конц-нной соляной ки-ты), с образованием комплексных соединений золота и платины: Аu + HNО3 + 4НСl = Н[АuСl4] + NO + 2Н2О ЗРt + 4HNО3 + 18НС1 = ЗН2[РtС16] + 4NО + 8Н2О
|
||||||
|
Электрохимическая коррозия. Самопроизвольное разруше-ние мета-в в присутствии элек-ита в результате образования гальванического элемента (гальванической пары). Представляет со-бой оки-ельно-восста-ный гетерогенный процесс, ко-торый в отличие от хим-ой коррозии происходит в средах, проводящих ток. Очень часто наблюдается в окружающей среде. Важное отличие электр-ческой коррозии от химической со-стоит в том, что в первом случае процессы окисления и восста-новления протекают на разных металлах или разных по химичес-кой активности участках одного и того же металла и связаны с переносом электронов, т.е. с возникновением электрического тока. На аноде гальванического элемента происходит окисление м-ла с образованием катионов металла или нерастворимых про-дуктов, например, ржавчины. Освобождающиеся электроны при наличии проводящей среды перемещаются от анода к катоду, на котором происходит восстановление окислителя. Растворенный кислород и ионы водорода— важнейшие окислители, вызываю-щие коррозию. Электрохимическая коррозия одна из главней-ших причин разрушения металлических изделий и загрязнения окружающей среды соединениями металлов.
|
электролизом. Хим-ая ре-ия, протекающая под дейс-м элек-ского тока, назы-ся электролизом. Если постоянный элек-ий ток пропускать через систему, состоящую из двух проводников первого рода (мет-ы) и проводника второго рода (ра-ор или ра-лав электролита *, в который они опущены), то на границе их раздела возникают элект-ские процессы, составляющие сущность элек-иза. Так, при электролизе расплава хлорида меди (II) электродные процессы могут быть выражены полуреакциями: на катоде (–) Сu2+ + 2e Cu0 – катодное восстановление на аноде (+) 2 Cl– – 2e Cl2 – анодное окисление Общая реакция электрохимического разложения вещества представляет собой сумму двух электродных полуреакций, и для хлорида меди она выразится уравнением: Cu2+ + 2 Cl– Cu + Cl2 При электролизе щелочей и солей оксокислот на аноде выделяется кислород: 4 OH– – 4e 2 H2O + O2 2 SO42– – 4e 2 SO3 + O2
|
Первый закон электролиза Фарадея: масса вещества, осаждённого на электроде при электролизе, прямо пропорциональна количеству электричества, переданного на этот электрод. Под количеством электричества имеется в виду электрический заряд, измеряемый, как правило, в кулонах. Второй закон электролиза Фарадея: для данного количества электричества (электрического заряда) масса химического элемента, осаждённого на электроде, прямо пропорционально эквивалентной массе элемента. Эквивалентной массой вещества является его молярная масса, делённая на целое число, зависящее от химической реакции, в которой участвует вещество. Законы Фарадея можно записать в виде следующей формулы:
где: m — масса осаждённого на электроде вещества в граммах Q — полный электрический заряд, прошедший через вещество F = 96,487 C mol−1 — постоянная Фарадея M — молярная масса вещества z — валентное число ионов вещества (число электронов на один ион).
|
||||||
|
|
|
|
||||||
|
|
|
|
||||||
|
|
|
|