
1й семестр / Lab_01-07% / LAB1-07
.DOCРязанская государственная радиотехническая академия
Кафедра физики
Отчет
О лабораторной работе 1-7.
«Определение отношения Cp/Cv для воздуха методом Клемана-Дезорма»
Выполнил ст. 012 гр.:
Козлов Сергей Анатольевич
Проверил:
Рязань 2000 г.
Цель работы: Изучение различных изопроцессов, протекающих в газах; экспериментальное определение Cp/Cv для воздуха.
Приборы и принадлежности: прибор Клемана Дезорма, манометр, насос, секундомер.
Элементы теории и метод эксперимента
Теплоемкостью Cm, какого либо тела называется величина, численно равная количеству теплоты которое нужно сообщить этому телу, чтобы повысить его температуру на один Кельвин:
Cm=Q/dT
Теплоемкость единицы массы вещества Суд называется удельной теплоемкостью, теплоемкость единицы количества вещества (одного моля) C – молярной. Очевидно, что C=Cудm , где m – молярная масса вещества.
Согласно первому закону термодинамики количество теплоты Q , переданное газу, затрачивается на увеличение его внутренней энергии dU и на работу A , совершаемую газом против внешних сил:
Q=dU+A
Отличия в записи (Q,A,dU) малых величин количества теплоты, работы и изменения внутренней энергии выражают физическое отличие этих величин, внутренняя энергия системы является функцией ее состояния, количество теплоты и работа являются функциями процесса.
По определению теплоемкости
C=Q/dT=dU/dT+A/dT
Поскольку передаваемое количество теплоты Q зависит от характера происходящего при этом процессом (способа нагрева газа), теплоемкость C также является функции процесса, один и тоже газ в зависимости от происходящего в нем при нагревании процесса имеет различные теплоемкости.
Состояние газа как термодинамической системы определяется параметрами: давление P , объемом V, температурой T , связь которых определяется уравнением состояния. Уравнение состояния идеального газа является уравнение Менделева-Клапейрона, которое для одного моля газа имеет вид
PV=RT
Далее для простоты будем считать, что количество газа остается постоянным и равным одному молю.
Процессы, протекающие в газе при неизменном значении одного из термодинамических параметров его состояния, называются изопроцессами.
|
t,c |
Значение ht ,мм |
<ht>, мм |
Ln<ht> |
||
|
1 |
2 |
3 |
|||
|
16 |
28 |
22 |
25 |
25 |
3.21 |
|
12 |
29 |
27 |
31 |
29 |
3.36 |
|
8 |
33 |
34 |
35 |
34 |
3.52 |
|
4 |
40 |
41 |
39 |
40 |
3.68 |
-
Практическое определение коэффициента.
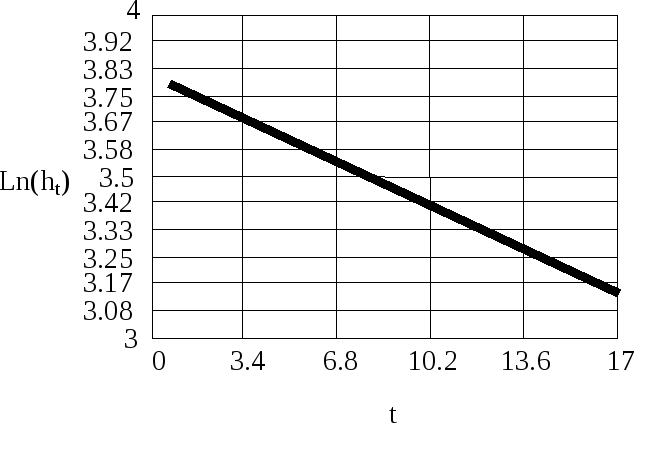
![]()
![]()
![]()
![]() мм
мм
![]() мм
мм
![]() мм
мм
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
-
Теоретическое определение
i=5 -Степень свободы молекул воздуха
Cv=iR/2 Cp=(i+2)R/2
Cp/Cv=1,4
|
Практическое значение |
Теоретическое значение |
|
1,117480 0,000025 |
1,4 |
