
Проблемы экологии автотранспорта / volume1
.pdfкристаллические вещества, обладают высокой стабильностью при хранении, как в сухом виде так и водных растворов. Порошкообразный вид продукта позволяет выпускать его в форме таблеток.
В ходе проведения микробиологических исследований, установлена высокая бактерицидная активность водных растворов пероксидных соединений титана по отношению к микроорганизмам Escherichia coli и Staphylococcus aureus, как в простых так и в коллоидных системах и молочнокислым бактериям. Полученные результаты указывают на потенциальную возможность создания на основе пероксидных соединений титана эффективных и нетоксичных дезинфицирующих, дезодорирующих, антисептических и консервирующих составов, которые могут найти применение в медицине и бытовых средствах.
ВЗАИМОДЕЙСТВИЕ ТРИФЕНИЛФОСФАЗИНОВ АДАМАНТАНОИЛДИАЗОМЕТАНА С ПРОИЗВОДНЫМИ ФУРАН-2,3-ДИОНА
Кузнецов А.С.1, Пулина Н.А.1, Рубцов А.Е.2
1ГБОУ ВПО «Пермская государственная фармацевтическая академия Минздравсоцразвития России» 614990, Россия,
г. Пермь, ул. Полевая, 2, alexanderiv.88@mail.ru
2 ГБОУ ВПО «Пермский государственный национальный исследовательский университет», 614990, Россия,
г. Пермь, ул.Букирева, 15
Ранее установлено, что взаимодействие трифенилфосфазинов диазосоединений с кислородсодержащими 2,3-диоксо- гетероциклами протекает по механизму аза-Виттига с образованием соответствующих 2-метиленгидразонопроизвод- ных [1]. Введение адамантана в качестве фармакофорного фрагмента позволяет получать соединения с потенциальной биологической активностью. Нами проведён ряд превращений трифенилфосфазинов 3-R-адамантаноилдиазометана (1) в
111
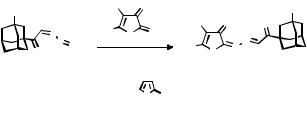
реакции с производными 4-R-фуран-2,3-диона (2) и выделены соединения 3:
Строение гидразонопроизводных 3 доказано ИК-, ЯМР1Н- спектроскопией. Изучается противомикробная, анальгетическая, противовоспалительная активность соединений 3.
Работа выполнена при финансовой поддержке РФФИ (11-03-00882-а).
[1] Залесов В.В., Пулина Н.А., Андрейчиков Ю.С. ЖОрХ, 1989, 25 (5), 1054-1059.
ВЛИЯНИЕ СТЕПЕНИ НЕНАСЫЩЕННОСТИ ЖИРНЫХ КИСЛОТ НА РЕЗУЛЬТАТ ИХ ВЗАИМОДЕЙСТВИЯ С м-ХЛОРНАДБЕНЗОЙНОЙ КИСЛОТОЙ И ОЗОНОМ
Куковинец О.С., Плакушкина Д.Ю., Ямансарова Э.Т., Абдуллин М.И.
ФГБОУ ВПО «Башкирский государственный университет», 450014, Россия, г. Уфа, ул. Мингажева, 100, if_bsu@mail.ru
Наиболее важными продуктами окисления высших жирных кислот in vivo являются оксилипины, к которым относятся ацетогенины, тромбоксаны, лейкотриены и простаноиды [1]. Известно также, что важное значение в химии живых систем имеют перекисные соединения, образующиеся при окислении высших жирных кислот, которые оказывают влияние на функциональное состояние клеточных мембран, способствуют интенсификации ферментных систем, оказывают регенеративное и ранозаживляющее действие.
Путём направленного введения кислородных функций в различные положения углеводородного остатка жирной кислоты можно получить соединения, являющиеся представителями многочисленного класса окисленных липидов [2]. Кроме этого
112
введение гидроксильной функции, склонной к образованию водородных связей, в структуру жирной кислоты при кристаллизации позволяет упорядочить структуру кристалла и получить материалы по своим свойствам приближенные к свойствам жидких кристаллов. [3]
При изучении процессов окисления ненасыщенных жирных кислот нами осуществлено два подхода. Во-первых, эпоксидирование линолевой и линоленовой кислот действием m-PBCA. Во-вторых, дозированное окисление озоном.
Регулированием соотношения реагента и субстрата реакция взаимодействия с окислителем может быть направлена в сторону образования продуктов моно-, ди- и триэпоксидирования. Установлено, что моноэпоксидирование метилового эфира линоленовой кислоты нерегиоспецифично и образуется смесь моноэпоксидов. О большей реакционной способности ∆12-двойной связи для продукта эпоксидирования линоленоата говорит наличие практически идентичных сигналов углеродных атомов двойных связей при 123.7 (123.8) и 132.3 (132.4) м.д. и единственного сигнала углеродных атомов эпоксидного цикла. В качестве основного продукта эпоксидирования линоленовой кислоты на две двойные связи был выделен диэпоксид, с симметричным расположением эпокси-групп по первой и второй двойным связям, что свидетельствует о влиянии реакционной среды на конформационные изменения молекулы в растворе.
С целью введения триоксоланового цикла в структуру эфиров олеиновой, линолевой и линоленовой кислот изучено их взаимодействие с эквимолярным количеством озона в апротонном растворителе при -25 - 0ºС. Обнаружено, что динамика изменения перекисного числа зависит от степени ненасыщенности жирной кислоты. Увеличение числа метиленразветвлённых двойных связей в её молекуле способствует стабилизации перекисей, а в случае линоленовой кислоты и их накоплению во времени, в то время как озониды олеиновой кислоты неустойчивы и быстро разлагаются при комнатной температуре.
С использованием данных ЯМР1Н и 13С спектроскопии предложен вероятный путь распада озонида олеиновой кислоты.
113
По-видимому, накопление перекисных соединений при озонолизе линоленовой кислоты катализируется образующимися в ходе распада озонидов перекисными соединениями.
[1] Племенков В.В. Введение в химию природных соединений. - М.: Химия, 2001. - 114 с.
[2]Van Ornum S.G., Champeau R.M., Pariza R. Ozonolysis Application in Drug Synthesis. Chem. Rev., 2006. – P. 106 .
[3] Charman W. // J. Med. Chem., 2002. – P. 4321.
ПОВЫШЕНИЕ ОСНОВНОСТИ ГИДРОКСОХЛОРИДА АЛЮМИНИЯ
Лайнер Ю.А. 1, Мильков Г.А. 1, Самойлов Е.Н. 1, Усманов Р.С.1, Гетманцев С.В. 2, Сычев А.В. 2, Рашковский Г.Б. 2
1Федеральное государственное бюджетное учреждение науки Институт металлургии и материаловедения им. А.А. Байкова Российской академии наук (ИМЕТ РАН), 119991, Россия, г. Москва, Ленинский пр., 49, lainer4@yandex.ru
2ОАО «Аурат», 125438, Москва, 4-ый Лихачевский пер., д.6; test@aurat.ru
В настоящее время в качестве коагулянта для отчистки воды широко используется гидроксохлорид алюминия (ГОХА) повышенной основности. Перспективными методами повышения его основности являются электрохимические и с введением металлического алюминия.
Выполнены работы по изучению электрохимического поведения металлического алюминия в растворах гидроксохлорида алюминия, которые установили, что скорость электрохимических процессов катодного удаления ионов водорода определяется величиной предельного катодного тока. Величина предельного тока катодного процесса удаления ионов водорода определяется концентрацией электролита, перемешиванием раствора, температурой. С повышением температуры требуется большая величина катодного тока для удаления ионов водорода из объема раствора, а чем ниже
114
концентрация электролита Al(OH)Cl2, тем большая степень основности образующегося Al(OH)2Cl. Оптимальные режимы проведения реакции удаления ионов водорода по мембранной технологии составляют: концентрация Al(OH)Cl2 3-4 г/л, сила тока – 1-3 А·дм2 при температуре 60-70оС. Проведены исследования по повышению основности растворов гидроксохлорида алюминия в лабораторном электродиализаторе с промышленными растворами методами электролиза и электродиализа. Электродиализатор состоит из четырех камер, разделенных тремя мембранами. I и II, III и IV камеры разделены анионитовой мембраной МА-40; II и III камеры разделены катионитовой мембраной МК-40. Для получения среднеосновного гидроксохлорида алюминия из низкоосновного необходимо в рабочую камеру с гидроксохлоридом ввести 1 катион алюминия и 3 аниона гидроксила по схеме: Al(OH)Cl2 + 1·Al+3 + 3·OH- → 2·Al(OH)2Cl. В процессе получения высокоосновного гидроксохлорида алюминия необходимо ввести 3 катиона алюминия и 9 анионов гидроксила по схеме: Al(OH)Cl2 + 3·Al+3 + 9·OH- → 2·Al2(OH)5Cl. Исследовано влияние концентрации взаимодействующих растворов, конструкции и габаритов камер, силы тока и напряжения на выпрямителе на изменение рН растворов, основности растворов гидроксохлорида алюминия, объемов реагирующих соединений в камерах – серной кислоты, сульфата алюминия, гидроксохлорида алюминия, натриевой щелочи.
В условиях ведения процесса методом электролиза и электродиализа с растворами 5 и 10% Al2O3 достигнуто повышение атомного отношения алюминия к хлору от 0,56 до 0,76 относительных единиц или условно повысилось на 36%. Коэффициент использования электричества по способу электродиализа по оценке составил около 70%.
Другим методом повышения основности является взаимодействие металлического алюминия с раствором гидроксохлорида алюминия. Разработана аппаратурнотехнологическая схема повышения основности растворов с использованием металлического алюминия в реакторе с фонтанирующим слоем. Рекомендованы марки сплавов алюминия для ведения этого процесса.
115

3-МЕТИЛ-4-НИТРО-3-ТИОЛЕН-1,1-ДИОКСИД В РЕАКЦИЯХ С АЦИЛГИДРАЗИНАМИ
Лапшина Л.В., Ефремова И.Е.
ФГБОУ ВПО «Российский государственный педагогический университет имени А.И. Герцена», 191986, Россия,
Санкт-Петербург, наб. р. Мойки, д. 48; kohRGPU@yandex.ru
4-Нитро-3-тиолен-1,1-диоксиды являются активными гетероциклическими сульфонитроалкенами, отличающимися разнообразием направлений реагирования с нуклеофилами. Новые варианты превращений выявлены при изучении взаимодействия 3-метил-4-нитро-3-тиолен-1,1-диоксида (НТД) с ацилгидразинами.
Показано, что в реакциях НТД 1 с ароилгидразинами (18°С, 1 ч) образуются продукты присоединения 2-5, а в случае гидразидов алифатических кислот выделяются смеси, содержащие аддукты 6-8 и линейные сульфоны – ацилгидразоны (2-нитроэтилсульфонил)пропанона 9-11. Нагревание этих смесей приводит к индивидуальным сульфонам 9-11. Аналогичные продукты – ароилгидразоны 12-15 получены при кипячении аддуктов 2-5 в этаноле (0.5 ч).
Наблюдаемый тандемный процесс включает, по-видимому, стадии AdN и последующего раскрытия сульфоланового цикла промежуточных аддуктов по связи С3-С4. Мягкие условия этих превращений, очевидно, связаны с влиянием нитрогруппы.
116
ОПРЕДЕЛЕНИЕ ГРАНИЧНЫХ УСЛОВИЙ ОБРАЗОВАНИЯ СУЛЬФИДОВ ИНДИЯ И МЕДИ ГИДРОХИМИЧЕСКИМ ОСАЖДЕНИЕМ
Левашова Е.В., Туленин С.С., Марков В.Ф.
ФГАОУ ВПО «Уральский федеральный университет имени первого Президента России Б.Н. Ельцина», 620002, Россия,
Екатеринбург, ул. Мира, 19; elena-levashova@mail.ru
Полупроводниковому соединению CuInS2 уделяется повышенный интерес, так как обладает уникальными свойствами, такими, как: оптимальная ширина запрещенной зоны (Eg = 1.55 эВ) [1,2], большой коэффициент оптического поглощения ( а > 10 см−1) и высокая стабильность характеристик.
Метод гидрохимического осаждения [3,4] был разработан в середине прошлого столетия. Оценивая приемущества метода, нельзя не отметить его высокую производительность, простоту технологического оформления, возможность нанесения пленок на поверхность сложной формы и различной природы.
Расчет базировался на равенстве произведения растворимости твердой фазы сульфида металла ПРMe2Sn ,
являющегося при данной температуре постоянной величиной, произведению активной незакомплексованной формы металла и
иона сульфидной |
серы в |
растворе |
(ионное произведение |
ПИMe2Sn ). Учет |
степени |
пересыщения ∆кр позволяет |
|
значительно повысить точность прогнозов: |
|||
|
ПИMe2Sn |
= ПРMe2Sn |
.∆кр . |
В основу термодинамического анализа условий получения сульфида металла положено суммарное уравнение его образования в результате взаимодействия комплексной формы металла с тиомочевиной в щелочной среде по реакции:
MeLn2+ + N2H4CS + 4ОН− = MeS + nL + CN22− + 4H2O,
где МеLn2+ – комплексная форма металла.
117

Для определения областей образования сульфидов индия и меди использовали уравнение
pCH = |
1 |
pПΡMe S |
|
− pα |
|
n+ − |
n |
( pkH |
S −2 pHH + 1 pKC − |
1 p[N2 H4CS] + 1 |
p |
βц |
) −∆, |
||
|
n |
Me |
|
|
|||||||||||
|
m |
2 |
|
|
m |
2 |
2 |
2 |
H |
2 |
|
βS |
|||
|
|
|
|
|
|
|
|
|
|||||||
Анализируя это выражение, можно сказать, что граничные условия образования конкретного сульфида металла определяются соотношением основных параметров системы: рН среды, концентрации тиомочевины, начальной концентрации соли металла и устойчивостью комплексов металла, определяемой концентрацией и природой лиганда.
Прогнозируемые условия осаждения представлены на рис. в координатах рСн=f (pH).
Как видно из рисунка образование In2S3 практически исключено, так как более устойчивой фазой является гидроксид индия. Процесс формирования Cu2S (кривая 3) имеет высокую вероятность образования в широком интервале рН. Образование же цианамида меди исключается.
Отмеченные особенности затрудняют возможность совместного осаждения In2S3 и Cu2S. Необходим тщательный подбор условий образования In2S3, величины рН и температуры.
Рис. Граничные условия образования сульфидов In2S3 (1) и Cu2S (3)
гидроксидов In(OH)3 (2), CuOH (4), CuCN2 (5)
[1]Завражнов А.Ю., Наумов А.В., Сергеева А.В. и др. T–x-фазовая диаграмма системы In–S // Неорганические материалы. 2006.-T. 42. № 12. C. 1420–1424
[2]Марков В.Ф., Маскаева Л.Н., Иванов П.Н. Гидрохимическое осаждение пленок сульфидов металлов: моделирование и эксперимент. Екатеринбург:
УрО РАН. 2006. 218 с.
118

ПРЕВРАЩЕНИЯ ПЕРЕКИСНЫХ ПРОДУКТОВ ОЗОНОЛИЗА МОНОТЕРПЕНОВ В СМЕСИ МЕТАНОЛ – ВОДА
Легостаева Ю.В., Гарифуллина Л.Р., Боцман Л.П., Ишмуратов Г.Ю.
ФГБУН Институт органической химии Уфимского научного центра Российской академии наук, 450054, Россия, г. Уфа, пр.
Октября, 71; insect@anrb.ru
В данном сообщении представлены результаты исследования превращений перекисных продуктов озонолиза природных бициклических монотерпенов [∆3-карена (ee 100%) (1) и (-)-α- пинена (ee 86%) (4)] под действием гидрохлоридов семикарбазида и гидроксиламина в смеси метанол-вода. Установлено, что при использовании солянокислого семикарбазида образуются кетоэфиры (2) и (5), гидроксиламина
– кетоксимоэфиры (3) и (6).
|
|
|
|
|
0 |
|
|
1. O /MeOH-H O, 00C |
|
|
|
||
|
|
|
CO Me 1. O3/MeOH-H2O, 0 C |
3 |
2 |
|
|
|
CO2Me |
||||
|
|
|
|
|
|
||||||||
O |
2 |
|
|
|
|
2. NH2OH |
|
|
|
|
|||
|
|
2. NH2C(O)NHNH2 |
HCl |
|
HCl |
|
N |
||||||
|
|
|
|
|
|
|
1 |
|
|
|
HO |
||
|
2; 65% |
|
|
|
|
|
|
3; 68% |
|||||
|
|
|
|
|
|
|
|
||||||
[ α ]D23 -21o (c 0.0093; CH2Cl2) |
|
|
|
|
|
[ α]D23 -5o (c 0.2325; CH2Cl2) |
|||||||
O |
|
|
1. O3/MeOH-H2O, 00C |
|
1. O3/MeOH-H2O, 00C |
HO N |
|||||||
|
|
|
|
|
|
|
|||||||
|
|
|
CO2Me |
HCl |
|
|
|
|
|
|
CO2Me |
||
|
|
2. NH2OH |
HCl |
|
|
|
|||||||
|
|
|
2. NH2C(O)NHNH2 |
|
|
|
|
|
|||||
|
5; 69% |
|
|
|
4 |
|
|
|
6; 64% |
||||
[ α ]D23 -24.8o (c 0.7345; CH2Cl2) |
|
|
|
|
|
[ α ]D23 -3.7o (c 0.9268; CH2Cl2) |
|||||||
119

РЕАКЦИИ 1-АЛКЕНИЛТРИХЛОРФОСФОНИЙ ГЕКСАХЛОРФОСФАТОВ
С 2,2',2"-НИТРИЛОТРИЭТАНОЛОМ
Лукичева Н.А., Митрасов Ю.Н., Кондратьева О.В., Гордеева И.В., 1Каткова Е.А., 1Михайлова Т.В.
ФГБОУ ВПО «Чувашский государственный педагогический университет им. И.Я. Яковлева», 428000, Россия, г. Чебоксары,
ул. К. Маркса. 38; mitrasov_un@mail.ru;1МБОУ «Лицей №2», 428000, Россия, г. Чебоксары, ул. Шевченко, 2
В продолжение работ [1, 2] по поиску эффективных N- функционализированных кислородсодержащих трансформеров нами изучено взаимодействие 1-алкенилтрихлорфосфоний гексахлорфосфатов (1а-в) с 2,2',2"-нитрилотриэтанолом.
Нами показано, что гексахлорфосфаты (1а-в) с высокой скоростью реагируют с 2,2',2"-нитрилотриэтанолом при мольном соотношении реагентов 3:2 и температуре 0-10ºС. Реакции в среднем завершались через 0,1–0,2 ч после смешения реагентов. При этом образовались прозрачные растворы и выпадал осадок, который представляет собой гидрохлорид три(2-хлор-этил)аммония. После отделения осадка перегонкой фильтрата с высокими выходами были получены дихлорангидриды 1-алке-нилфосфоновых кислот (2а-в).
3 RCH=CHPCl3 PCl6 |
+ 2 (HOCH2CH2)3N |
|
3 |
3 RCH=CHP(O)Cl2 + 2 (ClCH2CH2)3NHCl |
-3 POCl |
||||
1а-в |
|
|
|
2а-в |
везде: R=C6H5 (а), С2Н5О (б),C4H9O (в).
Строение 1-алкенилхлорфосфонатов (2а-в) подтверждали данными ИК, ЯМР 1Н и 31Р спектров, а состав – элементным анализом.
[1] Митрасов Ю.Н., Анисимова Е.А., Колямшин О.А., Кормачев В.В. ЖОХ, 1998, 68 (1) 164.
[2] Митрасов Ю.Н., Кондратьева О.В., Лукичева Н.А., Гордеева И.В.
ЖОХ, 2011, 81 (4), 687-688.
120
