
- •Аналитическая химия
- •Часть 1
- •Isbn 985-466-015-х
- •Раздел 1
- •Глава 1
- •Разложение пробы
- •1.3. Виды анализа
- •Экстракционная фотометрия
- •Глава 2
- •2.1. Аналитические реакции
- •2.2. Систематический и дробный анализ
- •Комплексообразование
- •2.3. Общая характеристика, классификация и способы обнаружения катионов
- •2.4. Общая характеристика, классификация и способы обнаружения анионов
- •Глава 3
- •3.1. Общая характеристика химического равновесия. Константа химического равновесия
- •3.2. Активность и коэффициент активности
- •3.3. Отклонения от идеальности в растворах сильных электролитов
- •3.4. Виды констант химического равновесия, используемые в аналитической химии
- •3.5. Общие принципы расчёта состава равновесных систем
- •Глава 4
- •4.1. Важнейшие теории кислот и оснований
- •4.2. Количественное описание силы кислот и оснований
- •4.3. Влияние растворителя на кислотно-основные свойства растворённого вещества
- •4.4. Нивелирующее и дифференцирующее действие растворителя. Сильные и слабые кислоты и основания
- •4.5. Расчёт рН водных растворов различных прото- литов
- •4.6. Расчёт состава равновесных смесей протолитов при заданном значении рН
- •4.7. Кислотно-основные буферные растворы
- •Глава 5
- •5.1. Понятие о комплексном соединении
- •5.2. Классификация комплексных соединений
- •5.3. Равновесия в растворах комплексных соединений
- •Общая константа образования
- •5.4. Влияние различных факторов на комплексообразование в растворах
- •5.5. Применение органических реагентов в аналитической химии
- •Лиганды с одним типом донорных атомов о,о-лиганды
- •Шестичленные циклы
- •Органические реагенты
- •6.1. Произведение растворимости малорастворимого электролита
- •Глава 6
- •6.2. Растворимость
- •6.3. Влияние различных факторов на растворимость
- •6.4. Общие принципы растворения осадков малорастворимых электролитов
- •Глава 7
- •7.1. Общая характеристика окислительно-восстановительных реакций
- •7.2. Количественная оценка окислительно-восстановительной способности веществ
- •7.3. Влияние различных факторов на протекание окислительно-восстановительных реакций
- •Глава 8
- •8.1. Отбор пробы
- •Анализируемым образец
- •I эмпирический
- •Генеральная проба
- •Лабораторная проба
- •8.2. Разложение пробы
- •9.1. Общая характеристика и классификация
- •Глава 9
- •9.2. Жидкость - жидкостная экстракция
- •Реэкстракт
- •Реэкстракция
- •Сложные эфиры фосфорной кислоты, фосфоновых, фосфиновых кислот, фосфиноксиды, сульфоксиды, диантипирилметан
- •Третичные амины, четвертичные аммониевые соли, соли тетрафениларсония и тетрафенилфосфония.
- •Глава 10
- •10.1. Приближённые вычисления и значащие цифры
- •3 Значащие цифры
- •1 Значащая цифра
- •10.2. Понятие об аналитическом сигнале
- •10.3. Методы расчёта концентрации вещества по величине аналитического сигнала
- •10.4. Неопределённость и погрешности измерений
- •10.5. Некоторые основные положения математической статистики, используемые в аналитической химии
- •10.6. Пример статистической обработки результатов измерений. Исключение промахов
- •10.7. Основные характеристики методики анализа
- •Раздел 2
- •Глава 11
- •11.3. Понятие о механизме образования осадка
- •11.4. Коллоидная стадия образования осадка
- •11.5. Причины загрязнения осадка и способы их устранения
- •11.6. Основные этапы методики гравиметрического определения методом осаждения
- •11.7. Гравиметрия в фармацевтическом анализе
- •Глава 12 общая характеристика титриметрических методов анализа
- •12.1. Основные понятия титриметрии
- •Исчезновение окраски фенолфталеина
- •Появление розовой окраски раствора
- •12.2. Классификация титриметрических методов анализа и способов титрования
- •12.3. Стандартные растворы и стандартные вещества
- •12.4. Расчёты, связанные с приготовлением растворов титрантов и титрованием
- •Vисх_mрисх_m(hCl) _n(hCl) - m(hCl) _c(hCl) - V - m(hCl) _p _ra(hCl) -p_ ra(hCl) -p _p-ra(hCl)
- •Глава 13 кислотно-основное титрование
- •13.1. Титранты и стандартные вещества
- •13.2. Обнаружение конечной точки титрования. Кислотно-основные индикаторы
- •13.3. Кривые титрования
- •13.4. Факторы, влияющие на величину скачка титрования
- •0,1МNaOh (1), 0,001мhCl 0,001мNaOh (2) и или основания (рис. 13.4).
- •0,1МhCl 0,1мNaOh (3)Прямое титрование таких
- •13.5. Погрешности титрования
- •13.6. Некоторые случаи практического применения кислотно-основного титрования в водных растворах
- •Глава 14 кислотно-основное титрование в неводных средах
- •14.3. Применение в фармацевтическом анализе
- •Глава 15 комплексометрическое титрование
- •15.1. Общая характеристика
- •15.2. Меркуриметрическое титрование
- •Ind HgInd фиолетовый Ind жёлтыйHg[Fe(cn)sNo]
- •15.3. Комплексонометрическое титрование
- •Глава 16
- •16.3. Меркурометрическое титрование
- •Глава 17
- •17.1. Общая характеристика и классификация
- •17.2. Кривые титрования
- •17.3. Способы обнаружения конечной точки титрования. Окислительно-восстановительные индикаторы
- •Глава 18
- •18.1. Иодометрическое титрование
- •18.2. Хлориодометрическое титрование
- •18.3. Иодатометрическое титрование
- •18.4. Броматометрическое титрование
- •18.5. Нитритометрическое титрование
- •I" крахмал избыток NaNo2 i4
- •18.6. Перманганатометрическое титрование
- •18.8. Дихроматометрическое титрование
- •18.8. Цериметрическое титрование
- •Раздел 3
- •Глава 19
- •19.1. Природа и свойства электромагнитного излучения
- •19.2. Классификация спектроскопических методов анализа
- •Глава 20
- •20.2. Отклонения от основного закона светопоглощения
- •20.3. Атомно-абсорбционная спектроскопия
- •20.4. Молекулярная абсорбционная спектроскопия в уф- и видимой области
- •Сурьмяно-цезиевый фотоэлемент кислородно-цезиевый фотоэлемент
- •20.4.3. Практическое применение и основные приёмы фотометрического анализа
- •Измерение светопоглощения хлороформного экстракта
- •Метод отношения пропусканий
- •Метод предельной точности
- •20.5.1. Процессы, приводящие к появлению аналитического сигнала
- •20.5.2. Общая характеристика ик-спектров
- •20.5.3. Измерение аналитического сигнала
- •20.5.4. Практическое применение
- •Глава 21 эмиссионные спектроскопические методы анализа
- •21.1. Атомно-эмиссионная спектроскопия
- •21.1.1. Процессы, приводящие к появлению аналитического сигнала
- •21.1.2. Измерение аналитического сигнала
- •Пламенная фотометрия
- •3000-7000 °C невысокая воспроизводимостьтолько щелочные, щелочноземельные металлы и т.П.
- •Фотоэлементы, фотоумножители, фотодиоды
- •21.1.3. Практическое применение
- •20.2. Люминесцентная спектроскопия
- •20.2.1 Классификация видов люминесценции
- •21.2.2 Механизм молекулярной фотолюминесценции. Флуоресценция и фосфоресценция
- •21.2.3 Основные характеристики и закономерности люминесценции
- •21.2.4. Влияние различных факторов на интенсивность флуоресценции растворов
- •21.2.5. Измерение аналитического сигнала
- •21.2.6. Практическое применение и основные приёмы люминесцентного анализа
- •Рибофлавин офлоксацин
- •Глава 22 общая характеристика и теоретические основы хроматографических методов анализа
- •22.1. Общая характеристика
- •22.2. Классификация хроматографических методов
- •Агрегатное состояние подвижной фазы
- •22.3. Хроматографические параметры
- •22.4. Теории хроматографического разделения
- •Глава 23
- •Сорбент помещают внутрь колонки
- •23.3. Особенности газотвёрдофазной хроматографии
- •23.4. Особенности газожидкостной хроматографии
- •23.5. Индексы удерживания Ковача
- •23.6. Практическое применение
- •Глава 24
- •Жидкостная хроматография
- •24.1. Общая характеристика
- •24.2. Плоскостная хроматография
- •Плоскостная хроматография
- •24.2.1. Методика получения плоскостной хроматограммы
- •24.2.2. Анализ плоскостной хроматограммы
- •24.2.3. Практическое применение
- •24.3. Колоночная жидкостная хроматография
- •24.3.1. Устройство жидкостного хроматографа
- •Ввод пробы
- •24.3.2. Практическое применение
- •24.4. Характеристика отдельных видов жидкостной хроматографии
- •24.4.1. Ионообменная хроматография
- •Сильнокислотные
- •24.4.2. Эксклюзионная хроматография
- •Глава 25 общая характеристика электрохимических методов анализа. Кондукгометрия
- •25.1. Основные понятия, связанные с электрохимическими методами анализа
- •25.2. Классификация электрохимических методов анализа
- •25.3. Кондуктометрия
- •25.3.1. Теоретические основы и классификация
- •25.3.2. Измерение аналитического сигнала
- •25.3.4. Практическое применение
- •25.3.5. Понятие о высокочастотной кондуктометрии
- •Глава 26 потенциометрический и кулонометрический методы анализа
- •26.1. Потенциометрический метод анализа
- •26.1.1. Общая характеристика и классификация
- •26.1.3. Индикаторные электроды
- •Первичные ионоселективные электроды
- •Электроды с подвижными носителями
- •Имеют жидкую мембрану -
- •26.1.4. Прямая потенциометрия
- •26.1.5. Потенциометрическое титрование
- •26.2. Кулонометрический метод анализа
- •26.2.1. Общая характеристика и классификация
- •26.2.2. Прямая кулонометрия
- •26.2.3. Кулонометрическое титрование
- •Глава 27 вольтамперометрический метод анализа
- •27.1. Принцип измерения аналитического сигнала.
- •27.2. Вольтамперограмма
- •Максимум второго рода
- •Максимум первого рода
- •27.3. Некоторые современные разновидности вольт- амперометрии
- •27.4. Практическое применение вольтамперометрии. Амперометрическое титрование
20.4. Молекулярная абсорбционная спектроскопия в уф- и видимой области
УФ
10
ближняя
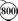
УФ-область
180 нм поглощается O2,
160 нм и O2, и N2
Молекулярную
абсорбционную спектроскопию в УФ- и
видимой областях спектра называют
спектрофотометрией
либо
фотометрией.
20.4.1. Молекулярные спектры поглощения в УФ- и видимой области
возбуждённое
электронное
состояние
основное
электронное
состояниеМолекулярные
абсорбционные спектры в УФ- и видимой
области
состоят
не из отдельных чётко определённых
линий, а
из широких полос.
Это вызвано следующими причинами.
Как и атомы молекулы могут поглощать
только такое электромагнитное
излучение, энергия которого точно равна
раз-
ности
между энергиями основного
Рис. 20.9. Электронные переходы в J г
гипотетической
молекуле и
возбуждённого
состояния.
Одна
ко,
полная энергия молекулы является
суммой энергии электронного состояния
(Еэл),
энергии колебания атомов, входящих в
её состав (Екол)
и энергии вращения данной молекулы
(Евр),
причём Еэл
> Екол
>> Евр.
Каждому электронному состоянию
молекулы соответствует целая группа
колебательных, а каждому колебательному,
в свою очередь, большое число вращательных
состояний.
Энергия электромагнитного излучения
УФ- и видимого диапазона соответствует
энергии возбуждения валентных
электронов.
Для того чтобы произошёл переход
молекулы из одного колебательного
состояния в другое без изменения её
электронного состояния, достаточно
энергии ИК-излучения, а между двумя
вращательными энергетическими
уровнями в пределах одного и того же
колебательного - энергии излучения
микроволнового диапазона.
200
250 300 350 400 450
Рис.
20.10.
Спектр поглощения берберина бисульфата
(водныйраствор) Основными
характеристиками полосы поглощения
являются её положение и интенсивность
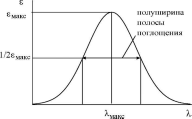
(рис. 20.11).
А,,нм
Рис.
20.11.
Основные характеристики полосы
поглощения
249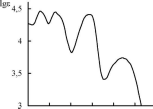
При
поглощении электромагнитного излучения
УФ- или видимого диапазона молекула
переходит из некоторого колебательного
и вращательного состояния основного
электронного уровня в некоторое
колебательное и вращательное состояние
следующего электронного уровня (рис.
20.9). Каждый образец вещества содержит
огромное число молекул. Даже если все
они находятся в основном электронном
состоянии, то при этом они могут находиться
в разных колебательном и вращательном
состояниях. Поэтому вещество будет
поглощать не только электромагнитное
излучение, соответствующее переходу
между самыми низкими колебательными
и вращательными состояниями основного
и возбуждённого электронного уровней,
но и излучение с близкими длинами волн.
Кроме того, в многоатомных молекулах
возможно много электронных переходов
и они могут быть близки по энергии,
поэтому в спектре поглощения отдельные
полосы поглощения могут сливаться
друг с другом. В качестве примера на
рис. 20.10 приведен спектр поглощения
алкалоида берберина.
Положение
максимума полосы поглощения (Хмакс)
соответствует длине волны такого
электромагнитного излучения, энергия
которого равна энергии необходимой для
электронного перехода. Для характеристики
ширины полосы поглощения используются
величиной
полуширины полосы поглощения.
Интенсивность поглощения, которую можно
охарактеризовать с помощью молярного
коэффициента поглощения, зависит от
вероятности данного электронного
перехода. Поглощение с емакс
> 104
считается интенсивным (максимально
возмож-
5 3
ное
значение s
составляет
примерно 2-10 ), поглощение с 8макс
< 10 считается малоинтенсивным.
Объектами исследования в спектрофотометрии чаще всего являются органические вещества. Зависимость между строением органических соединений и их способностью поглощать электромагнитное излучение УФ- и видимого диапазона обычно изучается в курсе органической химии. Напомним лишь, что в органических соединениях могут происходить 4 типа электронных переходов: а ^ а*, n ^ а*, л ^ л* и n ^ л*. Энергия переходов первых двух типов соответствует энергии УФ-излучения вакуумного диапазона (например, а ^ а* в молекуле этана - 135 нм, n ^ а* в молекуле метанола - 183 нм). Энергия л ^ л* переходов изолированных л-связей соответствует ЭМИ с X < 200 нм, например в молекуле этилена - 165 нм. При сопряжении нескольких л-связей полосы поглощения смещаются в более длинноволновую область спектра.
Группы,
обуславливающие появление полос
поглощения в молекулярных спектрах,
называются
хромофорами.
Атомы или группы атомов, которые сами
по себе не обуславливают появление
полос поглощения, но влияют на характер
поглощения хромофоров, называются
ауксохромами.
хромофор
ауксохром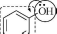
Ауксохромы
имеют неподелённые электронные пары,
находящиеся в сопряжении с л-электронной
системой хромофора, и могут сдвигать
полосу поглощения хромофора в более
длинноволновую область
(батохромный сдвиг)
или в более коротковолновую область
(гипсохромный
сдвиг),
увеличивать её интенсивность
(гиперхром- ный эффект)
или уменьшать её
(гипохромный эффект).
20.4.2. Измерение аналитического сигнала
Объектами
исследования в фотометрии обычно
являются растворы. Принцип измерения
аналитического сигнала заключается в
сравнении интенсивности двух световых
потоков, один из которых проходит через
исследуемый раствор, а второй - через
раствор сравнения.
однолучевые
двухлучевые
регистрирующие
нерегистрирующие
Принципиальная
схема однолучевого прибора показана
на рис.
20.12.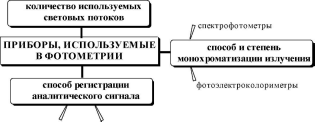
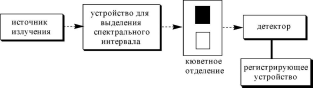
Рис.
20.12.Принципиальная
схема однолучевого прибора для измерения
светопоглощения в УФ- и видимой областях
спектра
![]()

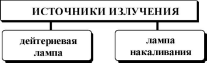
340-1100
нм![]()
Для получения видимого и длинноволнового УФ-излучения применяют также галогеновые лампы.
Источники излучения, используемые в фотометрии, дают непрерывные спектры. В зависимости от того, каким образом происходит выделение из непрерывного спектра испускания источника нужного спектрального интервала, абсорбционные спектрометры можно разделить на 2 класса: фотоэлектроколориметры и спектрофотометры.
В фотоэлектроколориметрахдля выделения нужного интервала длин волн применяют набор светофильтров.Величина полуширины пропускания используемых светофильтров составляет в среднем 25-45 нм. Нижняя граница рабочих длин волн составляет для большинства моделей фотоэлектроколориметров примерно 315 нм. Фото- электроколориметры используют обычно для проведения серийных измерений концентрации веществ, поглощающих в видимой или длинноволновой УФ-области электромагнитного спектра.
В спектрофотометрахдля выделения из спектра испускания источника излучения с нужной длиной волны применяют монохрома- торы: дифракционные решёткиили призмы.Монохроматор позволяет получить электромагнитное излучение с гораздо более высокой степенью монохроматичности, чем светофильтр. Спектрофотометры имеют более сложное устройство, чем фотоэлектроколориметры и используются для получения спектров поглощения веществ, определения концентрации веществ, поглощающих при длинах волн менее 300 нм, имеющих узкие полосы поглощения и т.д.
Растворы веществ, поглощение которых измеряется, помещают в специальные сосуды прямоугольной или, реже, цилиндрической формы, называемые кюветами.Кювета, содержащая раствор исследуемого вещества, называется рабочей,а кювета, содержащая раствор сравнения - кюветой сравнения.Кюветы, применяемые для работы в видимой области спектра, могут быть сделаны из стекла. Для работы в области длин волн меньше 325 нм необходимы кварцевые кюветы. В качестве материала для изготовления кювет используются также органические полимеры. Как правило, каждый прибор для фотометрических измерений снабжён набором кювет (толщиной от 0,1 до 5 см). Чаще всего в работе, особенно для спектрофотометров, используются кюветы с толщиной 1 см. Кроме обычных кювет существуют кюветы специальной конструкции, например, термостатированные, проточные.
В однолучевых приборахв поток излучения вначале помещают кювету сравнения и настраивают по ней прибор на ноль оптической плотности. Затем в поток излучения помещают рабочую кювету. При изменении X настройку прибора следует повторить. В двухлучевых спектрометрахпоток, выходящий из монохроматора, с помощью зеркала специальной конструкции расщепляется на два одинаковых потока: один направляется на кювету сравнения, а второй - на рабочую кювету. Потоки, выходящие из кювет, затем направляются на один и тот же детектор. Двухлучевые приборы удобны при автоматической регистрации спектров поглощения, так как их не нужно перенастраивать при изменении длины волны.
ДЕТЕКТОРЫ ИЗЛУЧЕНИЯ
