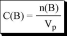- •Аналитическая химия
- •Часть 1
- •Isbn 985-466-015-х
- •Раздел 1
- •Глава 1
- •Разложение пробы
- •1.3. Виды анализа
- •Экстракционная фотометрия
- •Глава 2
- •2.1. Аналитические реакции
- •2.2. Систематический и дробный анализ
- •Комплексообразование
- •2.3. Общая характеристика, классификация и способы обнаружения катионов
- •2.4. Общая характеристика, классификация и способы обнаружения анионов
- •Глава 3
- •3.1. Общая характеристика химического равновесия. Константа химического равновесия
- •3.2. Активность и коэффициент активности
- •3.3. Отклонения от идеальности в растворах сильных электролитов
- •3.4. Виды констант химического равновесия, используемые в аналитической химии
- •3.5. Общие принципы расчёта состава равновесных систем
- •Глава 4
- •4.1. Важнейшие теории кислот и оснований
- •4.2. Количественное описание силы кислот и оснований
- •4.3. Влияние растворителя на кислотно-основные свойства растворённого вещества
- •4.4. Нивелирующее и дифференцирующее действие растворителя. Сильные и слабые кислоты и основания
- •4.5. Расчёт рН водных растворов различных прото- литов
- •4.6. Расчёт состава равновесных смесей протолитов при заданном значении рН
- •4.7. Кислотно-основные буферные растворы
- •Глава 5
- •5.1. Понятие о комплексном соединении
- •5.2. Классификация комплексных соединений
- •5.3. Равновесия в растворах комплексных соединений
- •Общая константа образования
- •5.4. Влияние различных факторов на комплексообразование в растворах
- •5.5. Применение органических реагентов в аналитической химии
- •Лиганды с одним типом донорных атомов о,о-лиганды
- •Шестичленные циклы
- •Органические реагенты
- •6.1. Произведение растворимости малорастворимого электролита
- •Глава 6
- •6.2. Растворимость
- •6.3. Влияние различных факторов на растворимость
- •6.4. Общие принципы растворения осадков малорастворимых электролитов
- •Глава 7
- •7.1. Общая характеристика окислительно-восстановительных реакций
- •7.2. Количественная оценка окислительно-восстановительной способности веществ
- •7.3. Влияние различных факторов на протекание окислительно-восстановительных реакций
- •Глава 8
- •8.1. Отбор пробы
- •Анализируемым образец
- •I эмпирический
- •Генеральная проба
- •Лабораторная проба
- •8.2. Разложение пробы
- •9.1. Общая характеристика и классификация
- •Глава 9
- •9.2. Жидкость - жидкостная экстракция
- •Реэкстракт
- •Реэкстракция
- •Сложные эфиры фосфорной кислоты, фосфоновых, фосфиновых кислот, фосфиноксиды, сульфоксиды, диантипирилметан
- •Третичные амины, четвертичные аммониевые соли, соли тетрафениларсония и тетрафенилфосфония.
- •Глава 10
- •10.1. Приближённые вычисления и значащие цифры
- •3 Значащие цифры
- •1 Значащая цифра
- •10.2. Понятие об аналитическом сигнале
- •10.3. Методы расчёта концентрации вещества по величине аналитического сигнала
- •10.4. Неопределённость и погрешности измерений
- •10.5. Некоторые основные положения математической статистики, используемые в аналитической химии
- •10.6. Пример статистической обработки результатов измерений. Исключение промахов
- •10.7. Основные характеристики методики анализа
- •Раздел 2
- •Глава 11
- •11.3. Понятие о механизме образования осадка
- •11.4. Коллоидная стадия образования осадка
- •11.5. Причины загрязнения осадка и способы их устранения
- •11.6. Основные этапы методики гравиметрического определения методом осаждения
- •11.7. Гравиметрия в фармацевтическом анализе
- •Глава 12 общая характеристика титриметрических методов анализа
- •12.1. Основные понятия титриметрии
- •Исчезновение окраски фенолфталеина
- •Появление розовой окраски раствора
- •12.2. Классификация титриметрических методов анализа и способов титрования
- •12.3. Стандартные растворы и стандартные вещества
- •12.4. Расчёты, связанные с приготовлением растворов титрантов и титрованием
- •Vисх_mрисх_m(hCl) _n(hCl) - m(hCl) _c(hCl) - V - m(hCl) _p _ra(hCl) -p_ ra(hCl) -p _p-ra(hCl)
- •Глава 13 кислотно-основное титрование
- •13.1. Титранты и стандартные вещества
- •13.2. Обнаружение конечной точки титрования. Кислотно-основные индикаторы
- •13.3. Кривые титрования
- •13.4. Факторы, влияющие на величину скачка титрования
- •0,1МNaOh (1), 0,001мhCl 0,001мNaOh (2) и или основания (рис. 13.4).
- •0,1МhCl 0,1мNaOh (3)Прямое титрование таких
- •13.5. Погрешности титрования
- •13.6. Некоторые случаи практического применения кислотно-основного титрования в водных растворах
- •Глава 14 кислотно-основное титрование в неводных средах
- •14.3. Применение в фармацевтическом анализе
- •Глава 15 комплексометрическое титрование
- •15.1. Общая характеристика
- •15.2. Меркуриметрическое титрование
- •Ind HgInd фиолетовый Ind жёлтыйHg[Fe(cn)sNo]
- •15.3. Комплексонометрическое титрование
- •Глава 16
- •16.3. Меркурометрическое титрование
- •Глава 17
- •17.1. Общая характеристика и классификация
- •17.2. Кривые титрования
- •17.3. Способы обнаружения конечной точки титрования. Окислительно-восстановительные индикаторы
- •Глава 18
- •18.1. Иодометрическое титрование
- •18.2. Хлориодометрическое титрование
- •18.3. Иодатометрическое титрование
- •18.4. Броматометрическое титрование
- •18.5. Нитритометрическое титрование
- •I" крахмал избыток NaNo2 i4
- •18.6. Перманганатометрическое титрование
- •18.8. Дихроматометрическое титрование
- •18.8. Цериметрическое титрование
- •Раздел 3
- •Глава 19
- •19.1. Природа и свойства электромагнитного излучения
- •19.2. Классификация спектроскопических методов анализа
- •Глава 20
- •20.2. Отклонения от основного закона светопоглощения
- •20.3. Атомно-абсорбционная спектроскопия
- •20.4. Молекулярная абсорбционная спектроскопия в уф- и видимой области
- •Сурьмяно-цезиевый фотоэлемент кислородно-цезиевый фотоэлемент
- •20.4.3. Практическое применение и основные приёмы фотометрического анализа
- •Измерение светопоглощения хлороформного экстракта
- •Метод отношения пропусканий
- •Метод предельной точности
- •20.5.1. Процессы, приводящие к появлению аналитического сигнала
- •20.5.2. Общая характеристика ик-спектров
- •20.5.3. Измерение аналитического сигнала
- •20.5.4. Практическое применение
- •Глава 21 эмиссионные спектроскопические методы анализа
- •21.1. Атомно-эмиссионная спектроскопия
- •21.1.1. Процессы, приводящие к появлению аналитического сигнала
- •21.1.2. Измерение аналитического сигнала
- •Пламенная фотометрия
- •3000-7000 °C невысокая воспроизводимостьтолько щелочные, щелочноземельные металлы и т.П.
- •Фотоэлементы, фотоумножители, фотодиоды
- •21.1.3. Практическое применение
- •20.2. Люминесцентная спектроскопия
- •20.2.1 Классификация видов люминесценции
- •21.2.2 Механизм молекулярной фотолюминесценции. Флуоресценция и фосфоресценция
- •21.2.3 Основные характеристики и закономерности люминесценции
- •21.2.4. Влияние различных факторов на интенсивность флуоресценции растворов
- •21.2.5. Измерение аналитического сигнала
- •21.2.6. Практическое применение и основные приёмы люминесцентного анализа
- •Рибофлавин офлоксацин
- •Глава 22 общая характеристика и теоретические основы хроматографических методов анализа
- •22.1. Общая характеристика
- •22.2. Классификация хроматографических методов
- •Агрегатное состояние подвижной фазы
- •22.3. Хроматографические параметры
- •22.4. Теории хроматографического разделения
- •Глава 23
- •Сорбент помещают внутрь колонки
- •23.3. Особенности газотвёрдофазной хроматографии
- •23.4. Особенности газожидкостной хроматографии
- •23.5. Индексы удерживания Ковача
- •23.6. Практическое применение
- •Глава 24
- •Жидкостная хроматография
- •24.1. Общая характеристика
- •24.2. Плоскостная хроматография
- •Плоскостная хроматография
- •24.2.1. Методика получения плоскостной хроматограммы
- •24.2.2. Анализ плоскостной хроматограммы
- •24.2.3. Практическое применение
- •24.3. Колоночная жидкостная хроматография
- •24.3.1. Устройство жидкостного хроматографа
- •Ввод пробы
- •24.3.2. Практическое применение
- •24.4. Характеристика отдельных видов жидкостной хроматографии
- •24.4.1. Ионообменная хроматография
- •Сильнокислотные
- •24.4.2. Эксклюзионная хроматография
- •Глава 25 общая характеристика электрохимических методов анализа. Кондукгометрия
- •25.1. Основные понятия, связанные с электрохимическими методами анализа
- •25.2. Классификация электрохимических методов анализа
- •25.3. Кондуктометрия
- •25.3.1. Теоретические основы и классификация
- •25.3.2. Измерение аналитического сигнала
- •25.3.4. Практическое применение
- •25.3.5. Понятие о высокочастотной кондуктометрии
- •Глава 26 потенциометрический и кулонометрический методы анализа
- •26.1. Потенциометрический метод анализа
- •26.1.1. Общая характеристика и классификация
- •26.1.3. Индикаторные электроды
- •Первичные ионоселективные электроды
- •Электроды с подвижными носителями
- •Имеют жидкую мембрану -
- •26.1.4. Прямая потенциометрия
- •26.1.5. Потенциометрическое титрование
- •26.2. Кулонометрический метод анализа
- •26.2.1. Общая характеристика и классификация
- •26.2.2. Прямая кулонометрия
- •26.2.3. Кулонометрическое титрование
- •Глава 27 вольтамперометрический метод анализа
- •27.1. Принцип измерения аналитического сигнала.
- •27.2. Вольтамперограмма
- •Максимум второго рода
- •Максимум первого рода
- •27.3. Некоторые современные разновидности вольт- амперометрии
- •27.4. Практическое применение вольтамперометрии. Амперометрическое титрование
12.3. Стандартные растворы и стандартные вещества
Как уже упоминалось выше, титрантом называют активный реагент, используемый для титрования. Поскольку титрование обычно проводят с помощью раствора титранта, то иногда титрантом называют не само активное вещество, а его раствор, применяемый для титрования.
Раствор, концентрация активного вещества в котором известна с высокой точностью, называется стандартным раствором.
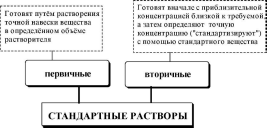
Стандартным веществом в титриметрииназывается реагент, используемый для стандартизации раствора титранта.
K2&2O7 Na2B4O7-10H2O
1
| Высокочистые вещества, ! используемые для стандартизации j титрантов либо для приготовления ! стандартных растворов, которые будут использоваться в качестве самостоятельных титрантов

В качестве первичных стандартных веществ используют соединения, обладающие следующими свойствами:
состав строго соответствует химической формуле;
выпускаются промышленностью в чистом виде (квалификация не ниже «ч.д.а.») либо легко подвергаются очистке;
устойчивы при обычных условиях;
нелетучии, по возможности, не содержат кристаллизационной воды (можно использовать и кристаллогидраты, если они устойчивы).
стандартный раствор HCl
Растворы веществ, способных реагировать с титрантом, стандартизированные с помощью первичного стандартного вещества.
имеют большую молярную массу(меньше погрешность при измерении массы).
Растворы титрантов можно готовить также из фиксаналов и методом ионного обмена. Фиксаналом(нормадозой, стандарт-титром) называются приготовленные и расфасованные в промышленных условиях порции вещества, содержащие точно известное его количество. Содержимое фиксанала растворяют в указанном объёме растворителя (обычно объём раствора составляет 1 л) и получают раствор с точной концентрацией растворённого вещества.
12.4. Расчёты, связанные с приготовлением растворов титрантов и титрованием
Расчёты, связанные с приготовлением растворов
Количественный состав раствора можно описывать с помощью безразмерных величин и величин, имеющих размерность. Безразмерные величины иначе называются долями.
ДОЛЯ РАСТВОРЁННОГО ВЕЩЕСТВА В РАСТВОРЕ
молярная
массовая
отношение массы растворённого вещества к массе раствора
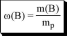
отношение объёма растворённого вещества к сумме объёмов всех веществ, участвующих в образовании раствора (до их смешивания)
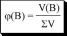
отношение количества растворённого вещества к сумме количеств всех веществ, находящихся в растворе
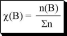
Из всех видов долей чаще всего, по крайней мере, в аналитической химии, используется массовая доля.
Доли могут выражаться в процентах. Процент - это не единица измерения, а всего лишь синоним величины «одна сотая».
К размерным величинам, используемым для описания количественного состава растворов, относят концентрации вещества в растворе и моляльность растворённого вещества.
Концентрация -это отношение массы или количества растворённого вещества к объёму раствора.
Массовая доля - это, согласно современному подходу, не концентрация и называть её «процентной концентрацией» не следует. Слово «концентрация» переводится на русский язык как «сосредоточение» и относится к растворённому веществу, а не к раствору, т.е. говорят «концентрация растворённого вещества в растворе», а не «концентрация раствора».
массовая
молярная
отношение массы растворённого вещества к объёму раствора
отношение количества растворённого вещества к объёму раствора
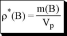
[p*(B)] = г/л[C(B)]= моль/л =M
|
массовая концентрация, имеющая размерность г/мл, называется титром раствора |
1 |
|
^ понятие "молярная концентрация" юможет относиться как к формульной единице вещества, так и к его эквиваленту |
|
| |||
|
| |||
Моляльностьрастворённого вещества представляет собой отношение количества этого вещества, находящегося в растворе, к массе растворителя. Обозначают моляльность как т(В), Ь(В), Ст(В). Размерность моляльности - моль/кг. Её используют в тех случаях, когда раствор находится в неизотермических условиях.
Для количественной характеристики стандартных растворов обычно используют молярную концентрацию (вещества или эквивалента вещества). Иногда для этой цели пользуются титром раствора.
Если стандартный раствор титранта используется для серийных анализов, то для его количественной характеристики удобно использовать титр соответствия(титр по определяемому веществу), который показывает массу определяемого вещества, взаимодействующего с 1 мл данного титранта.Например, титр 0,1000 МHCl поNaOH равен 4,000-10-3г/мл.
Титр соответствия рассчитывается заранее для определённой концентрации вещества в стандартном растворе. Представим себе, что в лаборатории закончился 0,1000 М HCl и новый приготовленный растворHCl оказался немного более концентрированным (или более разбавленным), чем исходный, например 0,1005 М. В таких случаях удобнее не пересчитывать величину титра соответствия, а ввести поправочный коэффициент (к), например, в данном случае он равен 1,005.