
- •Аналитическая химия
- •Часть 1
- •Isbn 985-466-015-х
- •Раздел 1
- •Глава 1
- •Разложение пробы
- •1.3. Виды анализа
- •Экстракционная фотометрия
- •Глава 2
- •2.1. Аналитические реакции
- •2.2. Систематический и дробный анализ
- •Комплексообразование
- •2.3. Общая характеристика, классификация и способы обнаружения катионов
- •2.4. Общая характеристика, классификация и способы обнаружения анионов
- •Глава 3
- •3.1. Общая характеристика химического равновесия. Константа химического равновесия
- •3.2. Активность и коэффициент активности
- •3.3. Отклонения от идеальности в растворах сильных электролитов
- •3.4. Виды констант химического равновесия, используемые в аналитической химии
- •3.5. Общие принципы расчёта состава равновесных систем
- •Глава 4
- •4.1. Важнейшие теории кислот и оснований
- •4.2. Количественное описание силы кислот и оснований
- •4.3. Влияние растворителя на кислотно-основные свойства растворённого вещества
- •4.4. Нивелирующее и дифференцирующее действие растворителя. Сильные и слабые кислоты и основания
- •4.5. Расчёт рН водных растворов различных прото- литов
- •4.6. Расчёт состава равновесных смесей протолитов при заданном значении рН
- •4.7. Кислотно-основные буферные растворы
- •Глава 5
- •5.1. Понятие о комплексном соединении
- •5.2. Классификация комплексных соединений
- •5.3. Равновесия в растворах комплексных соединений
- •Общая константа образования
- •5.4. Влияние различных факторов на комплексообразование в растворах
- •5.5. Применение органических реагентов в аналитической химии
- •Лиганды с одним типом донорных атомов о,о-лиганды
- •Шестичленные циклы
- •Органические реагенты
- •6.1. Произведение растворимости малорастворимого электролита
- •Глава 6
- •6.2. Растворимость
- •6.3. Влияние различных факторов на растворимость
- •6.4. Общие принципы растворения осадков малорастворимых электролитов
- •Глава 7
- •7.1. Общая характеристика окислительно-восстановительных реакций
- •7.2. Количественная оценка окислительно-восстановительной способности веществ
- •7.3. Влияние различных факторов на протекание окислительно-восстановительных реакций
- •Глава 8
- •8.1. Отбор пробы
- •Анализируемым образец
- •I эмпирический
- •Генеральная проба
- •Лабораторная проба
- •8.2. Разложение пробы
- •9.1. Общая характеристика и классификация
- •Глава 9
- •9.2. Жидкость - жидкостная экстракция
- •Реэкстракт
- •Реэкстракция
- •Сложные эфиры фосфорной кислоты, фосфоновых, фосфиновых кислот, фосфиноксиды, сульфоксиды, диантипирилметан
- •Третичные амины, четвертичные аммониевые соли, соли тетрафениларсония и тетрафенилфосфония.
- •Глава 10
- •10.1. Приближённые вычисления и значащие цифры
- •3 Значащие цифры
- •1 Значащая цифра
- •10.2. Понятие об аналитическом сигнале
- •10.3. Методы расчёта концентрации вещества по величине аналитического сигнала
- •10.4. Неопределённость и погрешности измерений
- •10.5. Некоторые основные положения математической статистики, используемые в аналитической химии
- •10.6. Пример статистической обработки результатов измерений. Исключение промахов
- •10.7. Основные характеристики методики анализа
- •Раздел 2
- •Глава 11
- •11.3. Понятие о механизме образования осадка
- •11.4. Коллоидная стадия образования осадка
- •11.5. Причины загрязнения осадка и способы их устранения
- •11.6. Основные этапы методики гравиметрического определения методом осаждения
- •11.7. Гравиметрия в фармацевтическом анализе
- •Глава 12 общая характеристика титриметрических методов анализа
- •12.1. Основные понятия титриметрии
- •Исчезновение окраски фенолфталеина
- •Появление розовой окраски раствора
- •12.2. Классификация титриметрических методов анализа и способов титрования
- •12.3. Стандартные растворы и стандартные вещества
- •12.4. Расчёты, связанные с приготовлением растворов титрантов и титрованием
- •Vисх_mрисх_m(hCl) _n(hCl) - m(hCl) _c(hCl) - V - m(hCl) _p _ra(hCl) -p_ ra(hCl) -p _p-ra(hCl)
- •Глава 13 кислотно-основное титрование
- •13.1. Титранты и стандартные вещества
- •13.2. Обнаружение конечной точки титрования. Кислотно-основные индикаторы
- •13.3. Кривые титрования
- •13.4. Факторы, влияющие на величину скачка титрования
- •0,1МNaOh (1), 0,001мhCl 0,001мNaOh (2) и или основания (рис. 13.4).
- •0,1МhCl 0,1мNaOh (3)Прямое титрование таких
- •13.5. Погрешности титрования
- •13.6. Некоторые случаи практического применения кислотно-основного титрования в водных растворах
- •Глава 14 кислотно-основное титрование в неводных средах
- •14.3. Применение в фармацевтическом анализе
- •Глава 15 комплексометрическое титрование
- •15.1. Общая характеристика
- •15.2. Меркуриметрическое титрование
- •Ind HgInd фиолетовый Ind жёлтыйHg[Fe(cn)sNo]
- •15.3. Комплексонометрическое титрование
- •Глава 16
- •16.3. Меркурометрическое титрование
- •Глава 17
- •17.1. Общая характеристика и классификация
- •17.2. Кривые титрования
- •17.3. Способы обнаружения конечной точки титрования. Окислительно-восстановительные индикаторы
- •Глава 18
- •18.1. Иодометрическое титрование
- •18.2. Хлориодометрическое титрование
- •18.3. Иодатометрическое титрование
- •18.4. Броматометрическое титрование
- •18.5. Нитритометрическое титрование
- •I" крахмал избыток NaNo2 i4
- •18.6. Перманганатометрическое титрование
- •18.8. Дихроматометрическое титрование
- •18.8. Цериметрическое титрование
- •Раздел 3
- •Глава 19
- •19.1. Природа и свойства электромагнитного излучения
- •19.2. Классификация спектроскопических методов анализа
- •Глава 20
- •20.2. Отклонения от основного закона светопоглощения
- •20.3. Атомно-абсорбционная спектроскопия
- •20.4. Молекулярная абсорбционная спектроскопия в уф- и видимой области
- •Сурьмяно-цезиевый фотоэлемент кислородно-цезиевый фотоэлемент
- •20.4.3. Практическое применение и основные приёмы фотометрического анализа
- •Измерение светопоглощения хлороформного экстракта
- •Метод отношения пропусканий
- •Метод предельной точности
- •20.5.1. Процессы, приводящие к появлению аналитического сигнала
- •20.5.2. Общая характеристика ик-спектров
- •20.5.3. Измерение аналитического сигнала
- •20.5.4. Практическое применение
- •Глава 21 эмиссионные спектроскопические методы анализа
- •21.1. Атомно-эмиссионная спектроскопия
- •21.1.1. Процессы, приводящие к появлению аналитического сигнала
- •21.1.2. Измерение аналитического сигнала
- •Пламенная фотометрия
- •3000-7000 °C невысокая воспроизводимостьтолько щелочные, щелочноземельные металлы и т.П.
- •Фотоэлементы, фотоумножители, фотодиоды
- •21.1.3. Практическое применение
- •20.2. Люминесцентная спектроскопия
- •20.2.1 Классификация видов люминесценции
- •21.2.2 Механизм молекулярной фотолюминесценции. Флуоресценция и фосфоресценция
- •21.2.3 Основные характеристики и закономерности люминесценции
- •21.2.4. Влияние различных факторов на интенсивность флуоресценции растворов
- •21.2.5. Измерение аналитического сигнала
- •21.2.6. Практическое применение и основные приёмы люминесцентного анализа
- •Рибофлавин офлоксацин
- •Глава 22 общая характеристика и теоретические основы хроматографических методов анализа
- •22.1. Общая характеристика
- •22.2. Классификация хроматографических методов
- •Агрегатное состояние подвижной фазы
- •22.3. Хроматографические параметры
- •22.4. Теории хроматографического разделения
- •Глава 23
- •Сорбент помещают внутрь колонки
- •23.3. Особенности газотвёрдофазной хроматографии
- •23.4. Особенности газожидкостной хроматографии
- •23.5. Индексы удерживания Ковача
- •23.6. Практическое применение
- •Глава 24
- •Жидкостная хроматография
- •24.1. Общая характеристика
- •24.2. Плоскостная хроматография
- •Плоскостная хроматография
- •24.2.1. Методика получения плоскостной хроматограммы
- •24.2.2. Анализ плоскостной хроматограммы
- •24.2.3. Практическое применение
- •24.3. Колоночная жидкостная хроматография
- •24.3.1. Устройство жидкостного хроматографа
- •Ввод пробы
- •24.3.2. Практическое применение
- •24.4. Характеристика отдельных видов жидкостной хроматографии
- •24.4.1. Ионообменная хроматография
- •Сильнокислотные
- •24.4.2. Эксклюзионная хроматография
- •Глава 25 общая характеристика электрохимических методов анализа. Кондукгометрия
- •25.1. Основные понятия, связанные с электрохимическими методами анализа
- •25.2. Классификация электрохимических методов анализа
- •25.3. Кондуктометрия
- •25.3.1. Теоретические основы и классификация
- •25.3.2. Измерение аналитического сигнала
- •25.3.4. Практическое применение
- •25.3.5. Понятие о высокочастотной кондуктометрии
- •Глава 26 потенциометрический и кулонометрический методы анализа
- •26.1. Потенциометрический метод анализа
- •26.1.1. Общая характеристика и классификация
- •26.1.3. Индикаторные электроды
- •Первичные ионоселективные электроды
- •Электроды с подвижными носителями
- •Имеют жидкую мембрану -
- •26.1.4. Прямая потенциометрия
- •26.1.5. Потенциометрическое титрование
- •26.2. Кулонометрический метод анализа
- •26.2.1. Общая характеристика и классификация
- •26.2.2. Прямая кулонометрия
- •26.2.3. Кулонометрическое титрование
- •Глава 27 вольтамперометрический метод анализа
- •27.1. Принцип измерения аналитического сигнала.
- •27.2. Вольтамперограмма
- •Максимум второго рода
- •Максимум первого рода
- •27.3. Некоторые современные разновидности вольт- амперометрии
- •27.4. Практическое применение вольтамперометрии. Амперометрическое титрование
10.4. Неопределённость и погрешности измерений
Любой результат анализа всегда имеет некоторую неопределённость. Это связано с особенностью работы приборов, несовершенством работы химика-аналитика при проведении отдельных операций, влиянием посторонних веществ, присутствующих в матрице, реактивах и с другими причинами.
Неопределённость измерения -параметр, связанный с результатом измерения и характеризующий разброс значений (например, ширина доверительного интервала, стандартное отклонение),которые с достаточным основанием могут быть приписаны измеряемой величине.
Погрешность результата -это разность между данным результатом и истинным значением измеряемой величины (абсолютная погрешность Axj = Xj -т)либо отношение этой разности к истинному значению измеряемой величины (относительная погрешность).
Истинное значение измеряемой величины- идеальная величина, которую можно достичь только в том случае, когда устранены все источники погрешностей измерения и выбрана вся генеральная совокупность.

C
Рис.
10.2.Графический
метод добавок
В
зависимости от причины возникновения
погрешности бывают
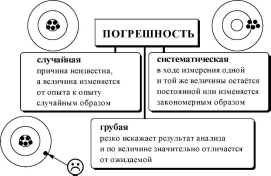
К появлению систематической погрешности могут приводить следующие основные причины:
методические(погрешность отбора пробы, погрешность разделения и концентрирования, пренебрежение сигналом контрольного опыта и т.д.);
реактивные(использование недостаточно чистых реактивов);
инструментальные(использование неправильно градуированного прибора);
индивидуальные(особенности работы химика-аналитика)
Причина грубых погрешностей - неправильная работа химика-
аналитика.
10.5. Некоторые основные положения математической статистики, используемые в аналитической химии
Случайной величинойназывается измеряемая по ходу опыта численная характеристика, принимающая одно и только одно возможное и наперёд неизвестное значение вследствие действия различных факторов, которые не могут быть заранее учтены.
Дискретнойназывают случайную величину, множество возможных значений которой конечно либо счётно. Непрерывнойназывают случайную величину, которая может принимать все значения из некоторого конечного или бесконечного интервала.
Функцией распределения случайной величиныназывается функция, определяемая равенством
F(x) =P(X <x)
где P(X <x) - вероятность того, что случайная величина X примет любое значение, которое меньше или равноx.
Функция f(x) называется плотностью вероятности непрерывной случайной величины,если для любых чиселa иb (b >a) выполняется равенство
b
P(a < X <b) =\ f (x)dx
a
x
F(x)
= {f (x)dx f(x)
=F'(x)
—да
Явления, носящие случайный характер, также как и закономерные явления подчиняются определённым законам, с помощью которых можно определить, какова будет вероятность того, что случайная величина примет интересующее нас значение. Распределения вероятностей случайных величин могут быть дискретными и непрерывными. Наиболее важным непрерывным распределением вероятностей, используемых в аналитической химии, является нормальное распределение.Примерами одномерного нормального распределения являются идеальный хроматографический пик или полоса поглощения в электронном спектре.
2)F(x)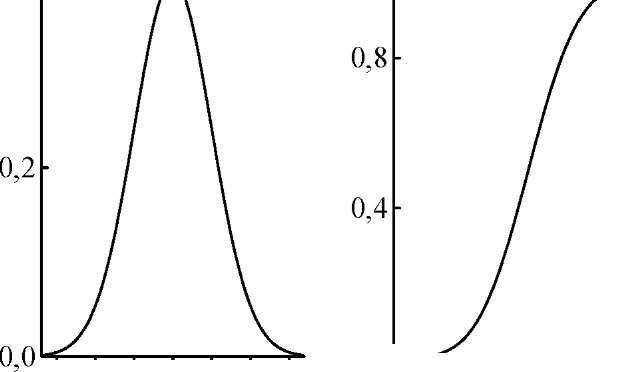
fx)
0,0^—1—.—.—.—.—г
-3
-2 -1 0 1 2 3 x
-3-2-10123
Рис.
10.3.Графики
плотности вероятности (1) и функции (2)
стандартного нормального
распределения(2)
x
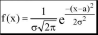
Графики плотности вероятности нормального распределения и функции нормального распределения показаны на рис. 10.3.
!) 0,4
Любое нормальное распределение описывается двумя параметрами: параметр апо смыслу является математическим ожиданием случайной величины и характеризует положение графика функцииf(x) относительно числовой оси, параметр а (а > 0), характеризующий растяжение (сжатие) графика, будучи возведённым в квадрат, равен дисперсии случайной величины. Нормальное распределение с а= 0 и а = 1 называется стандартным нормальным распределением.
Вероятность попадания значений нормально распределённой случайной величины в интервал a ± 3а составляет 99,73%, т.е. практически все значения нормально распределённой случайной величины находятся в этом интервале. Это свойство нормального распределения называется "правилом За".
Для характеристики случайной величины на практике пользуются выборкой. Выборкойназывается последовательность независимых одинаково распределённых случайных величин. Выборка, пронумерованная в порядке возрастания, т.е.x1, x2 ...xn, называется вариационным рядом.Сами значенияx называются вариантами,аn - объёмом выборки.В табл. 10.1 приведены основные характеристики, используемые для описания выборки.
Табл. 10.1.
Основные характеристики, используемые для описания выборки
|
Характеристика |
Определение понятия |
Расчётная формула |
|
выборочное среднее |
сумма всех значений серии наблюдений, делённая на число наблюдений |
n Z x. x = ■=' n |
|
выборочная дисперсия (исправленная) |
сумма квадратов отклонений, делённая на число степеней свободы. Число степеней свободы f =n-1 - число переменных, которые могут быть присвоены произвольно при характеристике данной выборки |
Z(x. -x)2 S2 = 1= n -1 |
|
выборочное стандартное отклонение |
положительный квадратный корень из выборочной дисперсии |
S =VS? |
|
стандартное отклонение выборочного среднего |
отношение выборочного стандартного отклонения к положительному квадратному корню из числа наблюдений |
S- = A Vn |
|
относительное стандартное отклонение |
отношение выборочного стандартного отклонения к выборочному среднему |
Sr =S x |
Чем меньше число степеней свободы (n-1), тем в большей степени выборочные характеристики отличаются от характеристик случайной величины. Для характеристики выборок малых объёмов(n <30), взятых из нормально распределённых генеральных совокупностей, используют распределение Стьюдента(t-распределение), представляющее собой распределение случайной величиныt
x-a , x-a ч t = = (илиt = )
S/Vn Sx
Данное распределение зависит только от объёма выборки и не зависит от неизвестных параметров a и а. Приn ^ да распределение Стьюдента переходит в стандартное нормальное распределение.
Распределение Стьюдента можно использовать для расчёта доверительного интервала выборочного среднего (в том случае, если выборка имеет нормальное распределение). Доверительным интерваломназывается интервал, вероятность попадания значений случайной величины в который равна принятой нами доверительной вероятности 1-а, где а - уровень значимости (в аналитической практике а = 0,05). Неизвестное математическое ожидание с вероятностью 1-а попадёт в интервал:
-
tSx;x
+tSx [
Например, если а = 0,05 и f = 5, то доверительный интервал для выборочного среднего равен ±2,57 Sx.
