
- •Белки, их строение и биологическая роль
- •Строение белков. Первичная структура.
- •Вторичная структура
- •Третичная структура
- •Понятие о нативном белке
- •Классификация. Биологические и химические свойства белков
- •Физико-химические свойства белков
- •Биохимия сложных белков
- •Некоторые особенности строения миоглобина и гемоглобина
- •Гемаглобинопатии
- •Ферменты
- •Механизм действия ферментов. Основные черты ферментативного катализа, его этапы.
- •1. Частичный протеолиз (Трипсиноген------ Трипсин)
- •Факторы, оказывающие влияние на активность ферментов.
- •Конкурентное ингибирование.
- •Неконкурентное ингибирование.
- •Биохимия нуклеотидов и нуклеиновых кислот. Матричные биосинтезы.
- •Характеристика репликации.
- •Транскрипция. Трансляция.
- •1).Инициация
- •1. Обмен веществ включает в себя 3 этапа:
- •Организация цпэ (по рис.1)
- •Функции дыхательной цепи:
- •Дыхательный контроль.
- •Токсичное действие кислорода. Защита от токсичного действия кислорода.
- •Обмен углеводов.
- •Функции углеводов.
- •Всасывание углеводов в кишечнике.
- •Метаболизм глюкозы.
- •Гликолиз (дихотомический процесс).
- •Биомедицинское значение ферментативных реакций гликолиза.
- •Суммарная реакция и выход энергии при гликолизе.
- •Пентофозофосфатный путь ( пфп).
- •Биомедицинское значение.
- •Общая схема биохимических реакций пфп.
- •Медицинское значение.
- •Глюконеогенез.
- •Биомедицинское значение.
- •Биомедицинское значение.
- •Биосинтез гликогена.
- •Обмен фруктозы и галактозы.
- •Обмен липидов.
- •Функции липидов в организме.
- •Переваривание и всасывание жиров.
- •Желчные кислоты.
- •Всасывание продуктов гидролиза.
- •Биосинтез кетоновых тел.
- •Распад кетоновых тел.
- •Биосинтез высших жк.
- •Синтез жиров (таг).
- •Отличие действия инсулина в жировой ткани и печени:
- •Синтез холестерина.
- •Биосинтез Хс.
- •Ферменты.
- •Регуляция синтеза нуклеотидов.
- •Синтез пиримидиновых нуклеотидов.
- •Регуляция.
- •Катаболизм.
- •Катаболизм пуриновых нуклеотидов.
- •Регуляция обмена веществ. Гормоны (химические посредники).
- •1. По химической структуре:
- •2. По механизму действия;
- •3. По влиянию на организм:
- •Синтез и секреция гормонов.
- •Механизм действия гормонов белково-пептидной природы через вторичных посредников.
- •Эффекты, осуществляемые через ц амф.
- •Кальций как вторичный посредник.
- •Биохимия печени
- •Обезвреживающая функция печени
- •Обезвреживание веществ
- •Отличие этих цепей от цпэ
- •Удф-глюкуронилтрансферазы
- •Биохимия крови
- •Белки плазмы крови
- •Сывороточный альбумин
- •Глобулины
- •Конверсия метгемоглобина
- •Биосинтез тема и его регуляция
- •Гемостаз
- •1 Фаза: первичный гемостаз.
- •2 Фаза: гемокоагуляция
- •Фибрина
- •Противосвертывающая система
- •Биохимический_анализ
- •Гормоны
- •Липотропины
Транскрипция. Трансляция.
Заключается в переводе информации, заключенной в последовательности нуклеотидов матричной-РНК, в последовательность аминокислот в белке, т.е. матрицей для синтеза белка является матричная РНК.
Субстраты - аминокислоты, источники энергии - АТФ и ГТФ. Биосинтез белка - циклический процесс:
инициация
элонгация
терминация
Для вступления в биосинтез аминокислоты должны быть активированы. Активация
аминокислот - образование аминоацил-m-PHK (аминокислота своей СООН-группой
присоединяется к 3-ОН-группе акцепторного участка т-РНК).
Происходит это при помощи специфических ферментов (для каждой аминокислоты -
свой фермент).
Аминоацил-m-PHK синтетаза (участвует в реакции активации аминокислот)
Молекулы т-РНК являются адаптерами.
1).Инициация
Заключается в формировании белоксинтезирующего мультиферментного комплекса рибосомы. Рис.1
- формил Met, присоединяется к малой субъединице рибосомы.
З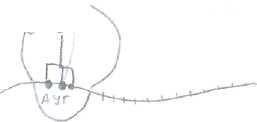 атем
этот комплекс присоединяется к матричной
атем
этот комплекс присоединяется к матричной
РНК в специальном стартовом кодоне по принципу
комплиментарности, матричная РЕК удерживается
в специальной бороздке. Затем к малой субъединице
присоединяется большая (состоящая из А- и Р-участков), так что инициирующая аминоацил-m-PHK оказывается в Р-участке, А-участок свободен. Р-пептидил-m-PHK -связывающий, А-аминоацильный (рис.2)
В процессе инициации принимают участие белковые факторы инициации. Фактор инициации 3 катализирует связывание матричной-РНК с малой субъединицей рибосомы. Фактор инициации 2 взаимодействует с инициирующей т-РНК и ГТФ и в присутствии фактора инициации 1 присоединяет т-РНК к первому кодону матрицы. Образуется инициирующий комплекс. Факторы высвобождаются, после этого к ГТФ присоединяется большая субъединица, при этом происходит гидролиз ГТФ.
2). Элонгация
Заключается в наращивании ППЦ от NH2 - к СООН-концу. Циклический процесс. Включает 3 этапа (идет в присутствии факторов элонгации):
связывание аминоацил-m-PHK, несущей другую аминокислоту;
образование пептидной цепи;
транслокация рибосомы.
На первом этапе молекула аминоацил-m-PHK, несущая любую аминокислоту, связывается со свободным А-участком, с комплиментарным кодоном матричной-РНК. А- и Р- участки расположены близко друг к другу так, что 2 связанные аминоацил-m-PHK спариваются с двумя соседними ко донами (фактор элонгации 1, 1 молекула ГТФ)
На втором этапе происходит расщепление макроэргической связи между т-РНК и аминокислотой, находящейся в Р-участке (рис.1) и засчет энергии разрыва этой связи в присутствии воды образуется пептидная связь между свободными СООН-концом аминокислотой Р-участка и NH2 —группой аминокислоты в А-участке (пептидилтрансфераза прочно связан с рибосомой).
Дополнительной энергией АТФ и ГТФ не требуется для синтеза пептидной связи, т.к. используется энергия макроэргической связи —> в Р-участке т-РНК становится свободной, а растущая ППЦ прикреплена к т-РНК в А-участке.
На третьем этапе происходит транслокация или перемещение рибосомы на один кодон с затратой энергии АТФ (фактор элонгации 2) в направлении 5—>3 т-РНК с растущей ППЦ переносится в Р-участок, а свободная аминокислота — в цитоплазму.
3). Терминация
Рибосома перемещается до тех пор, пока не встретит стоп ко доны: УАА, УАГ, УГА. К ним нет аминоацил-m-PHK. Вместо этого в А-участок присоединяется особый белок - фактор освобождения - это изменяет активность фермента и он присоединяет к растущему СООН-концу воду —> карбоксильный конец отделяется от т-РНК и синтезированная цепь уходит в цитоплазму.
Рибосома распадается, ППЦ отделяется.
Антибиотики, бактериальные токсины - ингибиторы матричных биосинтезов.
Энергетический обмен и общие пути катаболизма. Вопросы:
связь обмена веществ с обменом энергии. Понятие об ОВР.
общие пути катаболизма
а) цикл трикарбоновых кислот
б) окислительное карбоксилирование ПВК
в) молекулярная организация митохондриальной ЦПЭ
г) синтез АТФ. Хемоосметическая теория Митчелла.
3. ингибиторы дыхательной цепи и разобщители окислительного фосфорилирования
