
- •Основы молекулярно-кинетической теории (мкт)
- •Давление
- •Основное уравнение мкт
- •Скорости молекул газа (распределение Максвелла)
- •Газ в поле тяжести (распределение Больцмана)
- •Внутренняя энергия.
- •Работа , совершаемая при расширении вещества.
- •Теплота q.
- •Первое начало термодинамики. Первое начало термодинамики в процессах идеального газа.
- •Адиабатический процесс.
- •Энтропия.
- •Второе начало термодинамики. К.П.Д. Теплового двигателя.
- •Цикл Карно.
- •Деформация растяжения стержня. Закон Гука.
- •Тепловое расширение твердых тел.
|
ФЕДЕРАЛЬНОЕ АГЕНТСТВО ПО ОБРАЗОВАНИЮ Государственное образовательное учреждение высшего профессионального образования ТЮМЕНСКИЙ ГОСУДАРСТВЕННЫЙ АРХИТЕКТУРНО-СТРОИТЕЛЬНЫЙ УНИВЕРСИТЕТ
Кафедра физики
Величко Т.И.
МЕТОДИЧЕСКИЕ УКАЗАНИЯ ПО КУРСУ ОБЩЕЙ ФИЗИКИ, РАЗДЕЛ «МОЛЕКУЛЯРНАЯ ФИЗИКА И ТЕРМОДИНАМИКА»
для студентов специальности 270205 “Автомобильные дороги и аэродромы” очной и заочной форм обучения
Тюмень, 2009 |
УДК 539.19+536.7
В-27
Величко Т.И. Методические указания по курсу общей физики, раздел «Молекулярная физика и термодинамика», для студентов специальности 270205 «Автомобильные дороги и аэродромы» очной и заочной форм обучения. - Тюмень: РИО ГОУ ВПО ТюмГАСУ, 2009. – 16 с.
Методические указания представляют собой краткое содержание лекций по общей физике, раздел «Молекулярная физика и термодинамика».
Методические указания могут использоваться как справочное пособие при проведении практических и лабораторных занятий, при выполнении контрольных работ.
Рецензент: Михеев В.А.
Тираж 100 экз.
© ГОУ ВПО «Тюменский государственный архитектурно-строительный университет »
© Величко Т.И.
Редакционно-издательский отдел ГОУ ВПО «Тюменский государственный архитектурно-строительный университет »
СОДЕРЖАНИЕ
Основы молекулярно-кинетической теории____________________4 стр
Термодинамика ___________________________________________9 стр
Реальные газы____________________________________________14 стр
Жидкости __________________________________________ 14 стр
Твердые тела_____________________________________________ 15 стр
Список рекомендуемой литературы __________________________16 стр
Основы молекулярно-кинетической теории (мкт)
ОСНОВНЫЕ ПОНЯТИЯ
-
Плотность
 вещества,
вещества,
![]() ,
,
![]() .
(1)
.
(1)
![]() -
масса вещества в объеме
-
масса вещества в объеме
![]() .
.
-
Концентрация
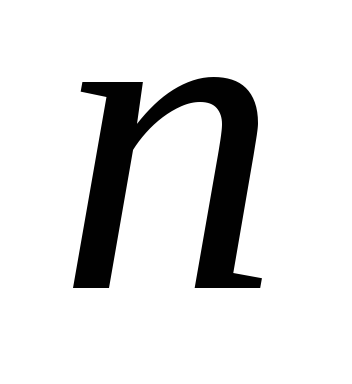 молекул,
молекул,
![]() ,
,
![]() м-3
. (2)
м-3
. (2)
![]() -число
молекул в объеме
-число
молекул в объеме
![]() .
.
-
Давление
![]() ,
,
![]() =Па
(Паскаль). (3)
=Па
(Паскаль). (3)
![]() -
сила, действующая на площадку
-
сила, действующая на площадку
![]() ,
перпендикулярную направлению силы.
,
перпендикулярную направлению силы.
1мм.рт.ст.=133 Па.
-
Количество молекул (атомов) вещества, содержащее столько же молекул, сколько их содержит 12 грамм изотопа углерода
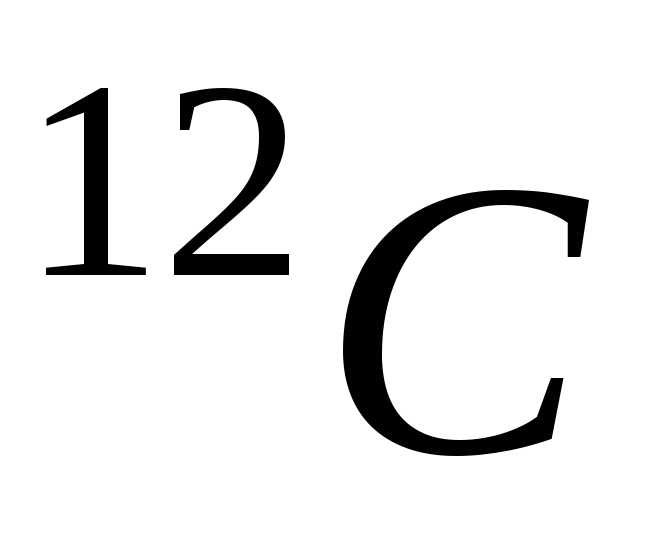 ,
называется молем
вещества. Один моль вещества содержит
,
называется молем
вещества. Один моль вещества содержит
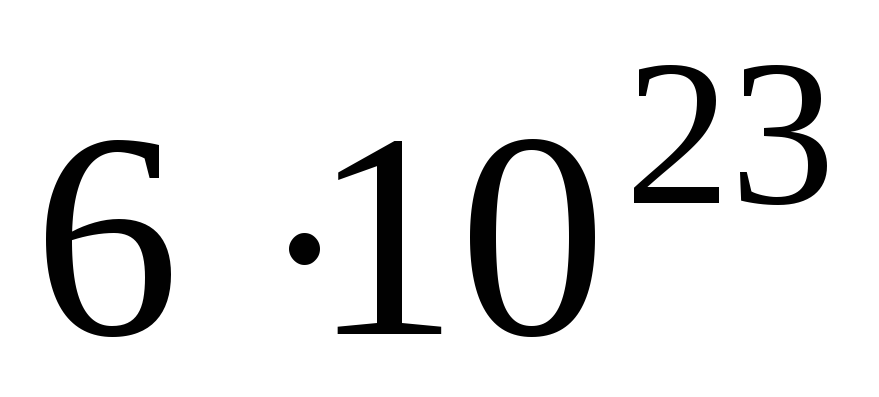 молекул. Это число называется числом
Авогадро
молекул. Это число называется числом
Авогадро
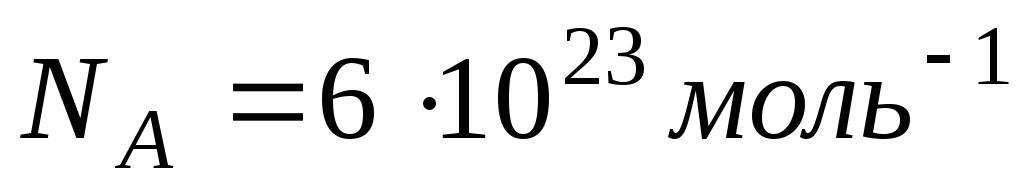 .
Масса моля вещества называется молярной
массой
.
Масса моля вещества называется молярной
массой
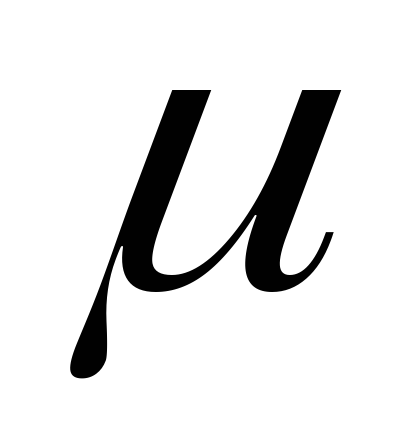 .
Молярная масса определяется по таблице
Менделеева, например для воды (
.
Молярная масса определяется по таблице
Менделеева, например для воды (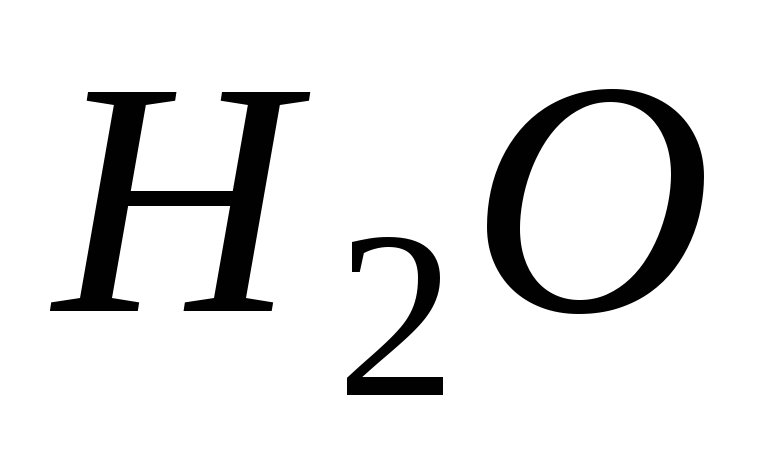 ),
),
![]() г/моль=
г/моль=![]() кг/моль
кг/моль
Количество молей (количество вещества)
![]() ,
,
![]() моль.
(4)
моль.
(4)
-
Масса одной молекулы
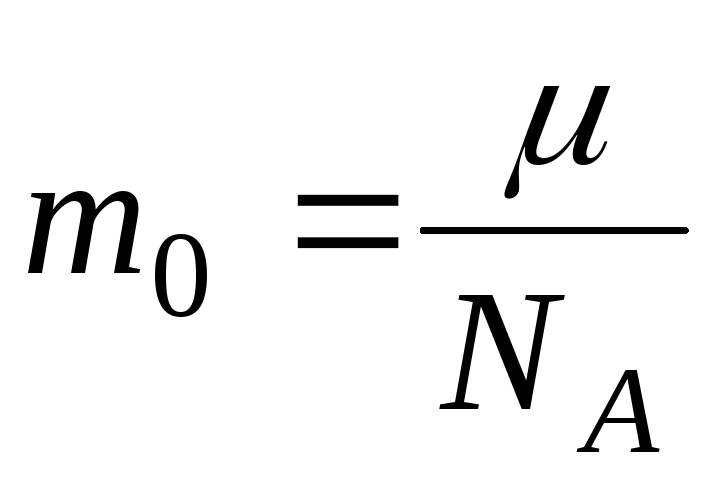 .
Плотность
.
Плотность
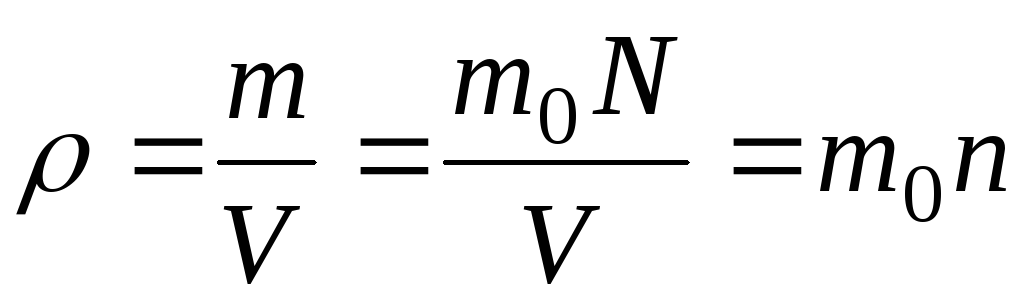 .
. -
Температура
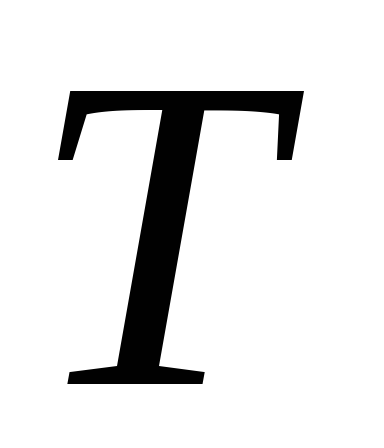 по шкале Кельвина связана с температурой
по шкале Кельвина связана с температурой
 по Цельсию:
по Цельсию:
![]() =
=![]() +273
K.
+273
K.
ИДЕАЛЬНЫЙ ГАЗ
Идеальным называется газ, удовлетворяющий трем условиям:
-
можно пренебречь взаимодействием молекул;
-
можно пренебречь собственным объемом молекул;
-
соударения молекул можно рассматривать как абсолютно упругие.
Азот N2, кислород O2 , водород H2, пары воды H2O и другие газы при условиях, близких к нормальным, удовлетворяют условиям идеальности.
Нормальные условия (н.у.):
температура t=0°С и давление p=760 мм.рт.ст.=101,3 кПа.
Характеристиками молекул газа при их хаотичном тепловом движении являются:
-
Эффективный диаметр d молекулы – минимальное расстояние, на которое сближаются молекулы при соударениях.
-
Средняя арифметическая скорость молекул
![]()
![]() .
(5)
.
(5)
3.
Средняя длина
свободного пробега
![]() молекулы - среднее расстояние, которое
пролетает молекула между двумя
последовательными соударениями,
молекулы - среднее расстояние, которое
пролетает молекула между двумя
последовательными соударениями,
![]() .
(6)
.
(6)
4. Среднее
число
![]() столкновений молекул
в единицу времени,
столкновений молекул
в единицу времени,
![]() .
(7)
.
(7)
Законы идеального газа:
-
Закон Дальтона: давление
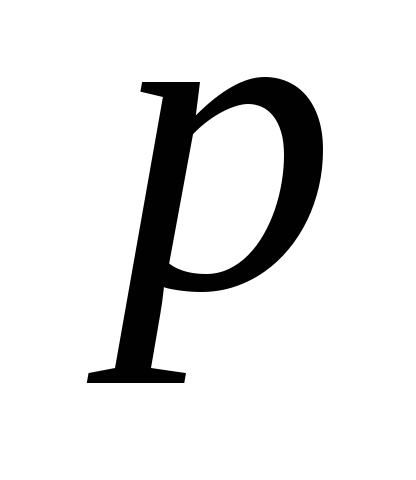 смеси газов равно сумме парциальных
давлений
смеси газов равно сумме парциальных
давлений
![]() .
(8)
.
(8)
Парциальное давление – это давление, которое оказывал бы один газ из смеси, если бы занимал весь объем сосуда. Из закона Дальтона следует, что количество молей ν смеси равно сумме молей отдельных газов
ν=ν1+ν2+ν3+… (9)
-
Уравнение состояния идеального газа (уравнение Менделеева-Клапейрона)
![]() ,
(10)
,
(10)
![]() -давление
газа,
-давление
газа,
![]() -
его объем,
-
его объем,
![]() – масса газа,
– масса газа,
![]() -
молярная масса,
-
молярная масса,
![]() =8,31
Дж/(моль·К) – газовая постоянная,
=8,31
Дж/(моль·К) – газовая постоянная,
![]() – температура в Кельвинах.
– температура в Кельвинах.
Также уравнение состояния записывают в форме
![]() ,
(11)
,
(11)
![]() =1,38·10-23
Дж/K
– постоянная Больцмана,
=1,38·10-23
Дж/K
– постоянная Больцмана,
![]() - концентрация молекул.
- концентрация молекул.

