
- •Классы неорганических сложных веществ
- •Алгоритмы составления химических формул
- •Написание химических формул
- •Классификация неорганических веществ и их свойства
- •Химические свойства основных оксидов
- •Химические свойства кислотных оксидов
- •Химические свойства амфотерных оксидов
- •Получение оксидов
- •Основания
- •Химические свойства оснований
- •Получение оснований
Простое вещество образовано атомами какого-либо одного элемента, и поэтому является формой его существования в свободном состоянии. Например, гелий He, кислород O2, озон O3, сера S8, железо, графит, алмаз, водород Н2, белый фосфор Р4.
Сложные вещества образованы атомами разных элементов и могут иметь состав постоянный (стехиометрические соединения, или дальтониды) или меняющийся в некоторых пределах (нестехиометрические соединения, или бертоллиды).
Классы неорганических сложных веществ
|
Класс |
Название |
Формула |
|
Оксиды |
Оксид алюминия |
Al2О3 |
|
Гидроксиды |
Гидроксид кальция |
Са(ОН)2 |
|
Сульфиды |
Сульфид железа (II) |
FeS |
|
Хлориды |
Хлорид натрия |
NaCl |
|
Гидриды |
Гидрид лития |
LiH |
Оксид – химическое соединение, состоящее из двух элементов, одним из которых является кислород.
Кислотный оксид: оксид, которому соответствует кислота. Большинство кислотных оксидов при соединении с водой образуют кислоты, например
диоксид
углерода: СО2
+ Н2О
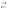 Н2СО3
Н2СО3
Некоторые кислотные оксиды с водой не взаимодействуют, однако сами они могут быть получены из соответствующей кислоты, например
Н2SiО3 = SiО2 + Н2О
Кислотные оксиды образуются неметаллами и некоторыми металлами, атомы которых проявляют высокую степень окисления (например оксиду Mn2+7O7 соответствует марганцовая кислота HMnO4).
Оснóвный оксид: оксид, которому соответствует основание.
Некоторые основные оксиды при взаимодействии с водой образуют основания, например
оксид кальция: СаО + Н2О = Са(ОН)2
Другие основные оксиды непосредственно с водой не взаимодействуют, а соответствующие им основания получают из солей,
например NiSO4 + 2 NaOH = Ni(OH)2 + Na2SO4
Основные оксиды образуются только металлами.
Амфотерный оксид: оксид, который с кислотой реагирует как основание, а с основанием – как кислота.
Оксид алюминия: Al2O3 + 3H2SO4 = Al2(SO4)3 + 3Н2О
Al2O3 + 2NaOH + 3Н2О = 2Na[Al(OH)4]
Основные, кислотные и амфотерные оксиды называются солеобразующими. Оксиды, не проявляющие ни основных, ни кислотных свойств, то есть не образующие солей, называются безразличными или индифферентными, например: CO, N2O, NO, SiO.
Кислота
Химическое соединение, которое в водном растворе полностью или частично диссоциирует на положительно заряженные ионы (катионы) водорода и отрицательно заряженные ионы (анионы) кислотного остатка:
HNO3
= H+
+ NO3–,
HNO2
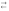 Н+
+ NО2–
Н+
+ NО2–
Азотная Азотистая
кислота кислота
Химическая частица (молекула, ион), которая при взаимодействии с основанием (в водном растворе – с молекулой воды) отдаёт ион водорода, или формально протон (донор протона).
НNО3
+ Н2О
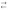 NО3–
+ Н3О+
NО3–
+ Н3О+
NH4+
+ Н2О
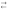 NН3
+ Н3О+
NН3
+ Н3О+
кислота основание
Химическая частица, обладающая по крайней мере одной свободной атомной орбиталью, которая может принять электронную пару от какого-либо основания (акцептор электронной пары):
Н+ (Н3О+), BF3, Al(OH)3
Основание
Химическое соединение, которое в водном растворе полностью или частично диссоциирует на положительно заряженные ионы (простые или сложные) и отрицательно заряженные гидроксид-ионы:
NaOH
= Na+
+ ОН– NH3
· Н2О
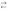 NH4+
+ ОН–
гидроксид натрия
гидрат аммиака1
NH4+
+ ОН–
гидроксид натрия
гидрат аммиака1
Химическая частица (молекула, ион), которая при взаимодействии с кислотой (в водном растворе – с молекулой воды) принимает ион водорода, или формально протон (акцептор протона):
NH3
+ Н2О
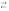 NH4+
+ OH–
NH4+
+ OH–
СН3СОО–
+ Н2О
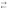 СН3СООН
+ ОН–
СН3СООН
+ ОН–
Химическая частица, обладающая по крайней мере одной неподелённой электронной парой, которая может быть передана на свободную атомную орбиталь какой-либо кислоты (донор электронной пары):
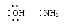
Щёлочь – растворимое в воде основание, создающее в водном растворе большую концентрацию ионов ОН–. Обычно к щелочам относят гидроксиды щелочных и щелочно-земельных металлов.
Гидроксиды щелочных металлов – едкие щёлочи.
Иногда к щелочам относят соли, содержащие катионы сильных оснований и анионы слабых кислот, водные растворы которых имеют щелочную реакцию, например гидросульфиды NaSH и KSH, карбонат Na2CO3, а также TlOH и аммиачную воду.
Амфотерный гидроксид – соединение, которое может реагировать как кислота (с более сильным основанием) и как основание (с более сильной кислотой).
Аl(ОН)3 + ОН– = [Al(OH)4]–
кислота основание
Аl(ОН)3 + 3Н3О+ = [Al(H2О)6]3+
основание кислота
Соль – кристаллическое соединение, состоящее из положительно заряженных ионов металла или аммония (катионов) и из отрицательно заряженных ионов кислотного остатка (анионов).
Соли имеют в твёрдом состоянии ионную кристаллическую решётку и образуют в водном растворе или в расплаве свободно двигающиеся ионы:
Na+NО3– NH4+Cl–
нитрат натрия хлорид аммония
В газообразном состоянии соли существуют в молекулярной форме.
