
- •1. Основные понятия термодинамики
- •2. Первый закон термодинамики
- •Первое следствие. Энтальпия реакции равна разности алгебраической суммы энтальпий образования всех продуктов реакции и алгебраической суммы энтальпий образования всех исходных веществ:
- •Второе следствие Энтальпия прямой реакции численно равна энтальпии обратной реакции, но с противоположным знаком:
- •3. Понятие о самопроизвольных процессах. Энтропия
- •4. Второй закон термодинамики.
- •Биохимические реакции
- •5. Принцип энергетического сопряжения биохимических реакций
- •6. Особенности термодинамики биохимических процессов в равновесных и стационарных состояниях. Понятие о гомеостазе
- •Заключение
- •Контрольные задания
- •Вариант 13
- •Вариант 14
- •Вариант 15
- •Типовые тестовые задания
- •Контрольные тестовые задания
- •Список литературы
- •Стандартные энтальпии образования, энтропии и энергии гиббса образования некоторых веществ при 298 к (25 оС)
- •Содержание
Биохимические реакции
Биохимические реакции сопровождающиеся уменьшением энергии Гиббса (Gр < 0), называют экзэргоническими реакциями; они могут совершаться самопроизвольно. Если в течение экзэргонической реакции энергия Гиббса только понижается, как показано на рис. 1, то такая реакция протекает самопроизвольно и необратимо. Чем больше значение энергии Гиббса биохимической системы в начальном состоянии по сравнению с её значением в конечном состоянии, тем больше химическое сродство между реагентами в рассматриваемой системе, то есть их реакционная способность.

Рис. 1. Изменение энергии Гиббса в закрытой системе
в необратимых экзэргонических реакциях,
совершаемых самопроизвольно (р, Т = const)
Критерий Gp < 0 свидетельствует только о термодинамической возможности протекания данного процесса и ничего не говорит о скорости процесса и необходимых условиях для его начала.
Например, горение графита:
С + O2
![]() СО2
СО2
по законам
термодинамики может происходить при
стандартных условиях, так как
![]() =393,5
кДж/моль. Но графит при 298 К с молекулярным
кислородом не реагирует, а чтобы реакция
пошла, необходимо создать определённые
условия (запал, катализатор) для увеличения
её скорости.
=393,5
кДж/моль. Но графит при 298 К с молекулярным
кислородом не реагирует, а чтобы реакция
пошла, необходимо создать определённые
условия (запал, катализатор) для увеличения
её скорости.
Биохимические реакции, сопровождающиеся увеличением энергии Гиббса (рис. 2), называются эндэргоническими (Gp > 0), и они невозможны без внешнего подвода энергии. Для того чтобы подобная реакция происходила, надо постоянно подводить энергию.
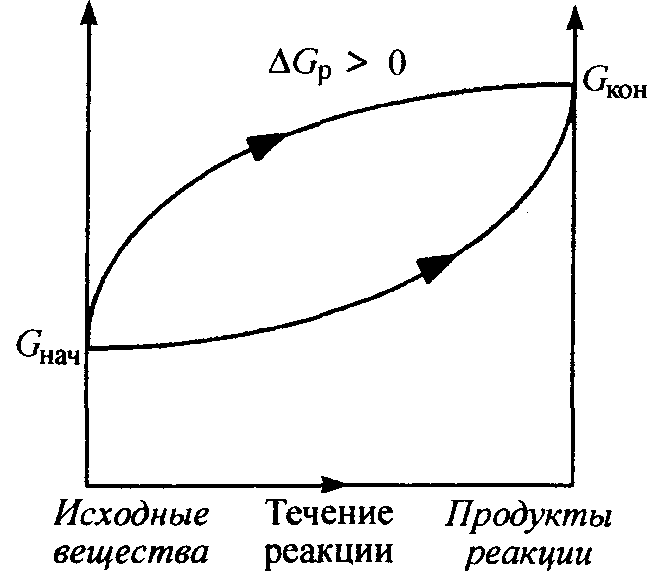
Рис. 2. Изменение энергии Гиббса в закрытой системе
в необратимых эндэргонических реакциях
(р, Т = const).
Например, процесс фотосинтеза в растениях идёт только под воздействием солнечной энергии:
6СО2
+ 6Н2О
![]() C6H12O6
+ 6О2.
Gp
= +2870 кДж/моль.
C6H12O6
+ 6О2.
Gp
= +2870 кДж/моль.
В живых системах эндэргонические реакции происходят за счёт их сопряжения с экзэргоническими реакциями.
Таблица
|
р, Т = const Взаимосвязь термодинамических величин
| ||||||
|
| ||||||
|
Химическое равновесие
|
5. Принцип энергетического сопряжения биохимических реакций
Живая клетка для своего существования нуждается в энергии. При этом некоторые (гетеротрофные) клетки получают необходимую энергию в основном за счёт окисления продуктов питания, а для некоторых (прототрофныхклеток источником энергии часто является солнечный свет. Полученная энергия переводится клетками обоих типов с довольно хорошим КПД (~40 %) в химическую энергию за счёт синтеза в них аденозинтрифосфорной кислоты (АТФ):
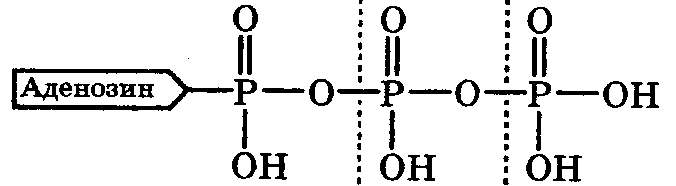
АТФ выполняет функцию аккумулятора энергии, так как при его гидролизе (расщеплении водой), образуются аденозиндифосфорная (АДФ) и ортофосфорная (Ф) кислоты и выделяется энергия. Поэтому АТФ называется макроэргическим соединением, а разрывающаяся при его гидролизе связь О–Р макроэргической.
Макроэргической связью называется химическая связь, при гидролизе которой выделяется значительная энергия:
АТФ + Н2О АДФ + Ф Gр = 30,5 кДж/моль;
АДФ + Н2О
АМФ + Ф
![]() =30,5
кДж/моль;
=30,5
кДж/моль;
АТФ + 2Н2О
АМФ + 2Ф,
![]() =61,0
кДж/моль.
=61,0
кДж/моль.
Разрыв любой химической связи (в том числе и макроэргической) всегда требует затраты энергии. В случае же гидролиза АТФ кроме процесса разрыва связи между фосфатными группами, для которого G > 0, происходят процессы гидратации (присоединение воды), изомеризации и нейтрализации продуктов, образующихся при гидролизе. В результате этих процессов суммарное изменение энергии Гиббса имеет отрицательное значение (∑∆G < 0). Следовательно, макроэргическим является не разрыв связи, а энергетический результат реакции гидролиза.
АТФ функционирует в клетках как промежуточный продукт, обеспечивающий организм энергией, необходимой для протекания жизненно важных эндэргонических процессов: синтеза метаболитов (химическая работа), сокращения мышц (механическая работа), переноса вещества через мембраны против градиента концентрации (активный транспорт) и передачи информации (в частности, для передачи нервных импульсов).
Для протекания в
живых системах эндэргонических
реакций (Gp
> 0), необходимо, чтобы они были сопряжены
с экзэргоническими реакциями (Gp
< 0). Такое сопряжение возможно, если
обе реакции имеют какое-либо общее
промежуточное химическое соединение
и на всех стадиях сопряжённых реакций
суммарный процесс характеризуется
отрицательным значением изменения
энергии Гиббса (Σ∆Gconp.
p
![]() 0).
0).
Например, синтез сахарозы является эндэргонической реакцией и самопроизвольно происходить не может:
Глюкоза + Фруктоза
→ Сахароза + Н2О,
![]() = +20,9 кДж/моль
= +20,9 кДж/моль
Однако сопряжение этой реакции с экзэргонической реакцией гидролиза АТФ, сопровождающееся образованием общего промежуточного соединения глюкозо-1-фосфата, приводит к тому, что суммарный процесс имеет ∑Gр < 0:
АТФ + Глюкоза + Фруктоза → Сахароза + АДФ + Ф,
![]() = 29,2
кДж/моль.
= 29,2
кДж/моль.
Наряду с АТФ в живых организмах имеются более эффективные макроэргические фосфорилированные соединения, гидролиз которых сопровождается выделением большей энергии. Так, стандартная энергия Гиббса для гидролиза креатинфосфата, 3-фосфоглицерилфосфата и фосфоенолпирувата равна соответственно 43,1, 49,4 и 61,9 кДж/моль. С помощью этих соединений происходит синтез АТФ из АДФ, а АДФ из АМФ.
Таким образом, внутренним источником энергии в живых системах являются фосфорилированные соединения, при взаимодействии которых с биосубстратами, включая воду, выделяется энергия. В результате сопряжения этих экзэргонических реакций с эндэргоническими реакциями обеспечивается протекание в клетке необходимых эндэргонических процессов.



