
- •Типовые аттестационные задания по химии Учебно-методическое пособие
- •Дорогой студент !
- •1. Классификация и свойства неорганических соединений
- •2. Основные понятия и законы химии
- •3. Строение вещества
- •3.1. Строение атома
- •3.2. Периодический закон и периодическая система химических элементов д.И. Менделеева
- •3.3. Химическая связь
- •4. Основы термодинамики
- •4.1. Термохимические понятия и расчёты
- •4.2. Элементы химической термодинамики
- •5. Общие закономерности химических процессов
- •5.1. Химическая кинетика
- •5.2. Химическое равновесие
- •5.3. Поверхностные явления и адсорбция
- •6. Дисперсные системы
- •6.1. Грубодисперсные системы
- •6.2. Коллоидные системы
- •7. Растворы
- •7.1. Способы выражения состава растворов
- •7.2. Коллигативные свойства разбавленных растворов неэлектролитов
- •8. Растворы электролитов
- •8.1. Свойства растворов электролитов
- •8.2. Ионное произведение воды. Водородный показатель
- •8.3. Реакции ионного обмена
- •8.4. Гидролиз солей
- •9. Окислительно-восстановительные реакции
- •10. Электрохимические процессы.
- •10.1. Активность и коррозия металлов
- •10.2. Гальванические элементы
- •10.3. Электролиз
- •11. Основы аналитической химии
- •11.1. Качественный химический анализ
- •11.2. Количественный химический анализ
- •11.3. Физико-химические и физические методы анализа. Методы разделения
- •12. Основы органической химии
- •12.1. Органические соединения и реакции
- •12.2. Высокомолекулярные соединения. Методы получения, строение
- •12.3. Биополимеры
- •12.4. Белки. Нуклеиновые кислоты.
- •12.5. Углеводы, или сахара. Липиды, или жиры.
- •2. Растворимость кислот, оснований и солей в воде
- •3. Относительные электроотрицательности атомов
- •4. Стандартные электродные потенциалы
- •Типовые аттестационные задания по химии
4.2. Элементы химической термодинамики
Изменение энтропии в химической реакции равно … .
1) сумме энтропий продуктов реакции
2) разности сумм энтропий исходных веществ и продуктов реакции
3) сумме энтропий исходных веществ
4) разности сумм энтропий конечных и исходных веществ
Энтропия идеально построенного кристалла при Т → 0 К стремится к … .
1) – ∞ 2) 0 3) + ∞ 4) – 273
Увеличение энтропии системы происходит в ряду превращений … .
1) Н2О (г) → Н2О (ж) → Н2О (т)
2) СО2 (г) → СО2 (т) → СО2 (г)
3) I2 (т) → I2 (ж) → I2 (г)
4) О2 (г) → О2 (ж) → О2 (г)
В результате реакций:
4Fе (т) + 3О2 (г) = 2Fе2О3 (т) ;
Н2 (г) + Сl2 (г) = 2НСl (г)
энтропия систем соответственно … .
1) увеличивается, практически не изменяется
2) уменьшается, увеличивается
3) увеличивается, увеличивается
4) уменьшается, практически не изменяется
Для вычисления
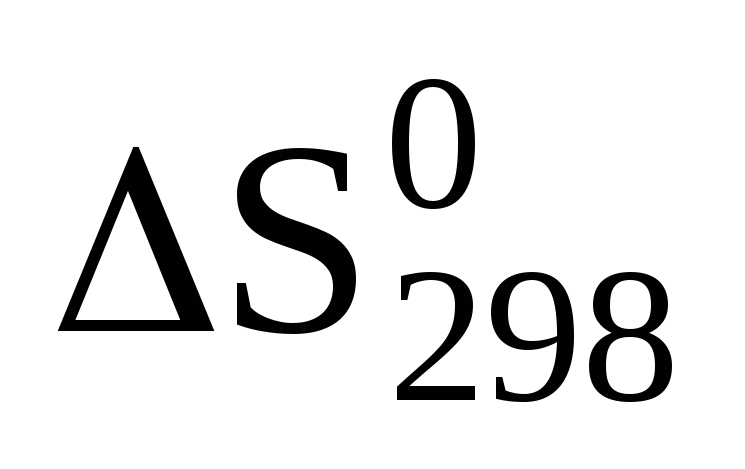 реакции NН4NО2
(т) = N2
(г) + 2Н2О
(ж) следует
воспользоваться уравнением … .
реакции NН4NО2
(т) = N2
(г) + 2Н2О
(ж) следует
воспользоваться уравнением … .
1) ![]()
2)
![]()
3) ![]()
4) ![]()
Энтропия практически не изменяется в реакции … .
1) ![]() =
=![]()
2)
![]() =
=![]()
3) ![]() =
=![]()
4) ![]() =
=![]()
Энергия Гиббса (изобарно-изотермический потенциал) определяется по уравнению … .
1) G = Н + ТS 2) G = S + ТН
3) G = Н – ТS 4) G = S – ТН
Условием возможности химической реакции является … .
1) увеличение энтальпии
2) уменьшение энтропии
3) уменьшение изобарно-изотермического потенциала
4) увеличение энергии Гиббса
Химическая реакция возможна при любых температурах, если … .
1) ΔН < 0 и ΔS < 0 2) ΔН > 0, а ΔS < 0
3) ΔН < 0, а ΔS > 0 4) ΔН > 0 и ΔS > 0
Химическая реакция возможна при достаточно высоких температурах, если … .
1) ΔН < 0 и ΔS < 0 2) ΔН > 0 и ΔS < 0
3) ΔН < 0 и ΔS > 0 4) ΔН > 0 и ΔS > 0
Осуществить реакцию N2 (г) + 2О2 (г) = 2NО2 (г) – Q … .
1) невозможно ни при каких температурах
2) можно при любых температурах
3) можно при низких температурах
4) можно при высоких температурах
При стандартных условиях термодинамически возможна реакция … .
1) 2N2 (г) + О2 (г) = 2N2О (г), ΔН0 > 0
2) 4NН3 (г) + 3О2 (г) = 2N2 (г) + 6Н2О (г), ΔН0 < 0
3) 2Сl2 (г) + 2Н2О (г) = 4НСl (г) + О2 (г), ΔН0 > 0
4) 2NО (г) + О2 (г) = 2NО2 (т), ΔН0 < 0
При стандартных условиях термодинамически более устойчивым соединением является … .
1) Н2О
(ΔG![]() = –229 кДж/моль)
= –229 кДж/моль)
2) Н2S
(ΔG![]() = –34 кДж/моль)
= –34 кДж/моль)
3) Н2Sе
(ΔG![]() = +71 кДж/моль)
= +71 кДж/моль)
4) Н2Те
(ΔG![]() = +138 кДж/моль)
= +138 кДж/моль)
Изменение энергии Гиббса (свободной энергии) в химической реакции равно … .
1) сумме энергий Гиббса продуктов реакции
2) сумме энергий Гиббса исходных веществ
3) разности сумм энергий Гиббса исходных веществ и продуктов реакции
4) разности сумм энергий Гиббса продуктов и исходных веществ
Температура, при которой равновероятны оба направления реакции
N2
(г) + 3Н2
(г)
![]() 2NН3 (г)
(ΔН0
= –92,38 кДж, ΔS0
= –0,198 кДж/К),
2NН3 (г)
(ΔН0
= –92,38 кДж, ΔS0
= –0,198 кДж/К),
равна … К.
1) 92,182 2) 466,6 3) 2,1·10–3 4) 18,3
Из водородных соединений элементов VIА группы
Н2О (г), Н2S (г), Н2Sе (г), Н2Те (г)
(ΔG0298, кДж/моль: –229 –34 + 71 + 138)
термодинамически из простых веществ можно получить … .
1) Н2Sе и Н2S 2) Н2О и Н2S
3) Н2Те и Н2S 4) Н2Sе и Н2О
При стандартных условиях из простых веществ термодинамически можно получить … .
1) Сl2О (г) и СuО (т)
(ΔG![]() = 94,2кДж/моль) (ΔG
= 94,2кДж/моль) (ΔG![]() = –127,2 кДж/моль)
= –127,2 кДж/моль)
2) СаСl2 (т) и НСl (г)
(ΔG![]() = –750,2 кДж/моль) (ΔG
= –750,2 кДж/моль) (ΔG![]() = –95,3 кДж/моль)
= –95,3 кДж/моль)
3) С2Н4 (г) и С2Н6 (г)
(ΔG![]() = 68,1 кДж/моль) (ΔG
= 68,1 кДж/моль) (ΔG![]() = –32,9 кДж/моль)
= –32,9 кДж/моль)
4) NО (г) и NН3 (г)
(ΔG![]() = 86,7 кДж/моль) (ΔG
= 86,7 кДж/моль) (ΔG![]() = 16,6 кДж/моль)
= 16,6 кДж/моль)
Из значений изменений энергий Гиббса (ΔG
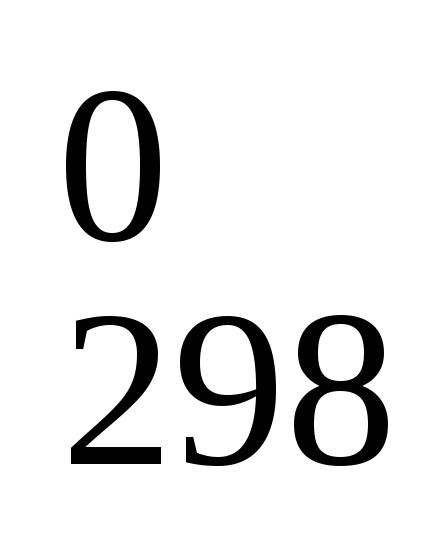 )
реакций:
)
реакций:
СаО
(т) + SО3
(г) = СаSО4
(т) (ΔG![]() = –347 кДж);
= –347 кДж);
ВаО
(т) + SО3
(г) = ВаSО4
(т) (ΔG![]() = –466 кДж);
= –466 кДж);
СuО
(т) + SО3
(г) = СuSО4
(т) (ΔG![]() = –24,7 кДж);
= –24,7 кДж);
FеО
(т) + SО3
(г) = FеSО4
(т) (ΔG![]() = –115 кДж)
= –115 кДж)
следует, что наиболее выраженными оснóвными свойствами обладает … .
1) СuО 2) СаО 3) ВаО 4) FеО
Знаки изменения свободной энергии реакций:
РbО2
(т) + Рb
(т) = 2РbО
(т) (ΔG![]() < 0);
< 0);
SnО2
(т) + Sn
(т) = 2SnО
(т) (ΔG![]() > 0)
> 0)
показывают, что для атомов свинца и олова более характерными в химических соединениях являются степени окисления соответственно … .
1) +4 и +2 2) +2 и +4 3) +4 и +4 4) +2 и +2
