
- •Типовые аттестационные задания по химии Учебно-методическое пособие
- •Дорогой студент !
- •1. Классификация и свойства неорганических соединений
- •2. Основные понятия и законы химии
- •3. Строение вещества
- •3.1. Строение атома
- •3.2. Периодический закон и периодическая система химических элементов д.И. Менделеева
- •3.3. Химическая связь
- •4. Основы термодинамики
- •4.1. Термохимические понятия и расчёты
- •4.2. Элементы химической термодинамики
- •5. Общие закономерности химических процессов
- •5.1. Химическая кинетика
- •5.2. Химическое равновесие
- •5.3. Поверхностные явления и адсорбция
- •6. Дисперсные системы
- •6.1. Грубодисперсные системы
- •6.2. Коллоидные системы
- •7. Растворы
- •7.1. Способы выражения состава растворов
- •7.2. Коллигативные свойства разбавленных растворов неэлектролитов
- •8. Растворы электролитов
- •8.1. Свойства растворов электролитов
- •8.2. Ионное произведение воды. Водородный показатель
- •8.3. Реакции ионного обмена
- •8.4. Гидролиз солей
- •9. Окислительно-восстановительные реакции
- •10. Электрохимические процессы.
- •10.1. Активность и коррозия металлов
- •10.2. Гальванические элементы
- •10.3. Электролиз
- •11. Основы аналитической химии
- •11.1. Качественный химический анализ
- •11.2. Количественный химический анализ
- •11.3. Физико-химические и физические методы анализа. Методы разделения
- •12. Основы органической химии
- •12.1. Органические соединения и реакции
- •12.2. Высокомолекулярные соединения. Методы получения, строение
- •12.3. Биополимеры
- •12.4. Белки. Нуклеиновые кислоты.
- •12.5. Углеводы, или сахара. Липиды, или жиры.
- •2. Растворимость кислот, оснований и солей в воде
- •3. Относительные электроотрицательности атомов
- •4. Стандартные электродные потенциалы
- •Типовые аттестационные задания по химии
4. Основы термодинамики
4.1. Термохимические понятия и расчёты
Энтальпия системы, в которой протекает экзотермическая реакция, в начальном состоянии … .
1) больше, чем в конечном
2) меньше, чем в конечном
3) одинакова с конечной
В случае эндотермической реакции энтальпия системы в начальном состоянии … .
1) больше, чем в конечном
2) такая же, как в конечном
3) меньше, чем в конечном
Реакция экзотермическая, если … .
1) ΔS > 0 2) ΔН < 0 3) ΔН > 0 4) ΔS < 0
Экзотермическая реакция выражается термохимическим уравнением … .
1) А + В = С , ΔН > 0
2) А + В + Q = С
3) А + В = С , ΔН < 0
4) А + В = С – Q
Количество теплоты, поглощаемое при разложении 0,5 моль оксида углерода(IV) по термохимическому уравнению реакции
СО2 (г) = С (т) + О2 (г) – 393,50 кДж,
равно … кДж.
1) 98,35 2) 196,75 3) 786,80 4) 8,96
Стандартная теплота (энтальпия) образования сложного вещества равна … .
1) теплоте сгорания 1 моль этого вещества
2) теплоте, которая выделяется или поглощается при образовании любого количества этого вещества
3) теплоте разложения этого вещества на простые вещества при н. у.
теплоте, которая выделяется или поглощается при образовании 1 моль этого вещества из простых веществ при стандартных условиях
Стандартная энтальпия образования оксида серы(IV) равна тепловому эффекту реакции … .
1) Сu2S (к) + О2 (г) = 2Сu (к) + SО2 (г)
2) S (к) + 2О (г) = SО2 (г)
3) Н2SО3 (ж) = Н2О (ж) + SО2 (г)
4) S (к) + О2 (г) = SО2 (г)
Понятие "теплота образования сложного вещества" относится к … вещества .
1) 1 г 2) любому количеству
3) 1 моль 4) 100 г
При стандартных условиях теплота образования … равна нулю.
1) О3 (г) 2) SО2 (г) 3) О2 (г) 4) СаО (т)
Тепловой эффект реакции
Аl2О3 (т) + 3SО3 (г) = Аl2(SО4)3 (т)
рассчитывают по уравнению … .
1) ![]()
2) ![]()
3) ![]()
4) ![]()
Тепловой эффект реакции
4NН3 (г) + 3О2 (г) = 2N2 (г) + 6Н2О (ж)
(ΔН0298, кДж/моль: –46,2 0 0 –285,8)
равен … кДж.
1) –1530,0 2) –239,8 3) –1669,8 4) 1900,8
В соответствии с термохимическим уравнением реакции
![]()
![]()
![]()
![]() =
–802 кДж
=
–802 кДж
для получения 502 кДж теплоты необходимо сжечь … литров метана (н. у.).
1) 14 2) 49 3) 28 4) 56
В соответствии с термохимическим уравнением реакции
FеО
(т) + Н2
(г)
![]() Fе (т)
+ Н2О
(г),
Fе (т)
+ Н2О
(г),
![]() = 23 кДж
= 23 кДж
для получения 560 г железа необходимо затратить … кДж теплоты.
1) 23 2) 560 3) 230 4) 115
Энтальпия образования
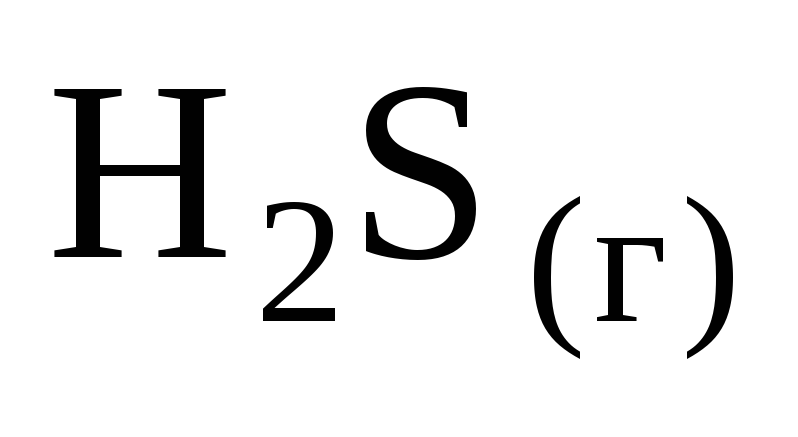 равна 21 кДж/моль, следовательно, при
взаимодействии 16 г серы и 11,2 л водорода
(н. у.) выделяется … кДж теплоты.
равна 21 кДж/моль, следовательно, при
взаимодействии 16 г серы и 11,2 л водорода
(н. у.) выделяется … кДж теплоты.
1) 21 2) 42 3) 5,25 4) 10,5
Согласно термохимическому уравнению реакции
С2Н4
(г)
![]() 2С (т)
+ 2Н2 (г),
2С (т)
+ 2Н2 (г),
![]() = –52,3 кДж,
= –52,3 кДж,
стандартная энтальпия образования этилена равна … кДж/моль.
1) 52,3 2) –104,6 3) –52,3 4) 104,6
Согласно термохимическому уравнению реакции
![]()
![]()
![]()
![]() =
–571,6 кДж,
=
–571,6 кДж,
стандартная энтальпия образования воды равна … кДж/моль.
1) 571,6 2) 285,8 3) –571,6 4) –285,8
Количество теплоты, выделяющееся при образовании 3 моль меди по уравнению реакции
2Сu2О
(т) + Сu2S
(т)
![]() 6Сu (т)
+ SО2 (г)
+ 115,5 кДж,
6Сu (т)
+ SО2 (г)
+ 115,5 кДж,
равно … кДж.
1) 57,75 2) 346,5 3) 11,55 4) 19,25
Стандартная теплота образования газообразного озона равна тепловому эффекту реакции … .
1) ![]() 2)
2)![]()
3) ![]() 4)
4)![]()
Стандартная энтальпия образования
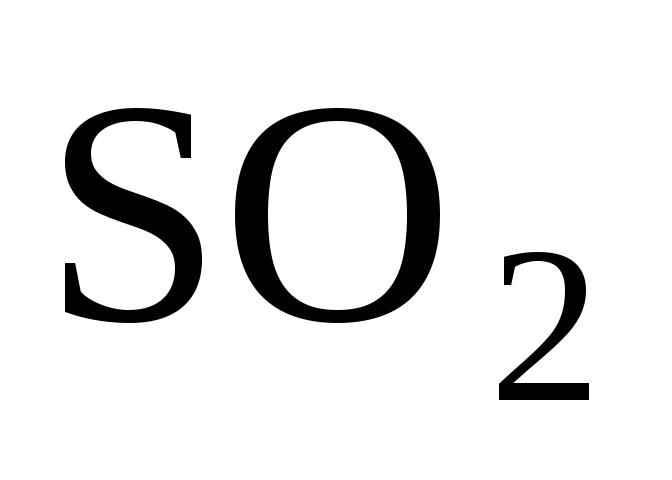 равна –297 кДж/моль, следовательно,
количество теплоты, выделяемое при
сгорании 16 г серы, равно … кДж.
равна –297 кДж/моль, следовательно,
количество теплоты, выделяемое при
сгорании 16 г серы, равно … кДж.
1) 74,25 2) 148,5 3) 297 4) 594
