
- •Типовые аттестационные задания по химии Учебно-методическое пособие
- •Дорогой студент !
- •1. Классификация и свойства неорганических соединений
- •2. Основные понятия и законы химии
- •3. Строение вещества
- •3.1. Строение атома
- •3.2. Периодический закон и периодическая система химических элементов д.И. Менделеева
- •3.3. Химическая связь
- •4. Основы термодинамики
- •4.1. Термохимические понятия и расчёты
- •4.2. Элементы химической термодинамики
- •5. Общие закономерности химических процессов
- •5.1. Химическая кинетика
- •5.2. Химическое равновесие
- •5.3. Поверхностные явления и адсорбция
- •6. Дисперсные системы
- •6.1. Грубодисперсные системы
- •6.2. Коллоидные системы
- •7. Растворы
- •7.1. Способы выражения состава растворов
- •7.2. Коллигативные свойства разбавленных растворов неэлектролитов
- •8. Растворы электролитов
- •8.1. Свойства растворов электролитов
- •8.2. Ионное произведение воды. Водородный показатель
- •8.3. Реакции ионного обмена
- •8.4. Гидролиз солей
- •9. Окислительно-восстановительные реакции
- •10. Электрохимические процессы.
- •10.1. Активность и коррозия металлов
- •10.2. Гальванические элементы
- •10.3. Электролиз
- •11. Основы аналитической химии
- •11.1. Качественный химический анализ
- •11.2. Количественный химический анализ
- •11.3. Физико-химические и физические методы анализа. Методы разделения
- •12. Основы органической химии
- •12.1. Органические соединения и реакции
- •12.2. Высокомолекулярные соединения. Методы получения, строение
- •12.3. Биополимеры
- •12.4. Белки. Нуклеиновые кислоты.
- •12.5. Углеводы, или сахара. Липиды, или жиры.
- •2. Растворимость кислот, оснований и солей в воде
- •3. Относительные электроотрицательности атомов
- •4. Стандартные электродные потенциалы
- •Типовые аттестационные задания по химии
3. Строение вещества
3.1. Строение атома
Главное квантовое число характеризует … .
1) общий запас энергии электрона в атоме
2) номер энергетического уровня атома
3) орбитальный момент импульса электрона
4) собственный момент импульса электрона
Орбитальное (азимутальное) квантовое число характеризует … .
1) момент импульса электрона при его движении вокруг атомного ядра
2) число атомных орбиталей на энергетическом подуровне
3) тип атомных орбиталей
4) размеры атомной орбитали
Магнитное квантовое число характеризует … .
1) проекцию орбитального момента количества движения электрона на направление внешнего поля
2) проекцию орбитального момента импульса электрона на направление электрического или магнитного поля
3) "движение электрона вокруг своей оси"
4) энергетический подуровень
Спиновое квантовое число характеризует … .
1) спин электрона
2) число подуровней на данном энергетическом уровне атома
3) внутреннее (орбитальное) движение электрона
4) орбитальный момент количества движения электрона
Форму атомной орбитали характеризует квантовое число … .
1) l 2) ml 3) ms 4) n
Размеры атомной орбитали характеризует квантовое число … .
1) l 2) ml 3) ms 4) n
Ориентацию атомной орбитали относительно направления электрического или магнитного поля характеризует квантовое число … .
1) l 2) ml 3) ms 4) n
Собственный момент количества движения электрона характеризует квантовое число … .
1) l 2) ml 3) ms 4) n
Максимальное количество электронов на третьем энергетическом уровне равно … .
1) 2 2) 8 3) 18 4) 32
Количество подуровней на третьем энергетическом уровне равно … .
1) 1 2) 2 3) 3 4) 4
Количество орбиталей на третьем энергетическом уровне равно … .
1) 1 2) 4 3) 9 4) 16
Электронная конфигурация нейтральных атомов с зарядом ядра +23 в основном состоянии выражается формулой … .
1) 1s22s22р63s23р63d24s3 2) 1s22s22р63s23р63d44s1
3) 1s22s22р63s23р63d54s0 4) 1s22s22р63s23р63d34s2
Атомный номер элемента, валентные электроны атомов которого в основном состоянии описываются формулой 3s23р4, равен … .
1) 8 2) 10 3) 11 4) 16
Количество электронов в нейтральном атоме азота, у которых
ml = 0, равно … .
1) 3 2) 6 3) 5 4) 7
Количество электронов в нейтральном атоме фосфора, у которых ml = +1, равно … .
1) 3 2) 6 3) 9 4) 15
Количество электронов в нейтральном атоме марганца, у которых ml = –2, равно … .
1) 1 2) 5 3) 13 4) 25
Атом иода в основном состоянии описывается сокращённой электронной формулой … .
1) [Kr]5s25p55d5 2) [Kr]5s25р5
3) [Kr]5s25р4 4) [Kr] 5s24d105р5
В атомах олова в основном состоянии валентные электроны описываются формулой… .
1) 5s25р2 2) 5d25р2 3) 5s24d105р3 4) 5s25d105р2
Распределение электронов по энергетическим уровням в невозбуждённом атоме магния описывается набором цифр … .
1) 4, 6, 2 2) 2, 6, 4 3) 2, 8, 2 4) 2, 8, 4
Невозможной для атомов является электронная конфигурация … .
1) 2р1 2) 3s2 3) 2d4 4) 4f 3
Количество электронов на внешнем энергетическом уровне нейтрального атома хлора в нормальном состоянии равно … .
1) 5 2) 6 3) 7 4) 8
Количество электронов на р-подуровне внешнего энергетического уровня нейтрального атома брома в основном состоянии равно … .
1) 4 2) 5 3) 6 4) 7
Заряд ядра нейтральных атомов, описываемых сокращённой электронной формулой [Ar] 4s13d5, равен … .
1) +20 2) +24 3) +30 4) +34
Количество заполненных энергетических подуровней в нейтральном невозбуждённом атоме германия равно … .
1) 5 2) 6 3) 7 4) 8
Количество заполненных энергетических уровней в нейтральном атоме кальция в основном состоянии равно … .
1) 4 2) 3 3) 2 4) 1
Химический элемент, в нейтральных атомах которого на энергетическом М - уровне содержится 9 электронов, – это … .
1) калий 2) скандий 3) кальций 4) медь
Элемент четвёртого периода Периодической системы химических элементов Д.И.Менделеева, нейтральные атомы которого имеют на d-подуровне по 3 электрона, – это … .
1) Мn 2) V 3) Sс 4) Сr
Количество электронов на s-орбиталях нейтрального атома магния в основном состоянии равно … .
1) 2 2) 6 3) 8 4) 12
Максимальное количество неспаренных электронов на любом
р-подуровне атомов химических элементов равно … .
1) 3 2) 4 3) 5 4) 6
Количество неспаренных электронов в нейтральном атоме кобальта в нормальном состоянии равно … .
1) 2 2) 3 3) 4 4) 5
Порядок размещения электронов в невозбуждённых атомах кислорода изображаются схемами …
1)
↑↓
↑↓
↑↓
↑↓
1s
2s
2р
2)
↑↓
↑
↑↓
↑↓
↑
1s
2s
2р
3)
↑↓
↑↓
↑↓
↑
↑
1s
2s
2р
4)
↑↓
↑↓
↑↓
↓
↓
1s
2s
2р
р-Элемент, нейтральные атомы которого в основном состоянии содержат наибольшее число вакантных орбиталей, – это … .
1) Аl 2) Si 3) Р 4) S
Возбуждённое состояние атомов магния описывается сокращённой электронной формулой … .
1) [Nе] 3s2 2) [Nе] 3s13р2 3) [Nе] 3s13р1 4) [Nе] 3s23р1
Суммарный спин электронов нейтрального невозбуждённого атома марганца равен … .
1) ![]() 2)
1
2)
1![]() 3)2
3)2![]() 4) 3
4) 3![]()
Схема расположения электронов в нейтральных атомах серы в основном состоянии имеет вид … .
1)
↑↓
↑↓
↑↓
↑↓
↑↓
↑↓
↑↓
↑
↑
1s
2s
2р
3s
3р
3d
2)
↑↓
↑↓
↑↓
↑↓
↑↓
↑
↑
↑
↑
↑
↑
1s
2s
2р
3s
3р
3d
3)
↑↓
↑↓
↑↓
↑↓
↑↓
↑↓
↑↓
↓
↑
1s
2s
2р
3s
3р
3d
4)
↑↓
↑↓
↑↓
↑↓
↑↓
↑↓
↑↓
↑↓
1s
2s
2р
3s
3р
3d
Суммарный спин электронов нейтрального невозбуждённого атома германия равен … .
1) ![]() 2)1 3) 1
2)1 3) 1![]() 4) 2
4) 2
Количество заполненных энергетических подуровней во фторид-анионе равно … .
1) 1 2) 2 3) 3 4) 4
Анионы брома в основном состоянии описываются электронной формулой … .
1) 1s22s22р63s23р63d104s24р6 2) 1s22s22р63s23р63d104s24р4
3) 1s22s22р63s23р63d104s24р5 4) 1s22s22р63s23р63d104s1
Катионы цинка в нормальном состоянии описываются электронной формулой … .
1) 1s22s22р63s23р63d10 2) 1s22s22р63s23р63d84s2
3) 1s22s22р63s23р63d104s24р2 4) 1s22s22р63s23р63d104s2
Наибольшее количество электронов имеет … .
1) нейтральный атом натрия
2) положительно заряженный атом алюминия
3) отрицательно заряженный атом фтора
4) нейтральный атом магния
Электронную оболочку невозбуждённых нейтральных атомов одного из благородных газов имеют ионы … .
1) Са2+ 2) Сr3+ 3) Sn2+ 4) Мn2+
Частицами, имеющими такую же электронную конфигурацию, как и невозбуждённые атомы аргона, являются … .
1) ионы кальция 2) электронейтральные атомы
калия
3) нейтральные атомы хлора 4) ионы натрия
Количество электронов в анионе серы равно … .
1) 14 2) 16 3) 18 4) 21
Согласно правилу Клечковского, … .
1) в атоме не может быть двух электронов с одинаковым набором квантовых чисел
2) 3d-подуровень заполняется электронами после 4s-подуровня
3) на 2р-подуровне не может быть больше шести электронов
4) суммарный спин электронов энергетического подуровня максимален
Количество нейтронов в атомах изотопов
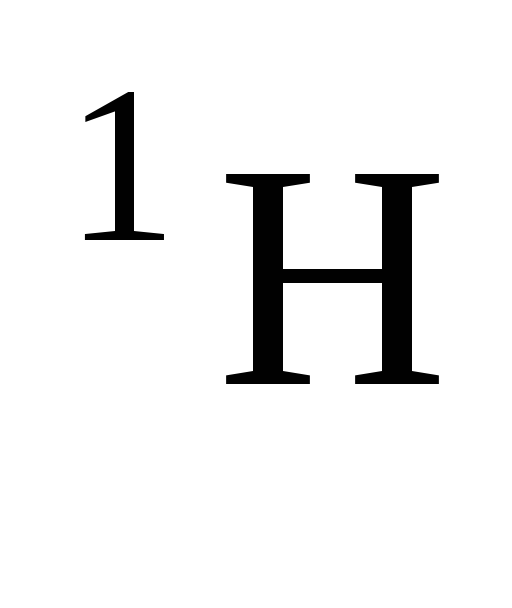 ,D
и T
соответственно равно … .
,D
и T
соответственно равно … .
1) 1,2,3 2) 2,3,4 3) 0,1,2 4) 1,1,1
Количество нейтронов в атомах нуклида
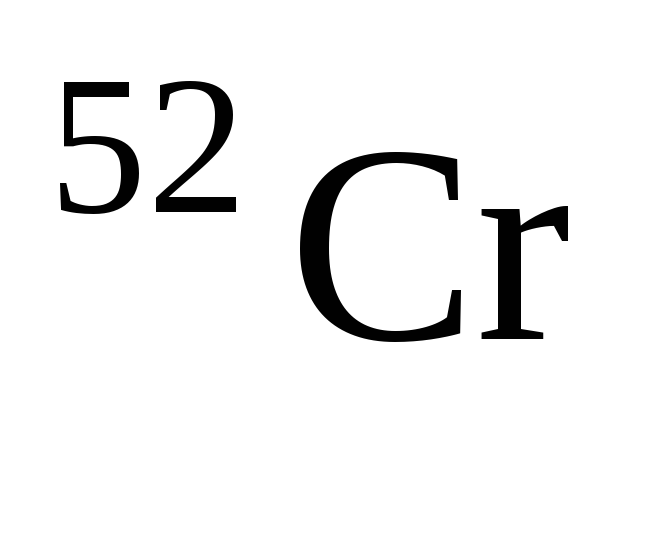 равно … .
равно … .
1) 52 2) 24 3) 28 4) 76
Количество нуклонов а атомах нуклида
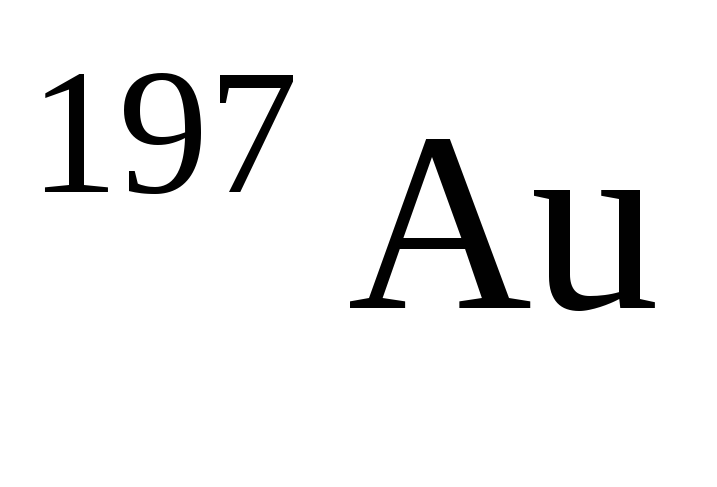 равно … .
равно … .
1) 79 2) 118 3) 197 4) 276
Количество протонов в атомах нуклида марганца-55 равно … .
1) 20 2) 25 3) 80 4) 55
На энергетическом подуровне атома, характеризующимся орбитальным квантовым числом 2, максимально может находиться … электронов.
1) 2 2) 8 3) 10 4) 14
Промежуток времени, в течение которого происходит распад половины радиоактивных атомов химического элемента, называется … .
1) временем распада
2) характеристическим временем
3) периодом разложения
4) временем полураспада
