
- •ЭЛЕКТРОННАЯ ОБОЛОЧКА АТОМА. Этапы изучения строения атома:
- •Противоречия модели Резерфорда:
- •Связь между частотой и энергией:
- •Квантово-механическая модель атома
- •Постулат Планка
- •Предположение де Бройля: электроны (как и все частицы) при движении проявляют свойства волны.
- •Принцип неопределенности:
- •Волновое уравнение Шредингира
- •Места пространства,
- •Квантовые числа
- •m - магнитное квантовое число – характеризует ориентацию орбитали в пространстве.
- •Четвертое квантовое число - спиновое, обозначается s, характеризует не орбиталь: а сам электрон.
- •Строение многоэлектронных атомов
- •Электроны, находящиеся на одной орбитали имеющие одинаковые значения квантовых чисел , кроме спинового
- •Максимальное число электронов (энергетическая емкость):
- •Принцип наименьшего запаса энергии (минимума энергии):
- •Правило Хунда (Гунда): в данном подуровне электроны стремятся занять энергетические состояния таким образом,
- •Электроны верхнего заполняемого слоя - валентными электронами.
- •Возможные значения квантовых чисел для различных значений главного квантового числа
- •Подуровни р, d, f обладают повышенной устойчивостью, когда они не заполнены, заполнены наполовину
- •Энергетические характеристики атомов

m - магнитное квантовое число – характеризует ориентацию орбитали в пространстве.
Принимает целые значения от -l через 0 до +l. Всего 2l +1 значение.
Физический смысл m: В спектрах атомов, помещенных во внешнее магнитное поле, обнаруживается дополнительное расщепление специальных линий, что говорит о различной взаимной ориентации электронных облаков.
S-подуровни в несильном постоянном магнитном поле не расщепляются.
Р- подуровни расщепляются в магнитном поле на три близкие линии ( три различных типа ориентации р - облаков в пространстве (оси х, у, z).
Четвертое квантовое число - спиновое, обозначается s, характеризует не орбиталь: а сам электрон.
Оно моделируется моментом количества движения электрона, как если бы электрон - волчок, который вращается всегда с одной скоростью, но только либо влево, либо вправо. s = +1/2, -1/2.
Электроны с разными спинами обычно обозначаются .
Строение многоэлектронных атомов
Принцип Паули: в атоме не может быть двух электронов, у которых были бы одинаковыми все четыре квантовых числа.
На одной орбитали, характеризующейся определёнными значениями квантовых чисел n, l и m может находиться либо один электрон, либо два, различающихся
значением s.
Принцип Паули запрещает нахождение на той же орбитали третьего электрона, так как это означало бы, что у двух из них все четыре квантовых числа одинаковы.
Электроны, находящиеся на одной орбитали имеющие одинаковые значения квантовых чисел , кроме спинового квантового числа, называются спаренными. Единичные электроны называются
неспаренными.
Вещества с неспаренными электронами парамагнитны, т.е. они проводят магнитные силовые линии лучше, чем вакуум, и магнитное поле втягивает эти вещества, из-за взаимодействия спинов электронов как элементарных магнитов с внешним магнитным полем.
Вещества, у которых все электроны спаренные- диамагнитны, т.е. они проводят магнитные силовые линии хуже, чем вакуум и магнитное поле выталкивает их.
Максимальное число электронов (энергетическая емкость):
на энергетическом уровне N = 2n2. и на подуровне: N = 2(21 +1).
Например, на третьем уровне максимально может быть: N=2*32 =18 электронов.
На d – подуровне (1=2) находятся
N = 2(2*2 +1) = 10 электронов.
Т.к. 2 электрона находятся на одной орбитали, то следовательно на d – подуровне имеется 10/2 = 5 орбиталей.
Принцип наименьшего запаса энергии (минимума энергии):
Наиболее устойчивому состоянию электрона в атоме отвечает минимальная из возможных его энергий.
Правило Клечковского: заполнение орбиталей происходит в порядке возрастания суммы чисел n + l, а при равных значениях этой суммы - в порядке возрастания n.
Например, электрон должен сперва вступать на 4s, а не на 3d подуровень, т.к. энергия 4s подуровня меньше, чем 3d.
для 4s подуровня n+1=4+0=4, а для 3d n+1 = 3+2=5.
На подуровнях 3d, 4р и 5s суммы значений n и 1 равны пяти (3d: 3+2=5; 4р: 4+1=5; 5s: 5+0=5). Поэтому последовательность заполнения 3d – 4р – 5s.
Порядок заполнения подуровней: 1s<2s<2p<3s<3p<4s 3d<4p<5s 4d<5p<6s 5d 4f<6p

Правило Хунда (Гунда): в данном подуровне электроны стремятся занять энергетические состояния таким образом, чтобы суммарный спин был максимальный.
Например, у азота в основном состоянии заполняются 2р орбитали 3 электронами.
Орбитали можно заполнить : |
|
|
|
||
|
|
или |
|
|
|
Σ ms = ½*1 |
< |
Σ ms = 3 * 1/2 =1½. |
неверно |
|
верно |
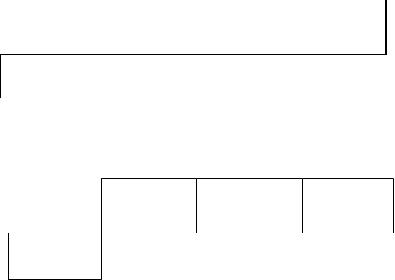
Электроны верхнего заполняемого слоя - валентными электронами.
Например, электронная конфигурация валентного уровня
кремния в основном состоянии: 3s2 3p2. 3px |
3py |
3pz |
|
Суммарный спин |
|
|
|
атома кремния ms = 1 |
|
3p2 |
|
В возбуждённом |
3s2 |
3py |
3pz |
состоянии происходит |
3px |
||
|
|
|
|
распаривание связки 3s2 |
|
|
|
и электронная конфигурация |
|
3p2 |
|
становится 3s13p3. |
3s2 |
|
|
Суммарный спин становится равным 2.
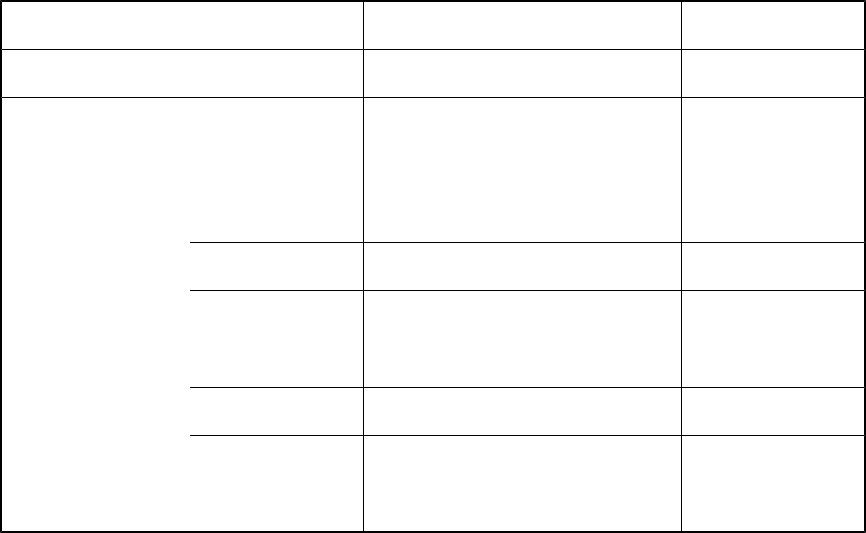
Возможные значения квантовых чисел для различных значений главного квантового числа
Значение n 1 (K)
2 (L)
3 (M)
4 (N)
Значения l |
Значения m |
е mах = 2n2 |
0 (s) |
0 |
2 |
0(s) |
0 |
2 |
1 (p) |
-1, 0, +1 |
6 |
0 (s) |
0 |
2 |
1 (p) |
-1, 0, +1 |
6 |
2 (d) |
-2, -1, 0, +1, +2 |
10 |
0 (s) |
0 |
2 |
1 (p) |
-1, 0, +1 |
6 |
2 (d) |
-2, -1, 0, +1, +2 |
10 |
3 (f) |
-3, -2, -1, 0, +1, +2, +3 |
14 |
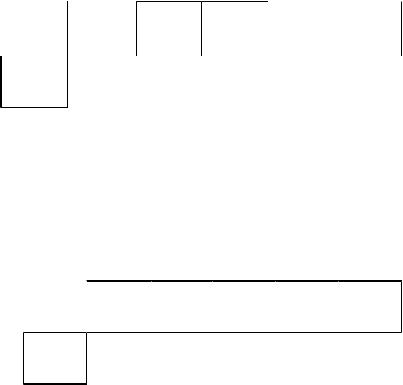
Подуровни р, d, f обладают повышенной устойчивостью, когда они не заполнены, заполнены наполовину (неспаренными электронами) и заполнены полностью.
Для хрома электронная конфигурация внешнего уровня
должна быть 4s23d4. 4s |
|
|
|
|
|
|
|
3d |
|
Но более устойчиво состояние когда подуровень заполнен наполовину, поэтому происходит проскок электрона с 4s подуровня на 3d подуровень, и конфигурация на самом деле выглядит 4s13d5:
4s 



 3d
3d
