
- •Учебное пособие
- •Введение
- •Приближённое определение погрешностей функции z одного переменного
- •Приближённое определение погрешностей функции нескольких переменных
- •Глава I механические свойства
- •1.1 Проверка законов движения на машине атвуда Цель работы: изучение законов Ньютона, проверка законов равноускоренного движения.
- •I. Теоретическое введение
- •II. Приборы и принадлежности Машина Атвуда, секундомер, грузы с перегрузками.
- •III. Описание экспериментальной установки и метода измерения
- •IV. Выполнение работы
- •Часть 1. Проверка законов путей (независимости ускорения от пройденного пути)
- •Часть 2. Проверка зависимости ускорения от движущей силы
- •Часть 3. Проверка зависимости ускорения от массы
- •V. Содержание отчета
- •VI. Контрольные вопросы
- •1.2 Изучение собственных колебаний пружинного маятника
- •I. Теоретическое введение
- •II. Приборы и принадлежности
- •III. Описание экспериментальной установки и метода измерения
- •IV. Выполнение работы
- •Часть 1. Определение жесткости пружины статическим способом
- •Часть 2. Определение жесткости пружины динамическим способом
- •V. Содержание отчета
- •II. Приборы и принадлежности
- •III. Описание экспериментальной установки и метода измерения
- •IV. Выполнение работы
- •Часть 1. Определение момента инерции маховика без грузов.
- •Часть 2. Определение момента инерции маховика с грузами.
- •V. Содержание отчета
- •VI. Контрольные вопросы
- •1.4 Определение момента инерции стержня
- •I. Теоретическое введение
- •II Приборы и принадлежности
- •III. Описание экспериментальной установки и метода измерения
- •IV. Выполнение работы
- •V. Содержание отчета
- •VI. Контрольные вопросы
- •1.5 Определение скорости полета пули баллистическим маятником
- •I. Теоретическое введение
- •II. Приборы и принадлежности
- •III. Описание экспериментальной установки и метода измерения
- •IV. Выполнение работы
- •V. Содержание отчета
- •VI. Контрольные вопросы
- •1.6 Определение момента инерции махового колеса и силы трения в опорах
- •I. Теоретическое введение
- •II. Приборы и принадлежности
- •III. Описание экспериментальной установки и метода измерения
- •IV. Выполнение работы
- •V. Содержание отчета
- •VI. Контрольные вопросы
- •1.7 Определение коэффициента вязкости жидкости
- •I. Теоретическое введение
- •II. Приборы и принадлежности
- •III. Описание экспериментальной установки и метода измерения
- •IV. Выполнение работы
- •V. Содержание отчета
- •VI. Контрольные вопросы
- •1.8 Определение плотности воздуха при нормальных условиях и его молекулярной массы
- •I. Теоретическое введение
- •II. Приборы и принадлежности
- •III. Описание экспериментальной установки и метода измерения
- •IV. Выполнение работы
- •V. Содержание отчета
- •VI. Контрольные вопросы
- •1.9 Определение отношения теплоемкостей газа методом адиабатического расширения.
- •I. Теоретическое введение
- •II. Приборы и принадлежности
- •III. Описание экспериментальной установки и метода измерения
- •IV. Выполнение работы
- •V. Содержание отчета
- •VI. Контрольные вопросы
- •1.10 Экспериментальная проверка закона гука и определение модуля юнга по растяжению проволоки
- •I. Теоретическое введение
- •II. Приборы и принадлежности
- •III. Описание экспериментальной установки и метода измерения
- •IV. Выполнение работы
- •V. Содержание отчета
- •VI. Контрольные вопросы
- •1.11 Изучение явлений переноса в воздухе при комнатной температуре
- •I. Теоретическое введение
- •II. Приборы и принадлежности
- •III. Описание экспериментальной установки и метода измерения
- •IV. Выполнение работы
- •V. Содержание отчета
- •VI. Контрольные вопросы
1.9 Определение отношения теплоемкостей газа методом адиабатического расширения.
Цель
работы:
экспериментально определить показатель
адиабаты
 .
.
I. Теоретическое введение
Теплоемкостью(истинной)Cтела
называется отношение элементарного
количества тепла , сообщенного
телу в каком-либо процессе, к соответствующему
изменению температуры тела
, сообщенного
телу в каком-либо процессе, к соответствующему
изменению температуры тела .
.
 (1)
(1)

Удельной теплоемкостью с называется теплоемкость единицы массы однородного вещества:
 (2)
(2)

где m — масса тела.
Молярной
(мольной) теплоемкостью называется
теплоемкость одного моля вещества:

 ,
(3)
,
(3)

где
 -
молярная масса вещества,
-
молярная масса вещества, -удельная
теплоемкость
-удельная
теплоемкость
Выражение (1) справедливо для любого тела или системы, не зависимо от агрегатного состояния. В случае газов нагревание может происходить при постоянном объеме или при постоянном давлении
 (4)
(4)

 (5)
(5)
Если ν = 1 моль, то (4) И (5) определяют молярные теплоемкости.
Подставим в (4) первое начало термодинамики, учитывая, что V= const, тогда А=0:
 (6)
(6)
Для изобарического процесса будем иметь
 (7)
(7)
Подставим (7) в (5), получим
 (8)
(8)
или
 (9)
(9)
Запишем уравнение Менделеева-Клапейрона для одного моля
 (10)
(10)
Продифференцируем его при условии, что Р= const:
 (11)
(11)
Откуда
 (12)
(12)
Подставим (12) в (9)
 (13)
(13)
или

Для
реальных газов
 чем выше
давление газа, тем больше будет разность
теплоемкостей отличатся отR.
чем выше
давление газа, тем больше будет разность
теплоемкостей отличатся отR.
Согласно распределению Максвелла-Больцмана для одного моля идеального газа имеем:
 (14)
(14)
Откуда с учетом (6) получим
 (15)
(15)
где i – число степеней свободы
Разделив (15) на (13) получаем теоретическое значение отношения теплоёмкости
 (16)
(16)
что
для двухатомных молекул (i
= 5) дает
 ;
;
для
одноатомных молекул (i
= 3)
 ;
;
для
молекул, состоящих из трех и более атомов
(i
= 6)
 .
.
II. Приборы и принадлежности
1.Закрытый стеклянный баллон с кранами.
2. Манометр
3. Ручной насос.
III. Описание экспериментальной установки и метода измерения
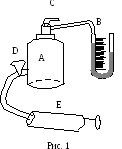
Экспериментальная
установка состоит из стеклянного баллона
А, соединенного с манометром В и с насосом
Е. Посредством крана С, баллон А соединяется
с атмосферой (рис. 1). Если при помощи
насоса накачать в баллон некоторое
количество воздуха то давление и
температура внутри баллона повысятся.
Вследствие теплообмена воздуха с
окружающей средой через некоторое время
температура воздуха, находящегося в
баллоне сравняется с температурой
внешней среды. Давление, установившееся
в баллоне
 ,
,
где
 — атмосферное
давление,
— атмосферное
давление,
 —добавочное
давление по манометру, измеряемое
разностью уровней жидкости в его коленах.
—добавочное
давление по манометру, измеряемое
разностью уровней жидкости в его коленах.
Если
открыть на короткое время кран
С, то воздух
в баллоне будет расширяться. Если процесс
происходит быстро, то его можно считать
адиабатическим. Давление в сосуде
установится равным атмосферному
 , а температура
газа понизится до
, а температура
газа понизится до , а объём будет
равен
, а объём будет
равен . В конце
адиабатического процесса, в состоянии
2, параметры будут
. В конце
адиабатического процесса, в состоянии
2, параметры будут .
.
Применяя
к 1 и 2 состояниям уравнение Пуассона,
получим:

Или
 (17)
(17)
охладившийся
при расширении воздух в баллоне через
некоторое время вследствие теплообмена
нагревается до температуры внешней
среды
 ; давление
возрастает до некоторой величины
; давление
возрастает до некоторой величины , где
, где — новая
разность уровней в манометре; объем
воздуха не изменится и будет равен
— новая
разность уровней в манометре; объем
воздуха не изменится и будет равен , то есть это
состояние воздуха, которое назовем 3
состоянием, характеризуется параметрами
, то есть это
состояние воздуха, которое назовем 3
состоянием, характеризуется параметрами . Так как в 1 и
3 состояниях воздух имеет одну и ту же
температуру (процесс изотермический),
то применяем закон Бойля-Мариотта.
. Так как в 1 и
3 состояниях воздух имеет одну и ту же
температуру (процесс изотермический),
то применяем закон Бойля-Мариотта.

 (18)
(18)
Возведем обе части уравнения (18) в степень γ, получим:
 (19)
(19)
Приравнивая, используя выражения (19) и (17), получим:
 отсюда
отсюда

Логарифмируя
последнее выражение и учитывая, что:
 , получим:
, получим:

тогда
 (20)
(20)
Таким
образом, экспериментальное определение
 сводится к
определению
сводится к
определению и
и .
.
