
|
Министерство науки и образования Рф ПСКОВСКИЙ ГОСУДАРСТВЕННЫЙ университет Кафедра техносферная безопасность |
|
Первичный токсиколого-гигиенический паспорт на Метанол |
|
|
|
Псков 2013 |
Выполнил студент: Медведев М.А группа:0033-04 ММФ Проверил: Пак Т.С
Метанол
Метано́л (метиловый спирт, древесный спирт, карбинол, метилгидрат, гидроксид метила) — CH3OH, простейший одноатомный спирт, бесцветная ядовитая жидкость. Метанол — это первый представитель гомологического ряда одноатомных спиртов.
С воздухом в объёмных концентрациях 6,72—36,5 % образует взрывоопасные смеси (температура вспышки 15,6 °C). Метанол смешивается в любых соотношениях с водой и большинством органических растворителей.
Получение
До 1960-х годов метанол синтезировали только на цинкхромовом катализаторе при температуре 300—400 °C и давлении 25—40 МПа (= 250—400 Бар = 254,9—407,9 кгс/см²). Впоследствии распространения получил синтез метанола на медьсодержащих катализаторах (медьцинкалюмохромовом, медь-цинкалюминиевом или др.) при 200—300 °C и давлении 4—15 МПа (= 40—150 Бар = 40,79—153 кгс/см²).
Современный промышленный метод получения — каталитический синтез из оксида углерода(II)(CO) иводорода(2H2) при следующих условиях:
температура — 250 °C,
давление — 7МПа (= 70 атм= 70 Бар = 71,38 кгс/см²),
катализатор— смесь ZnO (оксид цинка) и CuO (оксид меди(II)):
До промышленного освоения каталитического способа получения метанол получали при сухой перегонке дерева (отсюда его название «древесный спирт»). В данное время этот способ имеет второстепенное значение.
Также известны схемы использования с этой целью отходов нефтепереработки, коксующихся углей.
CO2 + 3H2 <--> CH3OH + H2O + 49.53 кДж/моль
H2O + CO <--> CO2 + H2 + 41.2 кДж/моль
Молекулярная
формула — CH4O
или CH3—OH,
а структурная: 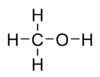 В
настоящее время метиловый спирт получают
синтетическим способом из монооксида
углерода и водорода при температуре
300—400 °C и давления 300—500 атм в
присутствии катализатора —
смесиоксидов
цинка, хрома и др. Сырьем для синтеза
метанола служитсинтез-газ(CO
+ H2),
обогащенный водородом: :CO+
2H2 →
CH3OH[1]
В
настоящее время метиловый спирт получают
синтетическим способом из монооксида
углерода и водорода при температуре
300—400 °C и давления 300—500 атм в
присутствии катализатора —
смесиоксидов
цинка, хрома и др. Сырьем для синтеза
метанола служитсинтез-газ(CO
+ H2),
обогащенный водородом: :CO+
2H2 →
CH3OH[1]
![]()
![]()
Крупнейшим производителем метанола в России является ОАО «Метафракс» в Губахе.
На конец 2013 года германский концерн "GELSENCHEM Chemical Products GmbH" предлагает метанол 98,5% по цене 520euro за 10 тонн и это цена с доставкой по Германии.
Применение
В органической химии метанол используется в качестве растворителя.
Метанол используется в газовой промышленности для борьбы с образованием гидратов (из-за низкой температуры замерзания и хорошей растворимости). В органическом синтезе метанол применяют для выпуска формальдегида, формалина, уксусной кислоты и ряда эфиров (например, МТБЭ и ДМЭ), изопрена и др.
Наибольшее его количество идёт на производство формальдегида, который используется для производства карбамидоформальдегидных и фенолформальдегидных смол. Значительные количества CH3OH используют в лакокрасочной промышленности для изготовления растворителей при производстве лаков. Кроме того, его применяют (ограниченно из-за гигроскопичности и отслаивания) как добавку к жидкому топливу для двигателей внутреннего сгорания. Используется в топливных элементах.
Благодаря высокому октановому числу, что позволяет увеличить степень сжатия до 16[источник не указан 380 дней] и большей на 20 % энергетической мощностью заряда на основе метанола и воздуха, метанол используется для заправки гоночных мотоциклов и автомобилей. Метанол горит в воздушной среде, и при его окислении образуется двуокись углерода и вода:
![]()
Для получения биодизеля растительное масло переэтерифицируется метанолом при температуре 60 °C и нормальном давлении приблизительно так: 1 т масла + 200 кг метанола + гидроксид калия или натрия.
Во многих странах метанол применяется в качестве денатурирующей добавки к этанолу при производстве парфюмерии. В России использование метанола в потребительских товарах запрещено.
При добыче газа гидраты могут образовываться в стволах скважин, промысловых коммуникациях и магистральных газопроводах. Отлагаясь на стенках труб, гидраты резко уменьшают их пропускную способность. Для борьбы с образованием гидратов на газовых промыслах вводят в скважины и трубопроводы различные ингибиторы (метиловый спирт, гликоли).
Работа топливных элементов основана на реакции окисления метанола на катализаторе в диоксид углерода. Вода выделяется на катоде. Протоны (H+) проходят через протонообменную мембрану к катоду где они реагируют с кислородом и образуют воду. Электроны проходят через внешнюю цепь от анода к катоду снабжая энергией внешнюю нагрузку.
Реакции:
На аноде CH3OH + H2O → CO2 + 6H+ + 6e−
На катоде 1.5O2 + 6H+ + 6e− → 3H2O
Общая для топливного элемента: CH3OH + 1,5O2 → CO2 + 2H2O
Получение муравьиной кислоты окислением метанола:

Получение диметилового эфира дегидратацией метанола при 300—400 °C и 2-3 МПа в присутствии гетерогенных катализаторов — алюмосиликатов — степень превращения метанола в диметиловый эфир — 60 % или цеолитов — селективность процесса близка к 100 %. Диметиловый эфир (C2H6O) — экологически чистое топливо без содержания серы, содержаниеоксидов азота в выхлопных газах на 90 % меньше, чем у бензина. Цетановое число диметилового дизеля более 55, при том что у классического нефтяного 38-53.
Метил-трет-бутиловый
эфир получается
при взаимодействии метанола с изобутиленом в
присутствии кислых катализаторов
(например, ионообменных
смол). 
Метил-трет-бутиловый эфир (C5H12O) применяется в качестве добавки к моторным топливам, повышающей октановое число бензинов (антидетонатор). Максимальное законодательное содержание МТБЭ в бензинах Европейского союза — 15 %, в Польше — 5 %. В России в среднем составе бензинов содержание МТБЭ составляет до 12 % для АИ92 и до 15 % для АИ95, АИ98.
