
- •химия
- •Вопрос 1-1
- •1-7 (агрегатные состояния)
- •1-10. Моль
- •Общие понятия и законы химии
- •2-1. Строение атомов
- •2-4. Изотопы
- •Химия 3
- •3-1. Периодическая система
- •3-3. Строение атома и свойства элемента
- •3-4. Строение атома и свойства элемента
- •3-5. Валентность химических элементов
- •3-5. Валентные электроны
- •3-7. Степень окисления
- •4-1. Виды химических связей
- •4-2. Ковалентная связь
- •4-3. Координационные связи
- •4-4. Металлическая связь
- •Химия 5-9
- •Вопрос 5 (1)
- •5-2. Уравнения химических реакций
- •5-2.Типы химических реакций
- •5-3. Типы химических реакций
- •5-4. Типы химических реакций
- •6-1. Энергетические эффекты
- •6-5. Потенциальная и кинетическая Э
- •6-6. Экзергонические и эндергонические реакции
- •6-7. Энергетические состояния (понятия)
- •6-8. Связанная энергия
- •6-9. Энтропия
- •7-1. Условия протекания химических реакций
- •7-4. Скорость химических реакций
- •7-5. Скорость химических реакций
- •7-6. Скорость химических реакций
- •7-7. Скорость химических реакций
- •8-1. Обратимые и необратимые реакции
- •9-1. Классификация неорганических соединений
- •9-2. Оксиды
- •9-3. Основания
- •9-4. Кислоты
- •9-5. Соли
- •Химия 10-15
- •10-1. Свойства воды
- •10-2. Строение молекул воды
- •10-3. Вода в организме человека
- •10-4. Роль воды в организме человека
- •11-1. Понятие о дисперсных системах
- •11-2. Примеры дисперсных систем
- •11-3. Водно-дисперсные системы
- •11-5. Грубодисперсные системы (взвеси)
- •11-6. Коллоидные растворы
- •10-7. Истинные растворы
- •11-8. Способы выражения концентрации растворов
- •11-9. Молярная концентрация
- •11-10. Водно-дисперсные системы организма человека
- •12-1. Электролитическая диссоциация
- •12-2. диссоциация солей, кислот, оснований
- •12-3. степень диссоциации
- •13-1. Активная реакция среды
- •13-2. Активная реакция среды
- •13-3. Ионное произведение воды
- •13-4. Кон-ция ионов водорода и гидроксила в разных средах
- •13-6. Шкала водородного показателя
- •14-1. Буферные системы
- •14-2. Механизм действия БС
- •14-3. Поддержание постоянства рН
- •14-4. Спортивная тренировка и буферные системы
- •15-1. Осмос
- •15-2. Осмотическое давление
- •15-3. Осмотическое давление
- •15-4. Характеристика осмотического давления
- •15-5. Осмотическое давление в растворах электролитов
- •15-6. Осмотическое давление в растворах электролитов
- •15-7. Осмотические явления в организме человека
- •Органические соединения
- •16-1. Особые свойства атома углерода
- •16-2. Классификация
- •17-1. Классификация по наличию функциональных групп
- •17-2. Продолжение классификации
- •18. Углеводы
- •18-1. Определение понятия
- •18-2. Углеводы в природе и в организме человека
- •18-3. Классификация углеводов
- •18-4. Углеводы - моносахариды
- •18-5. Моносахариды - гексозы
- •18-6. Циклические формы моносахаридов
- •18-7. Гексозы в природе и в организме человека
- •18-7. Углеводы - пентозы
- •18-8. Свойства моносахаридов
- •19-1. Дисахариды
- •19-2. Состав дисахаридов
- •19-3. Образование дисахаридов
- •19-4. Свойства дисахаридов
- •20-1. Гомополисахариды
- •20-2. Строение амилозы и амилопектина
- •20-3. Гликоген
- •20-4. Клетчатка
- •20-5. Клетчатка как продукт питания
- •20-6. Роль клетчатки
- •20-7. Гетерополисахариды
- •20-8. Гетерополисахариды в организме
- •20-9. Потребность в углеводах
- •20-10. Углеводы в продуктах питания
- •20-11. Проблемы
- •21. Липиды
- •21-1. Определение понятия
- •21-2. Классификация липидов
- •21-3. Липиды в организме человека
- •21-4. Жиры
- •21-5. Жирные кислоты
- •21-6. Важнейшие жирные кислоты
- •21-7. Свойства жиров
- •21-8. Химические свойства жира
- •21-9. Химические свойства жира
- •21-11. Жиры как источник энергии
- •21-12. Потребность в жирах
- •21-13. Жиры как незаменимый компонент питания
- •21-14. Потребность в жидких жирах
- •22. Жироподобные вещества
- •22-1. Фосфолипиды
- •23. Стероиды
- •23-1. Роль холестерина
- •23-2. Проблемы, связанные с холестерином
- •23-3. Главные проблемы
- •23-4. Что способствует повышению холестерина в крови
- •23-5. Холестерин как компонент питания
- •23-6. Влияние наследственности
- •23-7. Профилактика
- •24. Белки (протеины)
- •24-1. Определение понятия
- •24-2. Общие сведения о белках
- •24-3. Содержание и роль белка в организме человека
- •25-1. Состав
- •25-2. Аминокислоты
- •25-3. Строение аминокислот
- •25-4. Примеры аминокислот
- •25-5. Свойства аминокислот
- •25-6. Реакции между аминокислотами
- •26-1. Структура белковых молекул
- •26-2. Вторичная структура
- •26-3. Третичная структура
- •26-4. Первичная структура
- •26-5. Четвертичная структура
- •26-7. Свойства белков
- •26-8. Химические свойства белков
- •27-1. Классификация белков
- •27-2. Пищевая ценность белков
- •27-3. Полноценность белков
- •27-4. Простые и сложные белки
- •27-5. Сложные белки
- •27-6. Липопротеиды
- •28-1. Хромопротеины
- •Потребность в белках
- •Потребность - 2
- •Потребность - 3
- •Потребность - 4
- •Потребность -5
- •Полноценность белкового питания
- •Проблемы белкового питания
- •Содержание белков в продуктах питания
- •29. Нуклеотиды
- •29-1. Состав
- •29-2. Азотистые основания
- •29-3. Строение азотистых оснований
- •29-4. Углеводы нуклеотидов
- •29-5. Строение нуклеотидов
- •29-6. Важнейшие нуклеотиды
- •29-7. Мононуклеотиды
- •29-8. Роль АТФ и АДФ
- •29-9. Ди- и полинуклеотиды
- •Роль динуклеотидов
- •30-1. Полинуклеотиды
- •30-2. Роль ДНК
- •30-3. Роль РНК в процессе синтеза белка
- •30-4. Роль РНК
- •30-5. Механизм транскрипции
- •30-6. Транспортная РНК
химия

Вопрос 1-1
•Химия изучает состав, строение, свойства и превращения веществ.
Предметы, живые организмы, среды (воздух, вода)
вещества
молекулы
атомы
1-2
•Молекула – наименьшая частичка вещества, сохраняющая его свойства.
•Молекулы состоят из атомов. Связь между атомами в молекуле более прочная, чем между молекулами.
•Атом – химически неделимая частица.
•Встречаются одинаковые и разные атомы.
•Атомы могут отличатся друг от друга массой, свойствами.
1-3
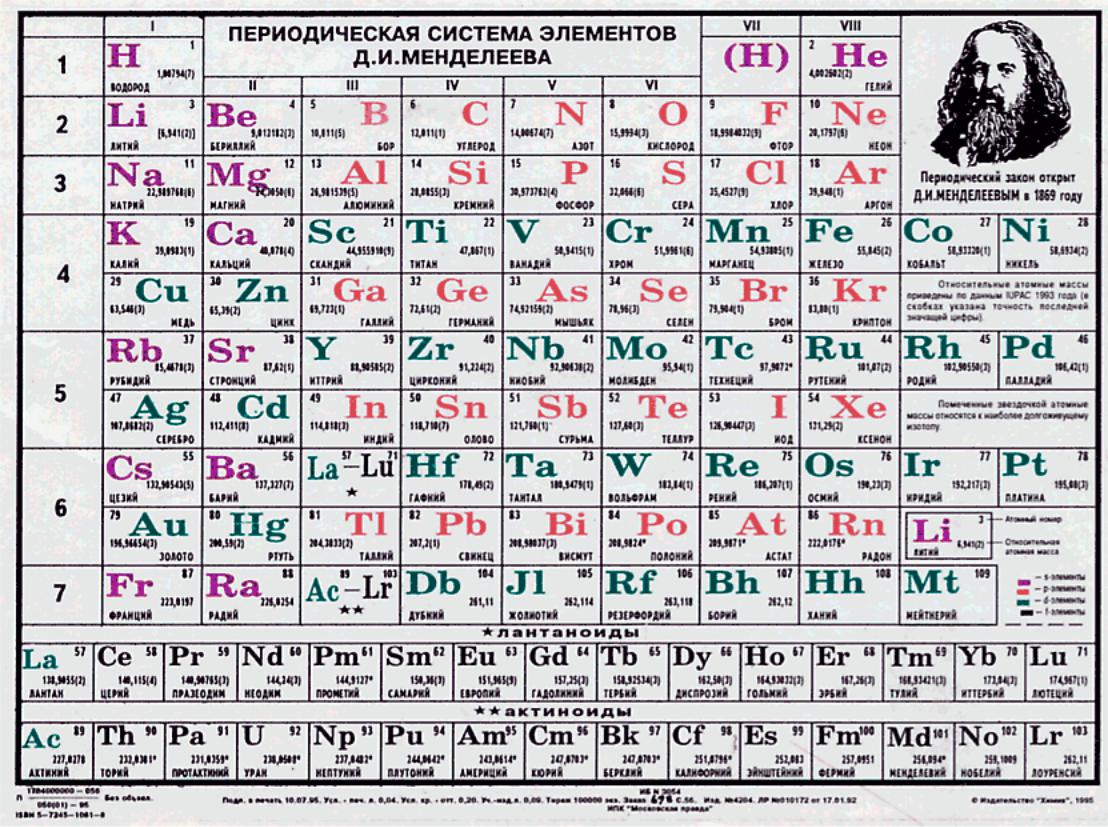
•Химический элемент – это атомы одного вида (имеющие одинаковые свойства).
•В природе встречается свыше 100 видов атомов (химических элементов). Все они представлены в таблице элементов Д.И. Менделеева.
•Химические элементы обозначают начальными буквами их латинских названий.
1-4
•Вещества бывают:
•- простые и сложные. Молекулы простых веществ состоят из атомов одного элемента, сложных - из атомов разных элементов.
•(есть вещества немолекулярного строения)
•- органические и неорганические
(минеральные). В состав молекул органических веществ входит элемент углерод (есть исключения).
•Органических веществ больше 3 млн, неорганических – около 300 тысяч.
1-5
•Все вещества имеют химические формулы.
•Химические формулы бывают общие и структурные. Общие формулы отражают качественный и количественный состав молекул веществ.
•Структурные отражают не только качественный и количественный состав, но и порядок соединения атомов в молекуле.
•Структурные формулы особенно важны для органических веществ.
1-6
•Некоторые химические элементы образуют несколько простых веществ (аллотропные видоизменения): кислород и озон (разное количество атомов в молекуле), углерод –
графит, алмаз и др.
•Углерод образует вещества немолекулярного строения. У них разные формы кристаллических решеток
