
- •Подписано в печать 22.07.2008. Формат 60х90 1/16.
- •I. Общие положения по выполнению контрольных работ
- •II. Оформление контрольных работ
- •III. Программа для подготовки к экзамену по химии
- •IV. Список рекомендуемой литературы
- •V. Основная часть
- •Контрольные задания
- •Строение атомов Введение
- •Периодическая система химических элементов д.И. Менделеева Введение
- •Контрольные задания
- •Химическая связь и строение молекул. Конденсированное состояние веществ Введение
- •Примеры решения задач
- •Контрольные задания
- •Энергетика химических процессов Введение
- •Примеры решения задач
- •Химическое сродство
- •Поскольку н0, s0 и g0 реакции связаны друг с другом уравнением:
- •Скорость химических реакций
- •Контрольные задания
- •Контрольные задания
- •Контрольные задания
- •Решение. В насыщенном растворе сульфата свинца существует гетерогенное равновесие:
- •Решение.
- •Решение.
- •Решение.
- •1 Моль 1 моль
- •Вычислим значение рН:
- •Контрольные задания
- •Окислительно – восстановительные реакции Введение
- •Основные типы окислительно-восстановительных реакций (овр)
- •Электродные процессы и гальванические элементы
- •Примеры решения задач
- •Коррозия металлов
- •Контрольные задания
- •Комплексные соединения
- •Контрольные задания
- •Химические свойства металлов
- •Контрольные задания
- •Полимеры Введение
- •Контрольные задания
- •Дисперсные системы
- •Контрольные задания
- •Количественный анализ Введение
- •VI. Приложение
- •Термодинамические константы веществ
- •Константы диссоциации некоторых слабых электролитов
- •Константы нестойкости ряда комплексных ионов
- •Стандартные электродные потенциалы е0 некоторых металлов (ряд напряжений)
- •Содержание
IV. Список рекомендуемой литературы
Основная учебная литература
1. Коровин Н.В. Учебник для технич. направл. и спец. вузов – 6-е изд., испр. – М.: Высш. шк., 2005. – 557 с.
2. Глинка Н.Л. Общая химия: Учебное пособие для вузов – изд. 30-е, испр./Под ред. А.И. Ермакова – М.: Интеграл – Пресс, 2004. – 728 с.
3. Зубрев Н.И. Инженерная химия на железнодорожном транспорте. – М.: УМК МПС РФ, 2002. – 292 с.
4. Глинка Н.Л. Задачи и упражнения по общей химии: Учебное пособие для вузов/ Под. ред. В.А. Рабиновича и Х.М. Рубиной – М.: Интеграл – Пресс, 2001. – 240 с.
5. Гольбрайх З.Е. Сборник задач и упражнений по химии: Учеб. пособие для студентов. – 6-е изд./ З.Е. Гольбрайх, Е.И. Маслов. – М.: ООО «Издательство АСТ»: ООО «Издательство Астрель», 2004. – 383 с.
Учебно-методическая литература
1. Васильченко Л.М., Сеницкая Г.Б., Халикова А.В. Химия. Лабораторные работы и методические указания к их выполнению для студентов всех специальностей – Самара: СамИИТ, 2001. – 36 с.
2. Васильченко Л.М., Халикова А.В., Сеницкая Г.Б. Методуказания для выполнения учебно-исследовательской работы по химии. – Самара: СамИИТ, 2002. – 16 с.
3. Васильченко Л.М., Сеницкая Г.Б., Халикова А.В., Яковлев В.М. Методические указания к выполнению лабораторных работ по количественному анализу химических соединений. – Самара: СамИИТ, 2002. – 32 с.
4. Васильченко Л.М., Яковлев В.М., Сеницкая Г.Б., Халикова А.В. Химия. – Часть III. Лабораторные работы для студентов всех специальностей. Методуказания – Самара: СамГАПС, 2003. – 24 с.
5. Васильченко Л.М., Халикова А.В., Сеницкая Г.Б. Защита от коррозии. Лабораторные работы для студентов всех специальностей дневной формы обучения – Самара: СамГАПС, 2004. – 26 с.
6. Васильченко Л.М., Халикова А.В., Сеницкая Г.Б., Сотова Н.В. Справочный материал по дисциплине «Химия» и «Коррозия металлов». – Самара: СамГАПС, 2006. – 46 с.
Дополнительная литература
1. Ахметов Н.С. Общая и неорганическая химия. Учебник для вузов.– 4-ое изд., испр. М.: Высш. шк., издат. центр «Академия», 2001. – 743 с.
2. Химия. Учебное пособие для общеобразоват. учреждений (Справочные материалы)/ Ю.Д. Третьяков, Н.Н. Олейников, Я.А. Кеслер и др.; Под. ред. Ю.Д. Третьякова. – М.: ООО «Изд-во Астрель»: ООО «Изд-во АСТ», 2002. – 333 с.
3. Горбунов А.И., Гуров А.А., Филиппов Г.Г., Шаповал В.Н. Теоретические основы общей химии: Учебник для студентов технических университетов и вузов. – М.: Изд-во МГТУ им. Н.Э. Баумана, 2003. – 720 с.
4. Гаркушин И.К., Лисов Н.И., Немков А.В. Общая химия для технических вузов: Учеб. пособие. – Самара: СамГТУ, 2003. – 404 с.
5. Бацанов С.С. Термохимические электроотрицательности металлов // Журн. физической химии. – 2000. – Т.74, № 2. – С.331-334.
V. Основная часть
Эквивалент. Закон эквивалентов
Примеры решения задач
Пример 1. Рассчитайте эквивалентную массу трёхвалентного металла (M), навеска которого массой 1,44 г при его полном окислении превращается в 2,72 г соответствующего оксида. Какой металл используется в качестве исходного реагента?
Решение. На основании закона эквивалентов составим пропорцию
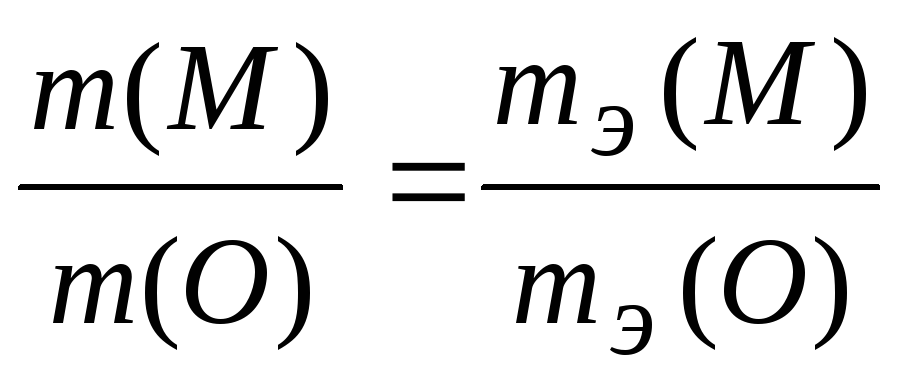 .
.
Здесь
m
– масса
реагента,
![]() - его эквивалентная масса.
- его эквивалентная масса.
Таким
образом,
![]()
Из условия задачи находим m(O)=m(окс.)-m(M)=2,72 – 1,44 =1,28 (г).
Учтя,
что
![]() (O)
= 8
(O)
= 8
![]() ,
получим
,
получим
![]() .
.
По определению грамм-атомная масса (A) простого вещества равна произведению его эквивалентной массы на валентность (υ)
![]() .
.
В итоге, сравнив найденный результат с значениями средних масс, указанными в таблице Менделеева, приходим к выводу, что в качестве металла был использован алюминий.
Пример 2. Сколько граммов цинка растворилось в соляной кислоте, если известно, что в ходе этой реакции выделилось 1,2 л водорода.
Решение. С учётом объёмных отношений газообразных реагентов, из закона эквивалентов следует, что
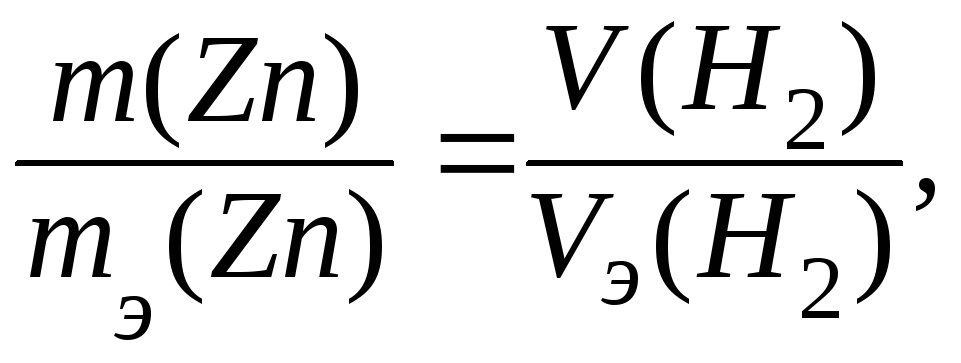
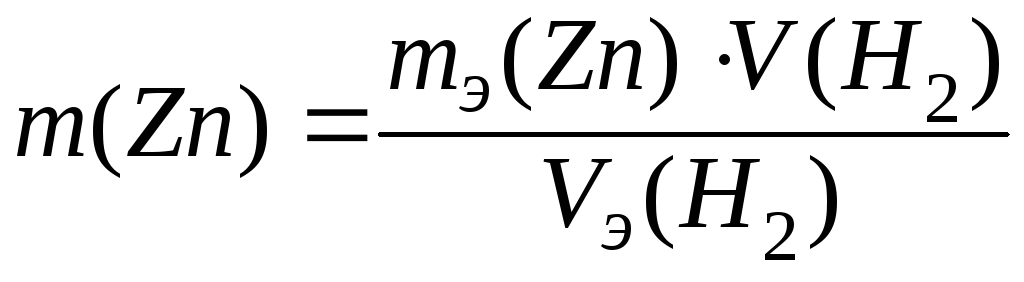 ,
,
где
m
- масса
металла,
![]() - его эквивалентная масса,V
– объём газообразного продукта реакции,
- его эквивалентная масса,V
– объём газообразного продукта реакции,
![]() - его грамм-эквивалентный объём.
- его грамм-эквивалентный объём.
Из данных таблицы Менделеева определим, что
![]()
Учтя,
что
![]() (
(![]() )=11,2
л, получим окончательно:
)=11,2
л, получим окончательно:
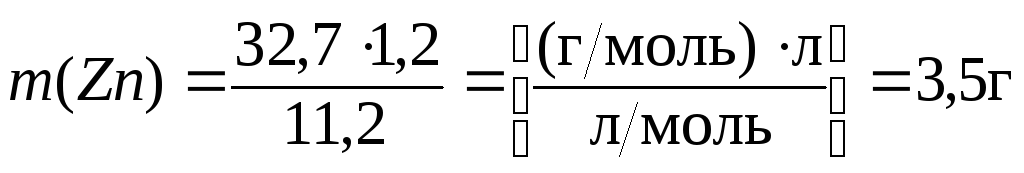
Пример 3. Определите мольную массу эквивалентов ортофосфорной кислоты в реакции её нейтрализации гидроксидом калия с образованием соответствующего моногидрофосфата.
Решение. Из уравнения указанной реакции
![]()
следует,
что число эквивалентности
![]()
Таким
образом,
![]() .
.
Пример 4. Рассчитайте мольную массу эквивалентов перманганат-анионов, восстанавливаемых в кислой среде водного раствора.
Решение. В кислой среде осуществляется следующая полуреакция восстановления:
MnO-4
![]()
Как
видно, Z
= 5,
![]() (г / моль).
(г / моль).
