
- •Департамент кадров и учебных заведений
- •Методические указания
- •Подписано в печать . Формат 60х90 1/16.
- •Определение эквивалента и эквивалентной массы металла по водороду
- •Определение тепловых эффектов химических реакций
- •Скорость химических реакций. Химическое равновесие
- •Растворы. Определение концентрации раствора.
- •Описание прибора:
- •Ход работы:
- •Форма записи:
- •Форма записи:
- •Формулы для расчета.
- •Электролитическая диссоциация. Реакции ионного обмена
- •Водородный показатель. Гидролиз солей
- •2. Гидролиз солей
- •Окислительно-восстановительные реакции
- •Классификация овр:
- •Гальванические элементы
- •Описание прибора
- •Электролиз
- •Химические свойства металлов
- •Коррозия металлов и борьба с ней
- •Определение временной и общей жесткости воды
- •Реактивы, посуда, оборудование
Определение эквивалента и эквивалентной массы металла по водороду
Цель работы: практически, опытным путем научиться определять эквивалент и эквивалентную массу металла по объему газа, выделенного в ходе реакции. Научиться проводить различные рациональные расчеты с использованием закона эквивалентов.
Теоретическая часть.
Из закона постоянства состава, кратных и объемных отношений следует, что элементы соединяются друг с другом в строго определенных количественных соотношениях, которые называют эквивалентами или эквивалентными массами.
Для определения эквивалентов и эквивалентных масс нужно знать, что такое моль и мольная масса.
Моль- это количество вещества, в котором содержится число частиц любого определяемого сорта, равное постоянной Авогадро (6,02 .1023). Например: 3 .1024 молекул воды составят 5 моль.
Мольная (молярная) масса вещества в граммах численно равна его относительной молекулярной (атомной) массе, выраженной в атомных единицах массы (а.е.м.). Масса 1 моля вещества выражается в г/моль. Например: молярная масса Н2О и атомная масса кислорода соответственно равны 18 и 16 а.е.м., их мольные массы равны 18 г/моль и 16 г/моль. Эквивалентом элемента называется такое его количество, которое соединяется 1с молем атомов водорода или замещает то же количество атомов водорода в химических реакциях. Например, в соединениях НВг, Н2О, РН3 эквиваленты брома, кислорода, фосфора соответственно равны 1 моль, 1/2 моль, 1/3 моль.
Масса одного эквивалента называется его эквивалентной массой. Так, в приведенных выше примерах, эквивалентные массы брома, кислорода, фосфора соответственно равны 79,9 г/моль, 16:2 = 8 г/моль, 31:3= 10,3 г/моль.
Эквивалентом сложного вещества называется такое его количество, которое взаимодействует без остатка с одним эквивалентом водорода или с одним эквивалентом любого другого вещества. Расчеты, связанные с определением эквивалентных масс, проводятся по закону эквивалентов: массы (объемы) реагирующих друг с другом веществ, пропорциональны их эквивалентным массам (объемам). Математически закон выражается зависимостью:
 (1)
(1)
где: m, (V) - массы (объемы) реагирующих веществ;
Э, (Vэкв.) - эквивалентные массы (объемы).
Эквивалентную массу простого вещества можно вычислить по формуле:
![]()
где
![]() - мольная масса атома элемента,
- мольная масса атома элемента,
В - валентность элемента.
Так, например, эквивалентные массы водорода и кислорода соответственно равны:
![]()
Эквивалентный объем газа можно вычислить по формуле:
![]()
Так, например, эквивалентные объемы водорода и кислорода соответственно равны:
![]()
Эквивалентные массы сложных веществ можно вычислить по формулам:
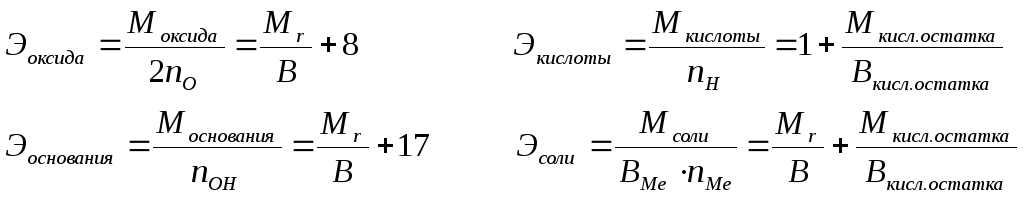 (2)
(2)
nO, nOH, nH, nMe – число атомов кислорода, гидроксильных групп, атомов водорода, металла соответственно в оксиде, основании, кислоте, соли; В – валентность, 8 – эквивалентная масса кислорода, 1 – эквивалентная масса водорода, 17 – эквивалентная масса гидроксильной группы.
В данной работе определение эквивалентной массы металла основано на измерении объема водорода, вытесненного активным металлом из разбавленной кислоты. Измеренный объем водорода при условиях опыта приводится к нормальным условиям:
![]()
Затем по формуле (1) определяют эквивалентную массу.
Рисунок и описание прибора для определения эквивалента металла
Рис.1.1
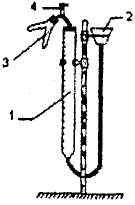
Прибор состоит из бюретки 1, соединенной резиновыми трубками с воронкой 2 и двухколенной пробиркой 3. Прибор смонтирован на штативе Бунзена.
Реактивы и посуда.
Прибор для определения эквивалента металла (рис.1.1), барометр, термометр, мерный цилиндр емкостью 10 мл, воронка, 10 % - ный раствор соляной кислоты, металлический магний.
Практическая часть
1. В одно колено пробирки 3 внесите магний, а в другое колено пробирки через воронку налейте около 12мл 10%- ного раствора соляной кислоты. Наденьте двухколенную пробирку на пробку, соединенную резиновой трубкой с бюреткой.
2. Необходимым условием протекания опыта является герметичность всей системы, поэтому проверьте прибор на герметичность. Для этого воронку 2 опустите или поднимите на 25-30 см и держите на одном уровне 1 -2 минуты. Если уровень воды в бюретке 1 не изменится за это время, то прибор герметичен. Если же уровень воды в бюретке будет снижаться или подниматься до уровня воды в воронке, то вращательными движениями добейтесь плотного прилегания всех пробок и снова проверьте герметичность прибора.
3. Убедившись в герметичности прибора, отметьте уровень воды в бюретке 1, а затем постепенно (первая порция кислоты должна быть небольшой во избежание бурного выделения газа) наклоните двухколенную пробирку так, чтобы кислота перелилась в колено с магнием.
4. По окончании реакции подождите 1 минуту, пока газ примет температуру помещения и измерьте объем водорода, вытесненного магнием. Для этого установите воронку на такой высоте, чтобы вода в воронке и бюретке была на одном уровне, то есть газ находился при атмосферном давлении. Деление бюретки, против которого установится уровень воды, будет соответствовать объему выделившегося водорода при условиях проведения опыта. ( Если в начале опыта уровень воды находился не на нулевой отметке, то из конечного показания уровня воды надо вычесть число, соответствующее начальному уровню воды). В таблицу 1.1 запишите значения указанных в ней величин.
Таблица 1.1 Параметры для расчета эквивалента металла.
|
m, г |
P, Па |
Т, К
|
V , мл |
Р0, Па |
Т0, К
|
V0, мл |
h, Па |
|
|
|
|
|
|
|
|
|
Определите давление Р по барометру и температуру Т по термометру.
Давление насыщенного водяного пара h, соответствующее температуре опыта Т, выпишите из следующей таблицы:
Таблица 1.2 Давление насыщенного водяного пара при различных температурах
|
Т, К |
h, Па |
|
293 |
2300 |
|
294 |
2500 |
|
295 |
2700 |
|
296 |
2900 |
|
297 |
3100 |
|
298 |
3300 |
|
299 |
3500 |
|
300 |
3700 |
Р0 - давление при нормальных условиях, равное 101325 Па;
Т0 - температура при нормальных условиях, равная 273 К.
Расчет
Напишите уравнение реакции магния с соляной кислотой.
Измеренный объем водорода V приведите к нормальным условиям по уравнению Клапейрона (3):
![]()
Из математического выражения (1) закона эквивалентов определите эквивалентную массу магния:
![]()
Определите теоретическое значение эквивалентной массы магния по формуле:
![]()
где
![]() - мольная масса металла, В валентность
металла.
- мольная масса металла, В валентность
металла.
Сравните полученное практическое значение эквивалентной массы Э магния с теоретическим значением Эт.
Рассчитайте процент относительной ошибки опыта по формуле:
![]()
Указания по технике безопасности
Необходимым условием протекания опыта является герметичность всей системы. Она в основном определяется тем, насколько плотно прилегают пробки к двухколенной пробирке и бюретке. При проверке герметичности прибора во избежание порезов рук стеклом, которые могут возникнуть при чрезмерном нажиме пробки на стекло, необходимо двухколенную пробирку, пробку и бюретку держать полотенцем.
Лабораторная работа №2
