
- •Часть II. «Витамины и ферменты»
- •Введение
- •Классификация и номенклатура
- •Определение активности ферментов
- •Единицы ферментативной активности
- •Общие свойства ферментов
- •Специфичность действия ферментов
- •Влияние температуры и рН на активность ферментов
- •Активирование и ингибирование ферментов
- •Гидролазы
- •Глюкозидазы
- •Выделение– и– амилаз солода.
- •Определение декстринирующей способности–амилазы
- •Влияние температуры на осахаривающую способность–амилазы
- •Определение активности амилолитических ферментов
- •Определение активности амилазы (сывороточная амилаза крови)
- •Протеазы
- •Гидролитическое расщепление казеина под действием пепсина.
- •Определение активности протеаз по методу Ансона
- •Определение активности протеолитических ферментов
- •Определение протеолитической способности (пс)
- •Определение протеолитической активности молокосвертывающих препаратов
- •Эстеразы
- •Гидролитическое расщепление жира под действием липазы
- •Определение активности липазы
- •Ер на воздушно–сухое вещество
- •Определение сахаров по Бертрану
- •Список использованных источников
- •Часть II."Витамины и ферменты". Раздел I."Ферменты".
Определение декстринирующей способности–амилазы
Принцип действия. При действии на крахмал –амилазы: образуется большое количество декстринов разного молекулярного веса, по–разному окрашивающихся йодом – амилодекстрины, эритродекстрины, ахродекстрины, мальтодекстрины.
Ход работы. В шесть пробирок вносят по 5 мл 2 %–ного раствора растворимого крахмала. В каждую пробирку добавляют по 1 мл буферного раствора с рН 5,6. Раствор фермента и воду вносят в количествах, указанных в таблице 2:
Растворы в пробирках хорошо перемешивают и ставят в термостат при 40 С. Глубину гидролиза крахмала контролируют по четвертой пробирке. Для этого из нее стеклянной палочкой периодически отбирают пробы на белую кафельную плитку, добавляя к ней раствор Люголя. Первый отбор пробы делают через пять минут после термостатирования. Пробирки выдерживают в термостате до тех пор, пока проба из четвертой пробирки не окрасится в красно–бурый цвет, что свидетельствует об образовании в этой пробирке эритродекстринов.
Таблица 2 – Основные параметры опыта и его результаты
|
№ пробирки |
1 |
2 |
3 |
4 |
5 |
6 |
|
Количество фермента, мл |
– |
0,2 |
0,4 |
0,6 |
0,8 |
1,0 |
|
Количество воды, мл |
4 |
3,8 |
3,6 |
3,4 |
3,2 |
3,0 |
|
Образовавшиеся декстрины |
|
|
|
|
|
|
После этого в каждую пробирку добавляют по 2–3 капли раствора йода и 20 %–ного раствора соляной кислоты для остановки гидролиза крахмала. Содержимое пробирок окрашивается в различные цвета: от синего в первой пробирке с крахмалом до желтого – в последней, через фиолетовый и красно–бурый.
Анализируя окраску с йодом, в таблицу 2 следует записать, до каких декстринов прошел гидролиз крахмала в каждой пробирке в зависимости от количества фермента.
Материалы и реактивы. Солод; 0,1 н раствор HCI; 0,15 М раствор фосфата натрия (двузамещенный); 2 % – ный раствор крахмала; 0,1 М раствор фосфатного буфера, рН 5,6 (см. Приложение 1, п.3); 20 %–ный раствор НСI; раствор Люголя.
Оборудование. Термостат; холодильник; центрифуга; кафельные плитки; стеклянные палочки; пипетки на 5,10,15 мл; фарфоровые стаканы; водяная баня.
Влияние температуры на осахаривающую способность–амилазы
Каталитическая активность ферментов значительно зависит от температуры. При низкой температуре ( 0 С, 4 С) ферментативные реакции протекают с малой скоростью, а при замораживании могут и не происходить. Температурный оптимум многих ферментов лежит в пределах от 40 С до 50 С. При нагревании свыше 60–70 С ферменты инактивируются необратимо, меняя свое строение, что приводит к потере каталитической активности.
Работа выполняется коллективно всей группой, каждый студент получает индивидуальное задание при какой температуре проводить исследование. Опыты ставят при температуре 4 С (холодильник), 20 С (комнатная), 30 С, 40 С, 50 С, 60 С, 70 С (водяные бани или термостат).
Чтобы получить правильные результаты, необходимо строго соблюдать заданную температуру.
Принцип метода. Для определения осахаривающей способности, характеризующей активность – амилазы, проводят гидролиз растворимого крахмала исследуемым ферментным препаратом при рН 5,6 и различной температуре. Количество образовавшегося сахара мальтозы определяют методом Бертрана.
Метод Бертрана основан на способности свободной альдегидной или кетонной группы молекулы сахара взаимодействовать со щелочным раствором окисной меди (II) (реактивом Фелинга) и восстанавливать ее до оксида меди (I), выпадающего в виде осадка красного цвета.
По количеству образовавшегося оксида меди (I) судят о содержании сахара в испытуемом растворе.
Реактив Фелинга представляет собой смесь разных объемов 4 %–ной сернокис лой меди и щелочного раствора сегнетовой соли. При смешивании сернокислой меди со щелочью выпадает осадок гидрата окиси меди (II). Сегнетова соль препятствует выпадению осадка, образуя комплексное растворимое соединение.
В щелочной среде циклическая (полуацетальная) форма сахара полностью переходит в ациклическую и на месте свободного гликозидного гидроксила образуется альдегидная (у альдоз) или кетонная (у кетоз) группа.
Т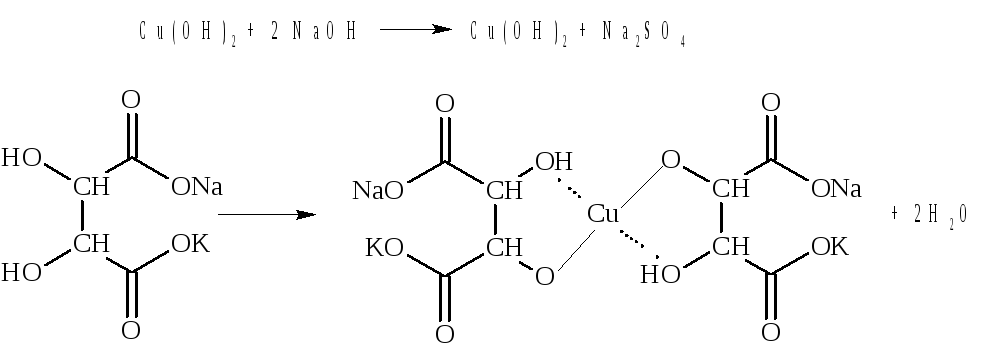 ак,
например, превращение циклической формы
мальтозы в ациклическую протекает
следующим образом:
ак,
например, превращение циклической формы
мальтозы в ациклическую протекает
следующим образом:
В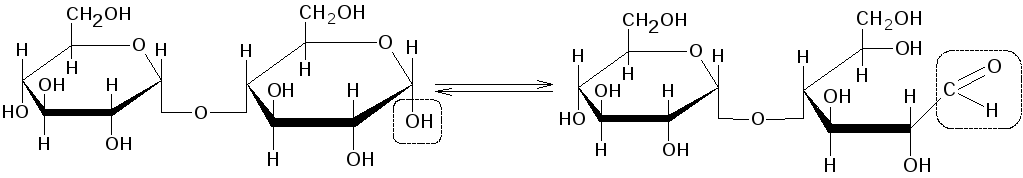 заимодействие
сахаров с реактивом Фелинга протекает
по уравнению:
заимодействие
сахаров с реактивом Фелинга протекает
по уравнению:
К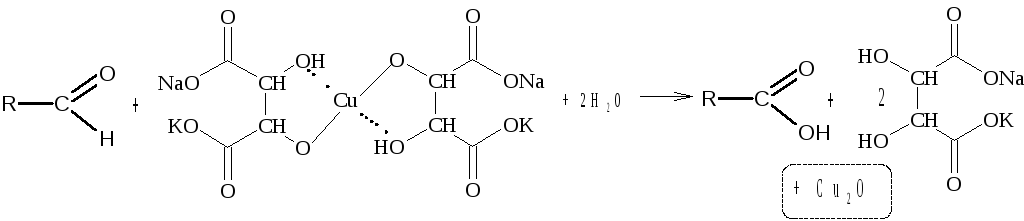 оличество
образовавшегося осадка оксида меди (I)
строго соответствует количеству сахара,
находящегося в растворе, и определяется
объемным методом. Для этого предварительно
отмытый от избытка реактива Фелинга
осадок оксида меди (I) обрабатывают
раствором железоаммиачных квасцов. При
этом медь (I) переходит в медь (II), а
эквивалентное количество железа (III)
восстанавливается до железа (II).
оличество
образовавшегося осадка оксида меди (I)
строго соответствует количеству сахара,
находящегося в растворе, и определяется
объемным методом. Для этого предварительно
отмытый от избытка реактива Фелинга
осадок оксида меди (I) обрабатывают
раствором железоаммиачных квасцов. При
этом медь (I) переходит в медь (II), а
эквивалентное количество железа (III)
восстанавливается до железа (II).
Сu+ – е Cu++
Fе+++ + е Fе++
Количество восстановленного железа, эквивалентное количеству оксида меди (I), определяют титрованием раствором перманганата. Весь процесс сводится к следующим реакциям:
Сu2О + Fе2(SО4)3 + Н2SО4––> 2 СuSО4 + 2 FеSО4 + Н2О;
10 FеSО4+2 КМnО4 + 8 Н2SО4––> 2Fе2(SО4)3+ К2SО4 +2 МnSО4 + 8 Н2О
Титр перманганата устанавливают по меди, что дает возможность сразу пересчитать объем пошедшего на титрование перманганата на эквивалентное количество миллиграммов оксида меди (I).
Ход работы. В колбу вносят 10 мл 2 % –ного крахмального клейстера и 2 мл фосфатного буфера рН 5,6. Содержимое колбы доводят до заданной температуры (нагревают или охлаждают), после чего вносят 1 мл ферментной вытяжки, предварительно термостатированной при той же температуре, и замечают время. Гидролиз проводят 30 минут, в течение которых строго следят за поддержанием заданной температуры. Через 30 мин. в колбу вносят 3 мл 6 %– ного раствора сульфата меди для прекращения действия фермента, содержимое колбы охлаждают и доводят водой до 20 мл. Количество образовавшейся мальтозы определяют методом Бертрана. Для этого в коническую колбу пипеткой отбирают 10 мл полученного гидролизата, добавляют 10 мл воды и 40 мл реактива Фелинга (смесь 20 мл Фелинга 1 и 20 мл Фелинга II).
Испытуемый раствор с жидкостью Фелинга нагревают до кипения и кипятят 3 минуты. Кипение должно идти спокойно, жидкость в колбе должна оставаться синей, что указывает на избыток реактива Фелинга, а, следовательно, и на полноту окисления.
Сняв раствор с огня, дают некоторое время для осаждения оксида меди (I), затем жидкость декантируют через асбестовый фильтр в колбу Бунзена, соединенную с отсасывающим насосом. Оксид меди (I) должен остаться в колбе, но часть его может перейти на фильтр. Осадок в колбе 3–4 раза промывают небольшими порциями горячей воды, декантируя через тот же асбестовый фильтр. Осадок в колбе и на фильтре, во избежание его окисления кислородом воздуха, должен все время находиться под жидкостью.
После отмывания осадка Сu2О от щелочи колбу Бунзена отключают от насоса, содержимое ее выливают. В чисто промытую колбу Бунзена вставляют тот же асбестовый фильтр. Промытый осадок оксида меди (I) в колбочке растворяют 15–20 мл железоаммиачных квасцов и количественно переносят на асбестовый фильтр. Для лучшего растворения осадка на фильтре верхний слой асбеста слегка разрыхляют стеклянной палочкой.
Когда осадок растворится, соединяют колбу Бунзена с насосом и отсасывают жидкость с фильтра. Колбочку, где был осадок, тщательно ополаскивают несколько раз водой, и промывные воды отсасывают в колбу Бунзена. Зеленоватый раствор в колбе Бунзена, содержащий ионы железа (II) , титруют раствором КМnО4 до слаборозовой окраски, не исчезающей в течение одной минуты. Израсходованное на титрование количество мл 0,1 н. раствора перманганата (с учетом поправки на титр) умножают на его титр по меди (6,36 мг Си2О) и по таблице (см. Приложение 2, таб.3) определяют количество мальтозы.
Мерой активности –амилазы служит количество разложившегося крахмала ферментом, содержащемся в 100 г исследуемого растительного материала (солода) в условиях опыта.
![]() , (9)
, (9)
где Х – активность фермента, %;
а– количество мальтозы, г;
0,95 – коэффициент пересчета мальтозы в крахмал;
н– навеска муки в испытуемой смеси, г.
Результаты записывают в таблицу 3 и строят график зависимости активности –амилазы от температуры.
Таблица 3 – Зависимость активности -амилазы от температуры
|
№ |
Температура, С, 0,1 н |
Количество (мл) 0,1 н КMnO4, пошедшее на титрование |
Количество меди, мг |
Количество мальтозы, г |
Активность -амилазы |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Материалы и реактивы.Ферментная вытяжка; растворимый крахмал,2 % раствор; фосфатный буфер,0,1 М раствор; сульфат меди,6 % раствор; Фелинг I – сульфат меди,4 % раствор; Фелинг II (см. Приложение 1,п.4); железоаммиачные квасцы (см. Приложение 1,п.5); перманганат калия, 0,1 н раствор.
Оборудование.Термостат; водяные бани; стеклянный фильтр; колбы Бунзена; плоскодонные колбы на 100 мл; бюретки; стеклянные палочки.
