
- •Ферменты оксидоредуктазы
- •Часть II. “Витамины и ферменты”
- •3.2.2 Определение активности пероксидазы............................................20
- •4.4 Определение активности о–дифенолоксидазы (полифенолоксидазы) и пероксидазы по Михлину и Броневицкой…..25
- •1.1 Использование неорганического фосфата в процессе брожения
- •1.2 Определение специфичности лактатдегидрогеназы
- •2 Флавиновые дегидрогеназы
- •2.1 Качественное определение активности сукцинатдегидрогеназы
- •2.2 Глюкозооксидаза (1.1.3.4)
- •2.3 Определение глюкозы с использованием фермента
- •2.4 Открытие ксантиноксидазы в молоке
- •3 Гемсодержащие ферменты - гемопротеины
- •3.1 Каталаза (1.11.1.6)
- •3.1.1 Обнаружение действие каталазы (качественно)
- •3.1.2 Определение активности каталазы по а. Н. Баху и а.И. Опарину
- •3.2 Пероксидаза (1.11.1.7)
- •3.2.1 Обнаружение действия пероксидазы (качественно)
- •3.2.2 Определение активности пероксидазы
- •4 Медь - содержащие оксидазы
- •4.1 Определение активности аскорбатоксидазы
- •4.2 Полифенолоксидаза (1.14.18.1)
- •4.3 Обнаружение действия фенолоксидазы (качественно)
- •4.4 Определение активности о - дифенолоксидазы (полифенолоксидазы) и пероксидазы по Михлину и Броневицкой
- •5 Список используемых источников
- •Приложение а
- •Значение стандартных окислительно- - восстановительных потенциалов
- •Приложение в
- •Методика приготовления реактивов
- •Часть II “Витамины и ферменты”
Министерство образования Республики Беларусь
МОГИЛЕВСКИЙ ГОСУДАРСТВЕННЫЙ ТЕХНОЛОГИЧЕСКИЙ ИНСТИТУТ
КАФЕДРА ХИМИЧЕСКОЙ ТЕХНОЛОГИИ ВЫСОКОМОЛЕКУЛЯРНЫХ СОЕДИНЕНИЙ
Ферменты оксидоредуктазы
Методические указания к лабораторному практикуму
по дисциплине ”Биохимия"
для студентов специальностей Т.18.01., Т.18.02., Т.18.03.
Часть II. “Витамины и ферменты”
Могилев 2001
УДК 557.1
Рассмотрены и утверждены
на заседании кафедры ХТВМС
протокол № 10 от 18 мая 20001г.
Составители: доц. О.Н.Макасеева
асс. Л.М.Ткаченко
Рецензенты: проф. Г.Н. Роганов
доц. В.Н. Тимофеева
© Могилевский государственный технологический институт
Содержание
С
Введение.........................................................................................................4
1 НАД+- зависимые дегидрогеназы................................................................5
1.1 Использование неорганического фосфата в процессе брожения......6
1.2 Определение специфичности лактатдегидрогеназы............................8
2Флавиновые дегидрогеназы.........................................................................9
2.1 Качественное определение активности сукцинатдегидрогеназы....10
2.2Глюкозооксидаза (1.1.3.4)....................................................................12
2.3 Определение глюкозы с использованием фермента
глюкозоксиды..........................................................................................13
2.4 Открытие ксантиноксидазы в молоке.................................................14
3 Гемсодержащие ферменты - гемопротеины..........................................16 3.1Каталаза (1.11.1.6).................................................................................17
3.1.1 Обнаружение действие каталазы (качественно).............................17
3.1.2 Определение активности каталазы по А. Н. Баху и А.И.Опарину..............................................................................................18
3.2Пероксидаза (1.11.1.7)..........................................................................18
3.2.1 Обнаружение действия пероксидазы (качественно)......................19
3.2.2 Определение активности пероксидазы............................................20
4 Медь - содержащие оксидазы....................................................................21
4.1 Определение активности аскорбатоксидазы.....................................21
4.2 Полифенолоксидаза (1.14.18.1)...........................................................23
4.3 Обнаружение действия фенолоксидазы (качественно).....................24
4.4 Определение активности о–дифенолоксидазы (полифенолоксидазы) и пероксидазы по Михлину и Броневицкой…..25
5 Список используемых источников...........................................................27
Приложение А...............................................................................................29
Приложение В............................................................................................30
Введение
К классу оксидоредуктаз относят ферменты, катализирующие окислительно–восстановительные реакции. Общая схема их может быть представлена следующим образом:
оксидоредуктаза
Субстрат + Акцептор Субстрат + Акцептор
АН2ВА ВН2
Характерной особенностью деятельности оксидоредуктаз в живой клетке является их способность образовывать системы ( так называемые цепи окислительно–восстановительных ферментов), в которых осуществляется многоступенчатый перенос атомов водорода или электронов от первичного субстрата к конечному акцептору, которым является, как правило, кислород, так что в результате образуется вода.
Другая особенность оксидоредуктаз состоит в том, что, будучи двухкомпонентными ферментами с весьма ограниченным набором активных групп (коферментов), они способны ускорять большое число самых разнообразных окислительно–восстановительных реакций. Это достигается за счет того, что один и тот же кофермент способен соединяться со многими апоферментами (белками), образуя каждый раз оксидоредуктазу, специфическую по отношению к тому или иному субстрату или акцептору.
Еще одна, пожалуй, главная особенность оксидоредуктаз заключается в том, что они ускоряют протекание химических процессов, связанных с высвобождением энергии. Последняя используется как для обеспечения синтетических процессов в организме, так и для других нужд.
Оксидоредуктазы, которые переносят атомы водорода или электроны непосредственно на кислородные атомы, носят название аэробных дегидрогеназ или оксидаз. В отличии от них оксидоредуктазы, переносящие атомы Н или электроны от одного компонента окислительной цепи ферментов к другому без передачи их на кислородные атомы, называют анаэробными дегидрогеназами или редуктазами.
Подклассы оксидоредуктаз определяются типами соединений, выступающих в качестве доноров электронов. Например, ферменты подкласса 1 катализируют окисление гидроксигрупп до карбонильных, подкласса 2 - окисление карбонильных до карбоксильных и т.д.
В отдельные подклассы выделены ферменты ( оксигеназы), катализирующие реакции введения атомов кислорода - одного, подкласс 14 (монооксигеназы) - двух, подкласс 13 (диоксигеназы) из молекулы О2.
В данном методическом указании рассмотрены более подробно строение и механизм действия оксидоредуктаз, имеющих важное значение в процессах технологической переработки пищевого сырья и при его хранении. Не менее важна роль этих ферментов в процессах дыхания живых организмов, окисления органических соединений - углеводов, липидов, белков, снабжающих клетку энергией.
1 НАД+- зависимые дегидрогеназы
Ферменты, катализирующие реакции окисления-восстановления с участием никотинамидадениндинуклеотида (НАД+), или его близкого аналога - никотинамидадениндинуклеотидфосфата (НАДФ+).
Более половины известных в настоящее время оксидоредуктаз содержат НАД+ или НАДФ+ в качестве кофермента, т.е являются двухкомпонентными, их называют пиридинпротеином. Пиридинпротеины способны отнимать от субстратов (спирты, альдегиды, кетокислоты, амины и др.) и включать в молекулу НАД+ (НАДФ+) 2 электрона и один протон ( гидрид ион Н-) (окисляя, таким образом, указанные соединения, а второй протон остается в среде, в результате чего утрачивается положительный заряд пиридинового цикла НАД+ (НАДФ+):
|
Н |
|
Н Н |
|
|
|
\ / |
|
С O |
|
С O |
|
// \ // |
|
/ \ // |
|
Н С C С- NH2 |
|
Н С C С- NH2 |
|
|
|
|
|
Н- С C- Н |
|
Н- С C- Н |
|
О \\ + / |
|
О \ / |
|
N |
|
N |
|
|
|
НО-Р- О-СН2 О |
|
|
|
NН2 |
|
|
|
Н Н |
|
|
Н-, Н+] |
О Н Н N C |
|
НО НО \ / \\ |
|
НО НО \ / \\ |
|
НО-Р= О Н-C C N |
|
НО-Р= О Н- C C N |
|
|
|
|
|
|
|
О - СН2 О NC CН |
|
|
|
\ // |
|
Н Н N |
|
Н Н N |
|
|
|
Н Н Н3РО4 |
|
|
|
НО О(Н) |
НАД+ (НАДФ+ ) НАДН (НАДФН)
Все пиридинпротеины являются анаэробными дегидрогеназами, т.е не передают снятые с субстрата атомы водорода на кислород, а передают их на ближайший в окислительной цепи другой фермент, как правило, флавопротеид.
Кофермент НАДФ+ является производным НАД+, у которого водород ОН - группы 2-го углеродного атома рибозы аденозина замещен на остаток фосфорной кислоты. Механизм окисления (своих субстратов) при участии НАДФ+в качестве кофермента аналогичен таковому при посредстве НАД+.
Несмотря на то, что реакции, катализируемые НАД+ и НАДФ+ зависимыми ферментами - дегидрогеназами обратимы, их биологическое значение в большинстве случаев связано, преимущественно, с протеканием реакции в определенном направлении. При этом отчетливо проявляется такая закономерность: если биологически значимо окисление субстрата, то в реакции в качестве окислителя чаще всего участвуют НАД+ . Если же реакция этого подкласса имеет значение для восстановления какого - либо органического соединения, то чаще всего восстановителем является НАДФН.





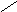

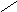 НО-Р- О-СН2
О
НО-Р- О-СН2
О



 NН2
+2Н
NН2
+2Н Н
Н
Н
Н 
 О Н
Н N C [ 2Н+,2е;
О Н
Н N C [ 2Н+,2е;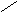
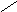
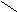
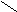

 О-
СН2
О NC
CН
О-
СН2
О NC
CН


 \
//
\
//
 Н
Н Н3РО4
Н
Н Н3РО4
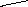 НО
О( Н)
НО
О( Н)