
- •1. Номенклатура и изомерия спиртов
- •2. Физические свойства спиртов
- •3. Химические свойства спиртов
- •1. Реакции, идущие с участием атома водорода гидроксильной группы
- •2. Реакции, идущие с замещением или отщеплением всей гидроксильной группы
- •4. Отдельные представители спиртов
- •4. Многоатомные спирты
3. Химические свойства спиртов
Спирты не обладают ярко выраженными кислотными или основными свойствами. Как сами спирты, так и их водные растворы не проводят электрический ток в заметной степени. Так как алкильная группа является донором электронов, то электронная плотность на атоме кислорода повышена и диссоциация связи О—Н проходит еще в меньшей степени, чем в молекуле воды:
![]()
Благодаря доступности и способности вступать в многочисленные химические реакции спирты играют громадную роль в различных, в том числе в промышленных, синтезах.
Реакции, в которые вступают спирты, можно разбить на следующие группы.
1. Реакции, идущие с участием атома водорода гидроксильной группы.
2. Реакции, происходящие с замещением или отщеплением всей гидроксильной группы.
3. Реакции окисления, в которых одновременно принимают участие гидроксильная группа, α-водородные атомы или даже соседние связи углерод — углерод.
1. Реакции, идущие с участием атома водорода гидроксильной группы
Атом водорода гидроксила обладает определенной подвижностью и способен к легкому замещению.
А) Замещение атома водорода в гидроксиле металлом.
Вещества, получающиеся в результате такого замещения называются алкоголятами:

Алкоголяты, образуемые метиловым спиртом, называют метилатами, образуемые этиловым спиртом — этилатами и т. д.
Алкоголяты — твердые вещества, легко растворимые в спирте. Алкоголяты натрия — нестойкие соединения, быстро темнеют (осмоляются) на воздухе, особенно при нагревании. Наиболее устойчив метилат натрия. В присутствии следов влаги алкоголяты натрия разлагаются, и вновь образуется спирт:
![]()
Реакция образования алкоголята иллюстрирует сходство спиртов с водой. Низшие спирты (СН3ОН, С2Н5ОН) реагируют с натрием бурно, средние — слабо, а высшие реагируют лишь при нагревании. Алкоголяты образуются при действии на спирты и других активных металлов, например магния, алюминия. В реакции образования алкоголята спирт проявляет свойства слабой кислоты.
Б) Замещение атома водорода в гидроксиле ацильной группой с образованием сложных эфиров.
При взаимодействии спиртов с органическими кислотами (лучше в присутствии следов сильных кислот) получаются сложные эфиры:

Реакция образования сложных эфиров называется реакцией этерификации. Реакция этерификации обратима: вода в присутствии кислот или щелочей разлагает сложные эфиры с образованием исходных веществ — кислоты и спирта. Такое гидролитическое разложение сложных эфиров называется реакцией гидролиза. Реакция этерификации, а также образующиеся в результате ее эфиры имеют очень важное промышленное значение.
2. Реакции, идущие с замещением или отщеплением всей гидроксильной группы
Гидроксильная группа спирта в некоторых реакциях обладает известной подвижностью и может замещаться или отщепляться.
А) Замещение гидроксила на галоген с образованием гадогенопроизводных углеводородов.
Обычно реакция осуществляется при действии на спирты галогенидов фосфора или серы, а также галогеноводородов:
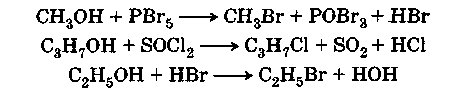
Реакция взаимодействия спирта с галогенопроизводными кислотами обратима. Чтобы добиться большего выхода, т. е. сдвинуть равновесие вправо, необходимо удалять из реакционной смеси воду. Поэтому реакцию ведут в присутствии водоотнимающих веществ, например концентрированной серной кислоты, или же в безводный спирт пропускают газообразный галогеноводород. Чтобы уменьшить количество присутствующей воды, удобнее брать не галогеноводородную кислоту, а ее соль и выделять из нее сухой галогеноводород действием концентрированной серной кислоты.
Б) Образование олефинов путем отщепления воды
При нагревании спирта с большим количеством крепкой серной кислоты или хлоридом цинка, а так же при пропускании паров спирта при 350—500 °С через трубку с оксидом алюминия происходит реакция дегидратации (отнятие воды) и образуются этиленовые углеводороды. Так, например, из этилового спирта получается этилен:
![]()
Образование молекулы воды происходит за счет гидроксила и атома водорода у соседнего атома углерода (реакция β-элиминирования).
Легче всего дегидратируются третичные, потом вторичные и затем уже первичные спирты. В спиртах сложного строения преимущественно отщепляется третичный (3-водородный атом, гораздо в меньшей степени — вторичный, и практически не отщепляется первичный (правило Зайцева):
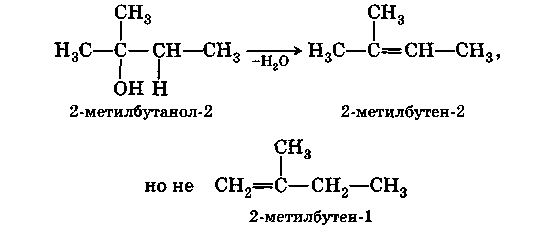
В) Межмолекулярная дегидратация.
При нагревании избытка спирта с серной кислотой или при пропускании паров спирта через порошкообразный безводный сульфат алюминия при 200°С наряду с этиленовыми углеводородами получаются и простые эфиры:
![]()
Г) Замена гидроксида на аминогруппу. В жестких условиях (300 °С, оксид алюминия) гидроксильная группа спиртов может быть заменена на аминогруппу с образованием первичных аминов:
![]()
Реакция осложняется образованием вторичных (R2NН) и третичных (R3N) аминов в результате взаимодействия спирта с уже образовавшимися аминами.
Реакции окисления, в которых одновременно принимают участие гидроксильная группа, α-водородные атомы или даже соседние связи углерод — углерод
А) Отщепление водорода (дегидрогенизация, дегидрирование).
При пропускании паров спирта при 200—300°С над мелко раздробленной медью или серебром первичные спирты превращаются в альдегиды, а вторичные — в кетоны. Реакция идет с выделением водорода:

Б) Окисление спиртов.
Окисление обычно проводят сильными окислителями, например К2Сг207 + Н2SО4 или КМп04 + + Н2SО4. При окислении спиртов действие окислителя направляется на тот углеродный атом, который уже связан с гидроксильной группой. Следовательно, в зависимости от того, какой спирт окисляется — первичный, вторичный или третичный, получаются различные продукты окисления.
При окислении вторичных спиртов образуются кетоны:

Окисление первичных спиртов происходит аналогично, но так как в первичных спиртах у углеродного атома, связанного с гидроксилом, на один атом водорода больше, чем во вторичных, то продуктами окисления в этом случае являются альдегиды:
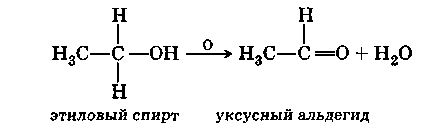
Эту реакцию трудно осуществить с высоким выходом из-за легкой окисляемости образовавшегося альдегида до соответствующей карбоновой кислоты.
