
ОРГАНИЧЕСКАЯ ХИМИЯ / органическая химия / арены
.rtfАРОМАТИЧЕСКИЕ УГЛЕВОДОРОДЫ
К ароматическим соединениям, или аренам, относится большая группа соединений, молекулы которых содержат устойчивую циклическую группировку (бензольное кольцо), обладающую особыми физическими и химическими свойствами.
К таким соединениям относятся прежде всего бензол и его многочисленные производные.
Термин "ароматические" вначале использовался применительно к продуктам природного происхождения, которые имели ароматный запах. Поскольку среди этих соединений было много таких, которые включали бензольные кольца, термин "ароматические" стали применять к любым соединениям (в том числе имеющих и неприятный запах), содержащих бензольное кольцо.
Бензол, его электронное строение
По формуле бензола С6Н6 можно предположить, что бензол является сильно ненасыщенным соединением, аналогичным, например, ацетилену. Однако химические свойства бензола не подтверждают такого предположения. Так, при обычных условиях, бензол не дает реакций, характерных для непредельных углеводородов: не вступает в реакции присоединения с галогенводородами, не обесцвечивает раствор марганцево-кислого калия. В то же время бензол вступает в реакции замещения аналогично предельным углеводородам.
Эти факты говорят о том, что, бензол частично сходен с предельными, частично с непредельными углеводородами и в то же время отличается от тех и других. Поэтому в течение длительного времени между учеными происходили оживленные дискуссии по вопросу о строении бензола.
В 60-е гг. прошлого столетия большинство химиков признали теорию циклического строения бензола на основании факта, что однозамещенные производные бензола (например, бромбензол) не имеют изомеров.
Наибольшее признание получила формула бензола, предложенная в 1865 г. немецким химиком Кекуле, в которой двойные связи в кольце углеродных атомов бензола чередуются с простыми, причем, по гипотезе Кекуле, простые и двойные связи непрерывно перемещаются:
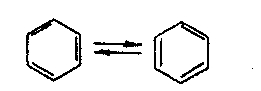
Однако формула Кекуле не может объяснить, почему бензол не проявляет свойств непредельных соединений.
Согласно современным представлениям молекула бензола имеет строение плоского шестиугольника, стороны которого равны между собой и составляют 0,140 нм. Это расстояние является средним значением между величинами 0,154 нм (длина одинарной связи) и 0,134 нм (длина двойной связи). Не только углеродные атомы, но и связанные с ними шесть атомов водорода лежат в одной плоскости. Углы, образованные связями Н — С — С и С — С — С равны 120 °.

Атомы углерода в бензоле находятся в sр2-гибрндизации, т.е. из четырех орбиталей атома углерода гибридизированными являются только три (одна 2s- и две 2 р-), которые принимают участие в образовании σ-связей между углеродными атомами. Четвертая 2 р-орбиталь перекрывается с 2 р -орбиталями двух соседних углеродных атомов (справа и слева), шесть делокализованных π-электронов, находящихся на гантелеобразных орбиталях, оси которых перпендикулярны плоскости бензольного кольца, образуют единую устойчивую замкнутую электронную систему.
В результате образования замкнутой электронной системы всеми шестью углеродными атомами, происходит "выравнивание" простых и двойных связей, т.е. в молекуле бензола отсутствуют классические двойные и одинарные связи. Равномерное распределение π-электронной плотности между всеми углеродными атомами и является причиной высокой устойчивости молекулы бензола. Чтобы подчеркнуть выравненность π-электронной плотности в молекуле бензола, прибегают к такой формуле:

Номенклатура и изомерия ароматических углеводородов ряда бензола
Общая формула гомологического ряда бензола СnН2n-6.
Первый гомолог бензола — метилбензол, или толуол, С7Н8

не имеет изомеров положения, как и все другие однозамещенные производные.
Второй гомолог С8Н10 может существовать в четырех изомерных формах: этилбензол С6Н5—С2Н5 и три диметилбензола, или ксилола, СбН4(СН3)2 (орто-, мета- и пара-ксилолы, или 1,2-, 1,3- и 1,4-диметилбензолы):

Радикал (остаток) бензола С6Н5— носит название фенил; названия радикалов гомологов бензола производят от названий соответствующих углеводородов, добавляя к корню суффикс -ил (толил, ксилил и т. д.) и обозначая буквами (о-, м-, п-) или цифрами положение боковых цепей. Общее название для всех ароматических радикалов арилы аналогично названию алкилы для радикалов алканов. Радикал С6Н5—СН2— называется бензил.
Называя более сложные производные бензола из возможных порядков нумерации выбирают тот, при котором сумма цифр номеров заместителей будет наименьшей. Например, диметил этил бензол строения

следует назвать1,4-диметил-2-этилбензол (сумма цифр равна 7), а не 1,4-диметил-6-этилбензол (сумма цифр равна 11).
Названия высших гомологов бензола часто производят не от названия ароматического ядра, а от названия боковой цепи, т. е. рассматривают их как производные алканов:

Физические свойства ароматических углеводородов ряда бензола
Низшие члены гомологического ряда бензола представляют собой бесцветные жидкости с характерным запахом. Плотность и показатель преломления у них значительно выше, чем у алканов и алкенов. Температура плавления тоже заметно выше. Из-за высокого содержания углерода все ароматические соединения горят сильно коптящим пламенем. Все ароматические углеводороды нерастворимы в воде и хорошо растворимы в большинстве органических растворителей: многие из них хорошо перегоняются с водяным паром.
Химические свойства ароматических углеводородов ряда бензола
Для ароматических углеводородов наиболее характерны реакции замещения водорода в ароматическом кольце. В реакции присоединения ароматические углеводороды вступают с большим трудом при жестких условиях. Отличительной особенностью бензола является его значительная стойкость по отношению к окислителям.
Реакции присоединения
-
Присоединение водорода
В отдельных редких случаях бензол способен к реакциям присоединения. Гидрирование, т. е. присоединение водорода, происходит при действии водорода в жестких условиях в присутствии катализаторов (Ni, Pt, Pd). При этом молекула бензола присоединяет три молекулы водорода с образованием циклогексана:

-
Присоединение галогенов
Если раствор хлора в бензоле подвергнуть действию солнечного света или ультрафиолетовых лучей, то происходит радикальное присоединение трех молекул галогена с образованием сложной смеси стереоизомеров гексахлорциклогексана:
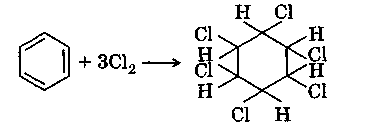
Гексахлорциклогексаи (товарное название гексахлоран) в настоящее время находит применение как инсектицид — вещества, уничтожающие насекомых, являющихся вредителями сельского хозяйства.
Реакции окисления
Бензол еще более стоек к действию окислителей, чем предельные углеводороды. Он не окисляется разбавленной азотной кислотой, раствором КМпО4 и т.д. Гомологи бензола окисляются значительно легче. Но и в них бензольное ядро относительно более устойчиво к действию окислителей, чем соединенные с ним углеводородные радикалы. Существует правило: любой гомолог бензола с одной боковой цепью окисляется в одноосновную (бензойную) кислоту:

Гомологи бензола с несколькими боковыми цепями любой сложности окисляются с образованием многоосновных ароматических кислот:
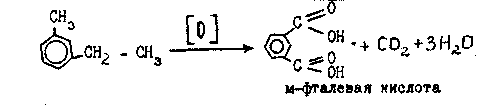
Реакции замещения
1. Галогенирование
В обычных условиях ароматические углеводороды практически не реагируют с галогенами; бензол не обесцвечивает бромной воды, но в присутствии катализаторов (FeCl3, FеВг3, АlCl3) в безводной среде хлор и бром энергично вступают в реакцию с бензолом при комнатной температуре:

-
Реакция нитрования
Для реакции применяют концентрированную азотную кислоту, часто в смеси с концентрированной серной кислотой (катализатор):

В незамещенном бензоле реакционная способность всех шести атомов углерода в реакциях замещения одинакова; заместители могут присоединяться к любому углеродному атому. Если же в бензольном ядре уже имеется заместитель, то под его влиянием состояние ядра изменяется, и положение, в которое вступает любой новый заместитель, зависит от природы первого заместителя. Из этого следует, что каждый заместитель в бензольном ядре проявляет определенное направляющее (ориентирующее) влияние и способствует введению новых заместителей лишь в определенные по отношению к себе положения.
По направляющему влиянию различные заместители подразделяются на две группы:
а) заместители первого рода:
![]()
Они направляют любой новый заместитель в орто- и пара-положения по отношению к себе. При этом они почти все уменьшают устойчивость ароматической группировки и облегчают как реакции замещения, так и реакции бензольного ядра:

б) заместители второго рода:
![]()
Они направляют любой новый заместитель в мета-положение по отношению к себе. Они увеличивают устойчивость ароматической группировки и затрудняют реакции замещения:

Таким образом, ароматический характер бензола (и других аренов) выражается в том, что это соединение, по составу являясь непредельным, в целом ряде химических реакций проявляет себя как предельное соединение, для него характерны химическая устойчивость, трудность реакций присоединения. Только в особых условиях (катализаторы, облучение) бензол ведет себя так, как будто в его молекуле имеются три двойные связи.
