Простые эфиры
Эфиры представляют собой продукты замещения атома водорода гидроксильной группы спиртов или фенолов на какой-либо радикал:
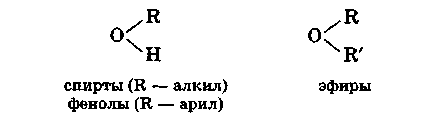
В зависимости от характера радикала R´ различают три типа эфиров:
1) простые эфиры, R´ — углеводородный радикал;
2) сложные эфиры неорганических кислот, R´ — остаток неорганической кислородсодержащей кислоты: азотной (—NO2), азотистой (—N0), серной (—S03Н) и т. п.;
3) сложные эфиры карбоновых кислот, R´ — остаток карбоновой кислоты — ацил, например СН3СО—, С2Н5СО— и т. д/
1. Номенклатура и изомерия простых эфиров
Согласно номенклатуре ИЮПАК, простые эфиры называют двумя способами, прибавляя к названию старшего (наиболее длинного) углеводородного радикала в качестве префикса название алкоксигруппы (R—О—) или для эфиров фенолов — арилоксигруппы (Аг—О—), например:
![]()
Простые эфиры называют также, используя название радикалов и слово эфир:
![]()
Физические свойства простых эфиров
Температура кипения простых эфиров значительно ниже, чем соответствующих спиртов, несмотря на то, что эфиры содержат большее число атомов углерода. Это объясняется тем, что из-за отсутствия подвижного атома водорода они не образуют водородных связей. Низшие члены гомологического ряда хорошо растворимы в воде [диметиловый эфир и тетрагидрофуран смешиваются с ней, диэтиловый эфир умеренно растворим в воде (6%)].
Химические свойства простых эфиров
Реакционная способность эфиров невелика. Они не изменяются при нагревании с водой, щелочами и разбавленными кислотами. В отличие от спиртов, при взаимодействии с металлическим натрием в обычных условиях они не выделяют водород. Только концентрированная йодоводородная кислота разлагает эфиры:
![]()
При хранении, особенно на свету, простые эфиры медленно окисляются кислородом воздуха, образуя крайне взрывчатые гидроперекиси, что может послужить причиной серьезного несчастного случая при перегонке эфиров:
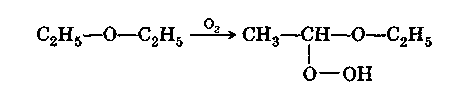
Своеобразно отношение простых эфиров к концентрированным протонным кислотам: эфиры растворяются в них с выделением теплоты. При этом образуются непрочные соединения солеобразного характера — оксониевые соединения.
Образование оксониевых соединений можно представить следующим образом. У эфирного атома кислорода имеется пара неподеленных электронов: протон кислоты образует связь с этой парой, в результате чего получается непрочный положительно заряженный ион оксония:
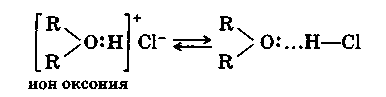
Оксониевая соль находится в равновесии с системой, состоящей из молекул эфира и кислоты, связанных водородной связью. Этим можно объяснить малую электрическую проводимость оксониевых солей.
Простые эфиры фенолов
Простые эфиры фенолов

Простые эфиры фенолов, как и простые эфиры спиртов, мало реакционноспособные соединения, но разрыв связи С—О в них происходит все же несколько легче. Отщепление алкильной группы можно осуществить действием А1С13 или концентрированной НВг, расщепление проходит всегда с образованием фенола и алкилгалогенида:
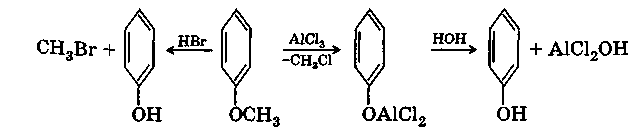
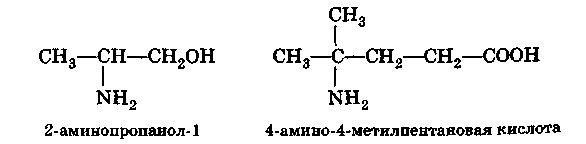
Классификация, номенклатура, изомерия аминов
Аминами называются производные углеводородов, образованные замещением в последних атомов водорода на группы —NН2, —NHR' или — NR'R":
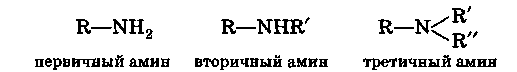
В зависимости от числа атомов водорода у атома азота, замещенных радикалами, амины называются первичными, вторичными или третичными. При этом не имеет значения, какие радикалы (первичные, вторичные или третичные) являются заместителями.
Группа —NН2, входящая в состав первичных аминов, называется аминогруппой. Группа >NН во вторичных аминах называется иминогруппой.
Номенклатура аминов:
1. Названия аминов обычно производят от названий входящих в них радикалов с присоединением окончания –амин: метиламин СН3— NН2, диметиламин (СН3)2—NН, триметил-амин (СН3)3N, пропиламин СН3СН2СН2 NН2 и т. д.
2. В более сложных случаях аминогруппу рассматривают как функциональную группу и ее название амино- ставят перед названием основной цепи (ИЮПАК):